丹参酮ⅡA抗ApoE-/-小鼠冠心病伴抑郁的作用及机制研究
2022-05-20孔俊虹陈弦沙晨曦龚楚桥宋晓龙
孔俊虹,陈弦,沙晨曦,龚楚桥,宋晓龙
(1.南京中医药大学附属常州市中医医院,江苏 常州 213003;2.盐城市中医院心内科,江苏 盐城 224001)
冠心病即冠状动脉粥样硬化性心脏病,是由于冠状动脉粥样硬化引起的管腔狭窄或闭塞,导致心脏组织缺氧、缺血或坏死而引起的缺血性心脏病。抑郁症已被认为是冠心病一个重要的独立危险因素。越来越多的证据表明冠心病患者的抑郁症患病率非常高,在冠状动脉旁路移植术或心肌梗死后,重度抑郁症的发生率约为15%,外加较轻度的抑郁症,发病率超过了40%[1-2]。合并抑郁症会导致冠心病患者出现不良结局的风险增加,如较差的运动耐受性、较低的治疗依从性、较差的生活质量及认知能力下降等[3-7],死亡的相对风险也会增加。
炎症在冠心病和抑郁症的病理学中起着关键作用,是冠心病的一个核心特征,在所有动脉粥样硬化阶段(从动脉粥样硬化斑块的起始到传播和激活,最终导致血栓形成)中都起着关键作用。研究表明,与健康受试者相比,冠心病患者表现出更高的炎症标志物及促炎基因表达[8-10]。促炎基因在抑郁症患者中表达显著增加[11-12]。GSK3β通过差异影响转录因子NF-κB亚基p65和CREB与共激活因子CREB结合蛋白(CBP)的相互作用来调节炎症反应[13-14]。研究表明,丹参酮ⅡA对GSK3β活性具有一定的抑制作用,其通过增加GSK3β的磷酸化,抑制了NF-κB的磷酸化,导致促炎因子IL-6和TNF-α表达降低,发挥了抗炎活性[15]。本研究构建了ApoE-/-小鼠冠心病合并抑郁模型,后给予丹参酮ⅡA,通过检测炎症相关蛋白的表达,探讨丹参酮ⅡA抗冠心病伴抑郁的可能机制。同时也为丹参酮ⅡA在心血管疾病中的应用提供数据支持。
1 材料与方法
1.1 动物
36只雄性SPF级ApoE-/-小鼠,8周龄,体质量21~25 g,购自常州卡文斯实验动物有限公司,许可证号:SCXK(苏)2016-0010。实验过程经南京中医药大学伦理委员会批准,批准文号:201901A055。动物饲养于南京中医药大学实验动物中心,自由饮食和饮水,恒温(21.0±2.0)℃,恒湿(55.0±5.0)%,保持12 h光照和黑暗交替循环。
1.2 主要试剂及仪器
1.2.1 主要试剂 丹参酮ⅡA(上海麦克林生化科技有限公司,批号:S819421);高脂饲料(0.15%胆固醇+21%猪油+78.85%基础饲料);油红O染料(上海麦克林生化科技有限公司,批号:S817380);苏木素-伊红(HE)染液、BCA蛋白浓度测定试剂盒、RIPA强裂解液、磷酸酶抑制剂(碧云天生物技术公司,批号:C0105S、P0012S、P0013B、P1081);TC、TG含量检测试剂盒(北京索莱宝科技有限公司,批号:BC1980、BC0620);HDL-C、LDL-C、IL-1β、IL-6、TNF-α、IL-10 ELISA检测试剂盒(上海茁彩生物科技有限公司,批号:ZC38176、ZC38098、ZC-37974、ZC-37988、ZC-39024、ZC-37962);NF-κB、p-NF-κB、GSK3β、p-GSK3β(Ser9)、CREB、p-CREB(Ser133)单克隆抗体(CST公司,批号:8242S、3033S、9315S、9331S、9197S、9198S);GAPDH单克隆抗体、二抗、ECL发光液(Affinity公司,批号:AF7021、S0001、K002)。
1.2.2 主要仪器 精密天平(Shimadzu,型号:AUW-220D);全波长酶标仪(Thermo Fisher,型号:51119570);低温离心机(Thermo Fisher,型号:Micro CL21R);电泳及转膜系统(Bio-Rad,型号:041BR121667);Tanon凝胶成像系统(上海天能,型号:Tanon-4600);生物倒置显微镜(Olympus,型号:IX3-SVR);旷场实验设备(上海吉量,型号:JLBehv-LA);强迫游泳实验设备、悬尾实验设备(上海然哲,型号:RZ-Forced S、RZ-Tail Suspension);心电图实验设备(珠海宏邦,型号:HB1003);高通量组织匀浆机(宁波新芝,型号:Scientz-48);全自动生物组织脱水机、染色机、生物组织冷冻包埋机、生物组织摊片机、生物组织烤片机(金华益迪,型号:YD-12P2、YD-700、YD-6L、YD-A、YD-B);切片机(Leica,型号:RM2235)。
1.3 造模及干预方法
36只ApoE-/-小鼠适应性饲养1周后,随机分为正常组、模型组、丹参酮ⅡA低剂量(30 mg·kg-1)组、丹参酮ⅡA高剂量(60 mg·kg-1)组[16],每组9只。正常组小鼠给予普通饲料饲喂,其他组小鼠给予高脂饲料饲喂,持续饲喂12周。第1周开始进行慢性不可预知温和应激(CUMS)造模[17],持续4周,构建冠心病伴抑郁小鼠模型。给药组从第5周开始每日灌胃给药1次,持续给药8周,正常组和模型组灌胃蒸馏水。末次给药结束1 h后,即进行心电图测试和行为学实验。测试完成后,小鼠禁食不禁水12 h,腹腔注射3%巴比妥钠40 mg·kg-1进行麻醉,摘眼球取血,随后分离靠近心脏的主动脉窦部,一部分保存在4%多聚甲醛中,一部分进行冰冻切片进行油红O染色,剩余部分保存于-80 ℃冰箱中,用于提取蛋白质进行Western blot分析。快速断头取脑,取小鼠右侧大脑海马区域组织,用于提取蛋白质进行Western blot分析。血液样本室温下静置1 h后,900×g离心15 min,上层血清保存于-80 ℃冰箱中,用于生化指标检测。
1.4 心电图检查
给药结束后,将小鼠麻醉并仰卧固定在鼠板上,将肢导联的电极夹子按照“左上肢黄色、左下肢绿色、右上肢红色、右下肢黑色”的顺序夹住小鼠爪子掌心部位,调节电压为心电图纸10 mm=1 mV,待小鼠心跳稳定且肢导联稳定,不受小鼠呼吸影响后,开始记录小鼠心电图变化。
1.5 行为学测试
1.5.1 强迫游泳实验(FST) 给药结束后,小鼠被单独放入一个圆形容器(高=40 cm,直径=20 cm),水位高度30 cm,水温保持在25~27 ℃。小鼠被迫游泳6 min,使用ANY-maze行为学分析设备软件采集并记录6 min中最后4 min内小鼠的不动时间。测试全程保持环境安静,排除声音对实验结果的影响。
1.5.2 糖水偏好实验(SPT) 给药结束后,将小鼠进行分笼,每笼1只,禁食禁水24 h后,给予1瓶2%蔗糖溶液和1瓶纯水。为了减小客观因素对实验的影响,实验在一个安静的地方进行测试,并于6 h后交换2个瓶子的位置,继续测试6 h后,记录蔗糖溶液和纯水的消耗量。蔗糖偏好率=蔗糖溶液消耗体积/(蔗糖溶液消耗体积+纯水消耗体积)×100%。
1.5.3 悬尾实验(TST) 给药结束后,将小鼠悬挂在离地面50 cm的钢梁上,并将胶带放于离尾巴尖端2 cm处。使用ANT-maze行为学分析设备软件采集并记录小鼠6 min内的不动行为,计算最后4 min内的总不动时间。当小鼠被动悬挂而没有任何挣扎动作时,就定义为静止不动。测试全程保持环境安静,排除声音对实验结果的影响。
1.6 HE染色
将放于4%多聚甲醛中的主动脉窦部进行脱水和石蜡包埋,使用轮转式切片机将蜡块切成4 μm的冠状切片备用。切片依次用二甲苯脱蜡,不同浓度乙醇脱水,苏木素核染色,分化液分化,伊红胞浆染色,不同浓度乙醇脱水,二甲苯透明,中性树脂封片。显微镜镜检,图像采集分析。
1.7 油红O染色
将新鲜主动脉窦部进行冰冻切片,6 μm,自然风干后4%多聚甲醛固定30 min,蒸馏水冲洗,晾干,将切片浸入油红O染液中染色10 min,镜下观察染色程度,后使用60%异丙醇进行分化,蒸馏水冲洗,苏木素复染,甘油明胶进行封片。显微镜镜检,图像采集分析。
1.8 生化指标检测
按照试剂盒说明书步骤检测血清中TC和TG的含量;使用ELISA试剂盒测定血清中HDL-C、LDL-C、IL-1β、IL-6、TNF-α及IL-10水平。
1.9 Western blot检测
将主动脉窦组织用PBS溶液清洗2遍,加入含1%PMSF和2%磷酸酶抑制剂的RIPA裂解液,使用高通量组织匀浆机进行低温研磨。匀浆在4 ℃和12 000 r·min-1下离心20 min,然后吸取上清液。根据生产说明书,使用BCA试剂盒测定上清液的蛋白质浓度。后通过12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离每个样品中等量的蛋白质,并转移到聚偏二氟乙烯(PVDF)膜上。与一抗和二抗孵育并洗涤后,使用Tanon凝胶成像系统检测蛋白质条带,并使用Image J软件分析蛋白条带的灰度值。
1.10 统计学方法
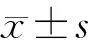
2 结果
2.1 丹参酮ⅡA对ApoE-/-小鼠心电图指标的影响
如图1所示,正常组小鼠心电图未见明显异常;与正常组相比,模型组中ST段明显抬高;与模型组相比,丹参酮ⅡA高、低剂量组小鼠心电图ST段随给药剂量增加逐渐恢复。提示丹参酮ⅡA能够改善由于冠心病引起的心电图ST段的抬高。
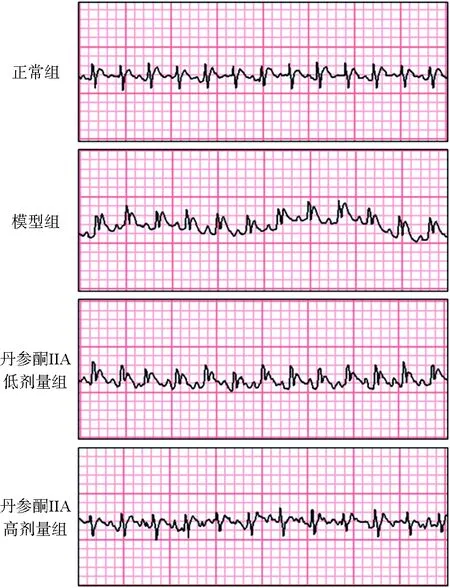
图1 丹参酮ⅡA对ApoE-/-小鼠心电图的影响Fig.1 Effect of tanshinone ⅡA on the electrocardiogram of ApoE-/- mice
2.2 丹参酮ⅡA对ApoE-/-小鼠心脏主动脉窦脂质聚集和斑块形成的影响
心脏主动脉窦经HE染色,结果如图2所示,正常组小鼠心脏主动脉窦内膜结构完整,光滑无中断,未见明显异常;与正常组相比,模型组小鼠心脏主动脉窦内膜下可见明显粥样斑块形成且大面积累及向管腔内凸起,斑块内存在泡沫细胞;与模型组相比,随着丹参酮ⅡA给药剂量的增加,组织内膜粥样斑块明显减少。油红O染色结果如图3所示,正常组小鼠心脏主动脉窦内膜下脂质积累较少;与正常组相比,模型组存在大量的脂质积累;与模型组比较,丹参酮ⅡA组随给药剂量的增加脂质积累明显减少。以上结果表明丹参酮ⅡA能有效抑制ApoE-/-小鼠主动脉窦内膜脂质积累和粥样斑块的形成。
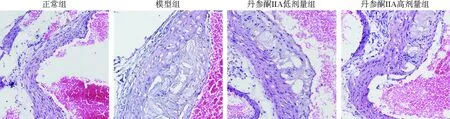
图2 丹参酮ⅡA对ApoE-/-小鼠心脏主动脉窦组织结构的影响(HE,×200)Fig.2 Effect of tanshinone ⅡA on the tissue structure of cardiac aortic sinus in ApoE-/- mice (HE,×200)
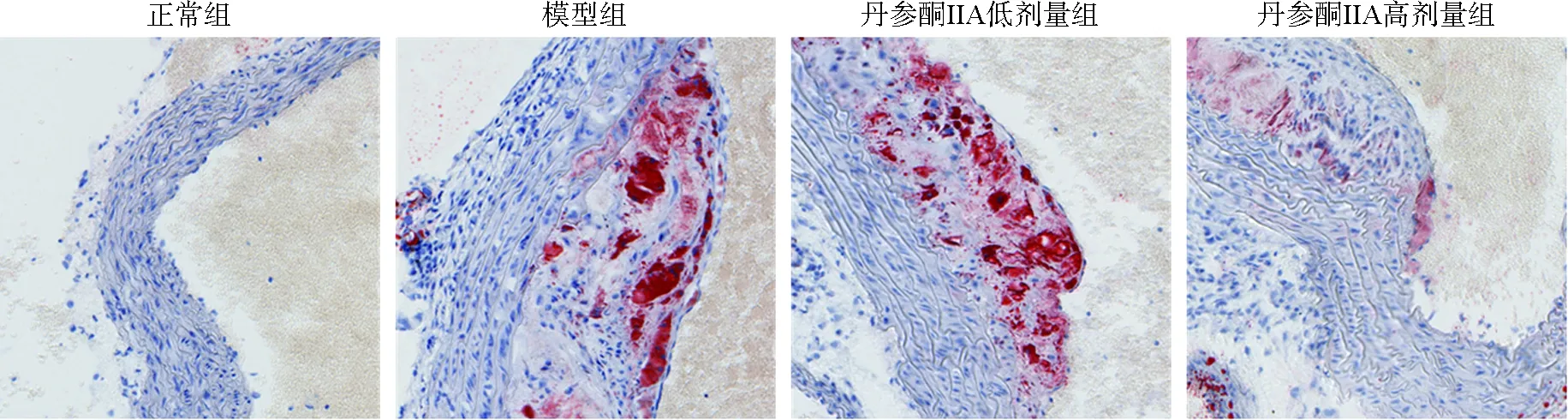
图3 丹参酮ⅡA对ApoE-/-小鼠心脏主动脉窦脂质堆积的影响(油红O,×200)Fig.3 Effect of tanshinone ⅡA on the lipid accumulation of cardiac aortic sinus in ApoE-/- mice (Oil red O,×200)
2.3 丹参酮ⅡA对ApoE-/-小鼠抑郁样行为的影响
表1结果显示,与正常组相比,模型组FST和TST的不动时间显著增加(P<0.01),且SPT蔗糖偏好率显著降低(P<0.01),表明造模成功;给予丹参酮ⅡA(30、60 mg·kg-1)治疗后,CUMS诱导小鼠FST和TST的不动时间显著减少(P<0.01),小鼠蔗糖偏好率显著增加(P<0.01),且表现出剂量依赖性。表明丹参酮ⅡA能有效改善ApoE-/-小鼠抑郁样行为。
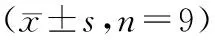
表1 丹参酮ⅡA对ApoE-/-小鼠抑郁样行为的影响Table 1 Effect of tanshinoneⅡA on the depression-like behaviors of ApoE-/- mice
2.4 丹参酮ⅡA对ApoE-/-小鼠血脂及炎症因子水平的影响
与正常组相比,模型组血清中TC、TG和LDL-C含量显著增加(P<0.01),而HDL-C含量显著降低(P<0.01);给予丹参酮ⅡA(30、60 mg·kg-1)治疗后,血清中TC、TG及LDL-C含量显著降低(P<0.01),HDL-C含量显著增加(P<0.01),且呈剂量依赖性,见表2。如表3所示,模型组血清中促炎因子IL-1β、IL-6及TNF-α的含量显著增加(P<0.01),而抗炎因子IL-10的含量显著降低(P<0.01)。丹参酮ⅡA(30、60 mg·kg-1)干预可显著降低促炎因子的水平,且增加抗炎因子的含量。以上结果表明,丹参酮ⅡA能够有效抑制ApoE-/-小鼠血清中脂质及促炎因子的增加,促进抗炎因子的释放,预防动脉粥样硬化的发生发展。
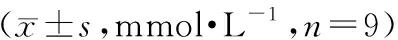
表2 丹参酮ⅡA对ApoE-/-小鼠血脂含量的影响Table 2 Effect of tanshinone ⅡA on the contents of serum lipids in ApoE-/- mice

表3 丹参酮ⅡA对ApoE-/-小鼠血清中炎症因子含量的影响Table 3 Effect of tanshinone ⅡA on the contents of serum inflammatory factors in ApoE-/- mice
2.5 丹参酮ⅡA对ApoE-/-小鼠心脏主动脉窦组织及海马组织中炎症相关蛋白表达的影响
与正常组相比,模型组心脏主动脉窦组织和海马组织中p-GSK3β(Ser9)/GSK3β和p-CREB(Ser133)/CREB的比值显著增加(P<0.01),给予丹参酮ⅡA(30、60 mg·kg-1)治疗后,p-GSK3β(Ser9)/GSK3β和p-CREB(Ser133)/CREB的比值进一步呈剂量依赖性增加(P<0.05,P<0.01)。在2种组织中,模型组p-NF-κB/NF-κB比值显著增加(P<0.01),给予丹参酮ⅡA(30、60 mg·kg-1)治疗后,p-NF-κB/NF-κB比值呈剂量依赖性降低(P<0.01)。结果见图4。
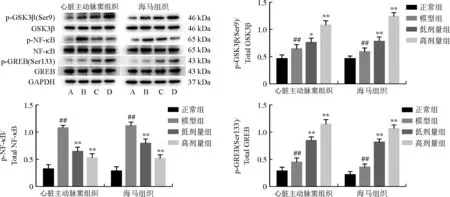
注:A.正常组;B.模型组;C.丹参酮ⅡA低剂量组;D.丹参酮ⅡA高剂量组; 与正常组相比,##P<0.01;与模型组相比,*P<0.05,**P<0.01。图4 丹参酮ⅡA对ApoE-/-小鼠心脏主动脉窦组织和海马组织炎症相关蛋白表达的影响Fig.4 Effect of tanshinone ⅡA on the expressions of inflammation related proteins in cardiac aortic sinus and hippocampus in ApoE-/- mice
3 讨论
丹参酮ⅡA是丹参酮最主要的成分之一,具有多种心血管方面的调节活性,如舒张血管、保护缺血再灌注损伤及抗心律失常等[18-20]。此外,也有不少文献报道了丹参酮ⅡA在抗炎方面的作用。丹参酮ⅡA通过促进GSK3β的磷酸化和抑制NF-κB的磷酸化,降低促炎因子IL-6和TNF-α的表达,发挥抗炎作用[15]。在糖尿病大鼠心肌缺血再灌注损伤模型中,丹参酮ⅡA预处理可减少大鼠心肌梗死面积,改善心功能障碍,降低心肌细胞凋亡和炎症水平,其机制可能与PI3K/Akt/NF-κB信号通路有关[21]。丹参酮ⅡA通过抑制NF-κB和HIF-1α的激活可减轻脂多糖(LPS)诱导的脓毒症肺损伤[22]。此外,丹参酮ⅡA还可通过抑制NLRP3炎症小体的活化发挥抗动脉粥样硬化作用[23]。丹参酮ⅡA在改善心肌细胞损伤及抗炎方面的作用表明其在抗冠心病等疾病中的潜力。研究表明,神经炎症因子通过攻击神经元细胞可能参与应激性抑郁症的发生和发展[24]。GSK3β的活化可使p-NF-κB与CBP结合能力增强,促进IL-1β、IL-6及TNF-α等促炎因子表达增加,发挥促炎作用;GSK3β活性被抑制,即p-GSK3β(Ser9)水平增加时,p-CREB(Ser133)与CBP结合能力增强,促进抗炎因子IL-10表达增加,发挥抗炎作用[13-14]。Su等[25]研究发现,在抑郁症小鼠模型中,NLRP3炎症小体能够调节CUMS诱导的MAPK通路和NF-κB蛋白复合物活性。另外,有研究表明,PI3K/Akt/GSK3β/CRMP-2信号通路介导了抑郁症中神经的可塑性[26],提示GSK3β、NF-κB等在冠心病伴抑郁中的可能作用。
本研究Western blot实验结果表明,模型组心脏主动脉窦组织和海马组织p-NF-κB/NF-κB比值较正常组显著增加,表明造模条件下,小鼠炎症水平升高;给予丹参酮ⅡA干预后,p-NF-κB/NF-κB比值被显著降低。此外,模型组p-GSK3β(Ser9)/GSK3β和p-CREB(Ser133)/CREB比值较正常组显著增加,这可能是因为机体自身的反馈性作用引起的,在外界刺激下,机体抗炎症机制被反馈性激活[13-14]。给予丹参酮ⅡA干预后,该p-GSK3β(Ser9)/GSK3β和p-CREB(Ser133)/CREB比值继续显著增加,使抗炎机制占主导作用,发挥其抗炎活性。
综上所述,本研究表明丹参酮ⅡA能够有效抑制ApoE-/-小鼠血清中脂质和促炎因子的增加,促进抗炎因子的释放,抑制ApoE-/-小鼠主动脉窦内膜脂质积累和粥样斑块的形成,改善ApoE-/-小鼠抑郁样行为。其抗冠心病伴抑郁的机制可能是通过调节GSK3β/NF-κB/CREB信号通路来实现的。
