高含硫气田采出水生化处理的微生物构效关系
2022-05-19苏三宝尚红超李春红李慧宇商剑峰
苏三宝, 尚红超, 李春红, 李慧宇, 商剑峰
(1.中原石油勘探局水务分公司, 濮阳 457001; 2.中原油田普光分公司, 达州 635002)
川东北丰富的高含硫天然气储量是支持国计民生和保障能源安全的重要资源。随着气田开发,产生大量水质复杂[高含重铬酸盐法化学需氧量(chemical oxygen demand determined by dichromate method,CODcr)、高含氨氮、高含盐]、水质变化大的采出水,需要妥善处置。随着科技进步和社会环保意识增强,处理后资源化利用是经济、社会和环境效益均较好的方法。袁增等[1]开发了蒸发-生化处理-臭氧氧化联合工艺处理气田水,实现主要指标CODcr、氨氮、氯离子达到回用标准。何绪文等[2]开发了氧化预处理-移动床生物膜反应器(moving bed biofilm reactor,MBBR)-反渗透(reverse osmosis,RO)工艺,实现高含难降解有机物的含盐焦化污水处理后回用,表明在高含盐污水资源化处理过程中,生化处理发挥重要作用。
生化处理具有效率高、经济性好、耐受高负荷能力强等优点,是高盐工业污水处理的研究热点[3]。赵天亮等[4]在实验室研究了活性污泥法处理高含盐采油废水,结果CODcr去除率可达90%以上。施云芬等[5]采用脉冲水解酸化-A/O(厌氧/好氧工艺法)中试装置处理石化废水,CODcr和氨氮的去除率分别达到80%和86%。蔡丽云等[6]使用Illumina Miseq研究了活性污泥法处理垃圾渗滤液时的细菌和真菌组成。前人研究中,一方面学者们多使用实验室规模装置,与现场规模装置差别较大,所得结果较难指导实际应用;另一方面微生物组成分析主要基于种群特征基因16S rDNA,而针对特定功能基因(如好氧氨氧化aomA基因)的研究则较少。
依托川东北高含硫气田采出水深度处理工程的缺氧/好氧池-膜生物反应池(anoxic/oxic pond-membrane bioreactor,A/O-MBR)生产装置,持续监测关键指标CODcr和氨氮,研究水质动态变化特征;使用Illumina Miseq高通量测序,不仅针对16S rDNA分析细菌组成;还针对功能基因氨单加氧酶amoA分析氨氧化细菌(ammonia oxidizing bacteria,AOB)和氨氧化古菌(ammonia oxidizing archaea,AOA)组成,研究微生物组成与水质动态变化特征相互关系;使用荧光定量PCR方法,定量分析细菌、AOB和AOA的含量,研究微生物含量与水质动态特征相互关系。通过这些研究,进一步深入认识A/O-MBR处理高含硫气田高盐采出水的关键功能菌群和代谢机理,为指导现场调整工艺运行、提高处理效率和稳定性奠定基础。
1 试验材料与方法
1.1 试验材料
主要试剂有:重铬酸钾,硫酸汞,硫酸银,浓硫酸,硫酸亚铁铵,硫酸亚铁,邻菲罗啉,碘化汞,碘化钾,氢氧化钠,氯化铵等,均为分析纯,购买自国药集团化学试剂有限公司。
主要仪器有:CODcr微波消解仪(HT-III,青岛海特尔),氨氮测定仪(5B-6D,连华科技),离子色谱仪(Aquion RFIC,Thermo Fisher)。
1.2 现场工艺
现场生产规模A/O-MBR包括容积约250 m3的缺氧池(A池)2座、约1 000 m3的好氧池(O池)2座、约200 m3的膜生物反应池(membrane bioreactor,MBR池)2座。各MBR池配备陶瓷平板膜膜塔12组,膜面积约780 m2。
高含硫气田采出水在气、水分离后,首先经过“气提除硫+化学除硫”彻底去除水中硫化物,降低安全风险;然后使用“氢氧化钠+碳酸钠”除硬,降低钙、镁离子;最后进入A/O-MBR,进行生化处理,降低CODcr和氨氮含量;MBR出水送下游脱盐处理,实现资源化利用。
A/O-MBR采用连续进水、连续出水模式运行。首先,进水与膜池回流液混合后进入A池,使用潜水搅拌机混匀,控制回流量,保持溶解氧<0.5 mg/L。然后,A池泥水混合物自然流入O池,进行曝气处理,调节曝气量,保持溶解氧范围2.0~5.0 mg/L。最后,O池泥水混合物自然流入MBR池。
MBR池运行方式为:出水9 min,反洗1 min,循环往复;单个MBR池出水流量约20 m3/h,反洗流量约30 m3/h,污泥回流量约40 m3/h;MBR运行7~10 d,跨膜压差上升至50 kPa,使用次氯酸钠和柠檬酸进行在线化学清洗。
1.3 水质分析
每天采集生化进水、MBR出水水样,开展关键水质指标CODcr、氨氮、氯离子的分析,以及氨氮降解产物亚硝酸根、硝酸根含量分析。
因为采出水高含盐,CODcr测量使用硫酸汞屏蔽-微波消解法[7]。氨氮测定参照《水质 氨氮的测定 纳氏试剂分光光度法》(HJ 535—2009)。氯离子、硝酸根、亚硝酸根使用离子色谱仪测定,参照《水质 无机阴离子的测定 离子色谱法》(HJ 84—2016)。
1.4 微生物组成分析
根据现场水质分析结果,分别于2020年8月27日和2020年11月20日,采集缺氧池、好氧池、MBR膜池泥水混合样,作为低/高氨氮去除率(LS/HS)阶段代表样品,用于微生物组成和定量分析(表1)。泥水混合样静置30 min,弃上清液,取活性污泥样品。
准确称取0.5 g活性污泥,然后使用PowerSoilRDNA Isolation Kit(MOBIO Laboratories, Inc., USA)提取细菌基因组DNA,电泳检测,-20 ℃保存,用于高通量测序和荧光定量PCR。
使用引物对515F(5’-GTGCCAGCMGCCG CG GTAA-3’)/806R(5’-GGACTACHVGGGTWTCTA AT-3’)扩增细菌16S rDNA V3-V4区[8]。使用amoA-1F(5’-GGGGTTTCTACTGGTGGT-3’)/ amoA-2R(5’-CCCCTCTGCAAAGCCTTCTTC-3’)扩增AOB的amoA基因[9]。使用Arch-amoA26F(5’-GACT ACATMTTCTAYACWGAYTGGGC-3’)/Arch-amoA417R(5′-GG KGTCATRTATGGWGG YAAYGTTGG-3′)扩增AOA的amoA基因[10]。扩增产物纯化和定量,并统一稀释到相同浓度后,使用Illumina MiSeq PE300高通量测序,测序服务由上海派森诺生物科技有限公司(上海,中国)提供。
下机数据,在QIIME2(2019.4)软件,调用DADA2(1.14.1)方法进行质控、去噪、拼接、去嵌合体;然后去重,产生单个去重的序列(ASVs),或称特征序列,以及这些序列在样本中的丰度表(特征表)[11]。对于细菌16S rDNA,物种注释选用Greengenes数据库(Release 13.8);对于AOB和AOA的amoA功能基因,使用本地化的nt数据库(ftp://ftp.ncbi.nih.gov/blast/db/)。对于注释结果,使用EXCEL手动筛选、编辑和分析。
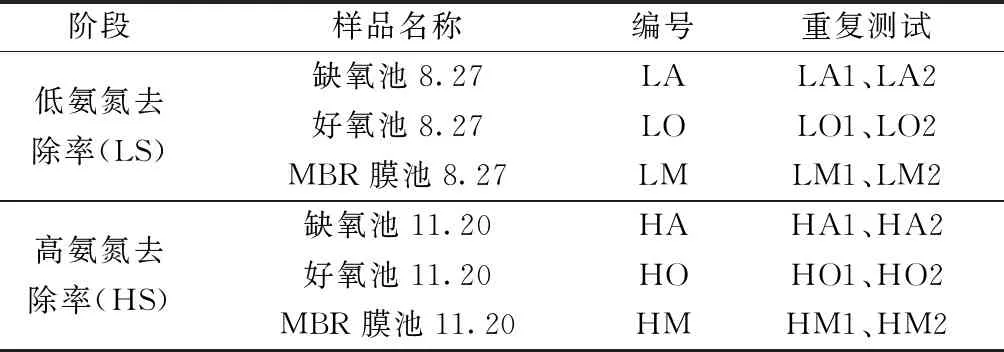
表1 微生物组成和定量分析样品
1.5 微生物含量分析
分别使用引物515F/806R、amoA-1F/amoA-2R和Arch-amoA26F/Arch-amoA417R,开展荧光定量PCR方法测量活性污泥中细菌、AOB和AOA的含量。首先,使用分别含有280 bp 16S rDNA V4片段、500 bp AOB-amoA片段和415 bp AOA-amoA片段的dsDNA质粒作为模板,并分别从3.06×108、2.85×108、2.93×108拷贝数/μL,系列稀释成为1.0×108~1.0×103拷贝数/μL,用于制备标准曲线。然后,使用实时荧光定量PCR仪(CFX96,Bio-Rad,USA),选用AceQ qPCR SYBR Green Master Mix试剂盒(JZ121—02,吉真生物),进行荧光定量PCR测试。最后,使用Bio-Rad CFX Manager软件,计算Ct值,进行结果定量分析[12]。
1.6 序列登录号
LS和HS样品的高通量测序原始结果上传至GeneBank,登录号PRJNA733682,访问地址为https://www.ncbi.nlm.nih.gov/bioproject/PRJNA733682。
2 结果与讨论
2.1 水质动态变化特征
持续监测生化进水和MBR出水的关键水质指标CODcr和氨氮含量,计算去除率,绘制变化曲线,如图1所示。

图1 MBR出水CODcr和氨氮变化曲线Fig.1 Curve of CODcr and ammonia nitrogen for MBR effluent
图1(a)显示,在整个监测周期内,MBR出水CODcr含量主要在150~300 mg/L范围波动,去除率则主要在 65%~85%波动,波动幅度相对较小。图1(b)显示,氨氮在整个监测周期内分为两个阶段,第一阶段氨氮去除率较低(LS),MBR出水氨氮含量主要在35~50 mg/L范围变化,去除率最高不足20%;第二阶段氨氮去除率较高(HS),MBR出水氨氮含量先逐步下降至10 mg/L,然后稳定在20 mg/L附近,氨氮去除率保持在60%~80%。
表2展示了A/O-MBR进水关键指标氯离子、CODcr和氨氮的特征值,其中氯离子含量最大值、最小值和平均值分别为17 105、5 073、8 788 mg/L,说明进水盐度不仅含量高,而且变化大。CODcr含量平均818 mg/L,最大值达到1 589 mg/L,说明进水有机污染物含量高。对于进水氨氮含量,LS阶段为(44.2±6.7)mg/L,HS阶段为(72.8±26.5)mg/L,说明HS阶段不仅氨氮含量更高,而且变化更大。
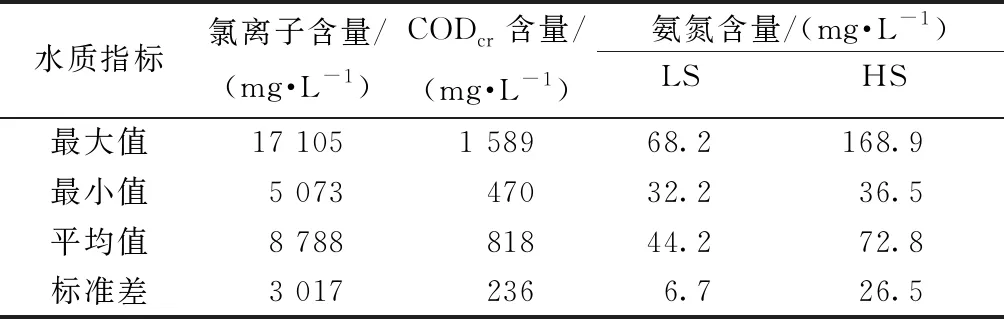
表2 A/O-MBR进水水质
MBR出水关键指标特征值如表3所示,MBR出水CODcr含量平均211 mg/L,平均去除率为72.7%。MBR出水氨氮含量,LS阶段平均43.1 mg/L,平均去除率仅5.7%;HS阶段平均20.3 mg/L,平均去除率则高达70.8%。
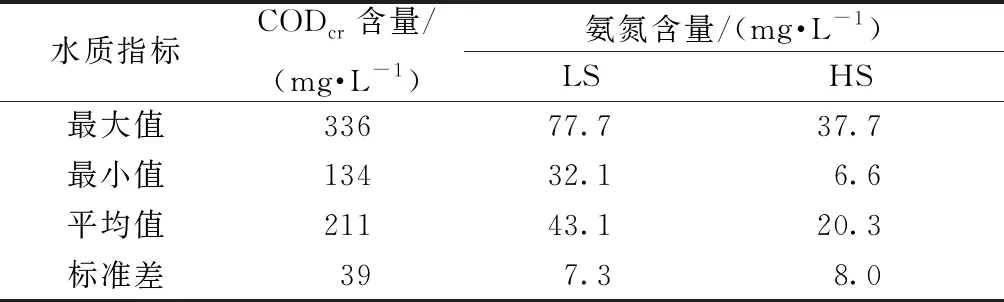
表3 A/O-MBR出水水质
A/O-MBR的CODcr平均去除率只有72.7%,略低于文献[1, 5]报道。分析原因,一方面是高含硫气田采出水含盐量高、有机污染物含量高,增加了生化处理难度;另一方面是气田生产过程中诸如酸洗清管、管道批处理、气井溶硫解堵等作业频繁,作业污水使进水水质变化大(表2),冲击A/O-MBR运行,降低CODcr平均去除率。
进一步分析了氨氮生物降解产物亚硝酸根和硝酸根含量,如图2所示。对于亚硝酸根,图2(a)显示进水一直保持极低水平,最高仅23.4 mg/L,平均仅3.72 mg/L。出水亚硝酸根也分两个阶段,在2020年11月7日之前,即LS阶段,仍是极低水平,最高仅22.4 mg/L,平均4.40 mg/L,与进水相当;结合图1(b)显示的LS阶段氨氮去除率平均仅5.7%,可推断在此阶段氨氮生物降解可忽略。2020年11月7日之后,即HS阶段,亚硝酸根含量快速增加;在10日达到最高的100.6 mg/L,随后逐步降低,并在9.42~38.7 mg/L范围波动;此阶段亚硝酸根快速增加,结合图1(b)显示HS阶段氨氮去除率平均高达70.8%,可推断在HS阶段,氨氮主要通过生物降解,即在氨氧化菌(AOB或AOA)作用下[9],氧化为亚硝酸根。
分析11月9日—11日氨氮减少量和亚硝酸根增加量,结果发现氨氮减少量为1.79 mol/L,而亚硝酸根增加量为1.76 mol/L,二者几乎相同,说明减少的氨氮通过生物降解全部转化为亚硝酸根,化学反应式为
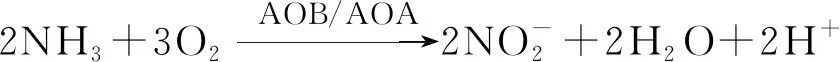
(1)
图2(b)显示了硝酸根含量变化,发现进水和出水的硝酸根均保持较低水平,平均值分别为9.43 mg/L和7.58 mg/L,差别不大。基于此,可以推断在本研究A/O-MBR中,亚硝酸盐氧化菌(NOB)的作用不明显,没有将亚硝酸根进一步氧化为硝酸根。

图2 生化进水和MBR出水的亚硝酸根和硝酸根变化曲线Fig.2 Curve of nitrite and nitrate for A/O-MBR influent and MBR effluent
进一步分析,图1(b)显示11月下旬氨氮去除率仍保持较高水平,平均71.0%;而图2(a)显示此阶段亚硝酸根含量已经逐步下降到9.42~38.7 mg/L范围,氨氮减少量显著大于亚硝酸根增加量,氮元素不能物质守恒。基于此,推断11月下旬,随着亚硝酸根含量增加,激活了反硝化菌。MBR池较大回流量(约40 m3/h),将亚硝酸根输送进入缺氧池,为异养反硝化菌在缺氧条件将亚硝酸根还原成为氮气提供了合适条件,代谢反应式为
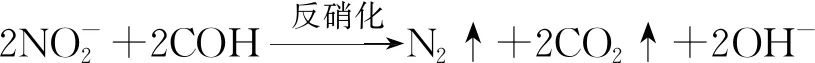
(2)
因此,A/O-MBR主要水质变化特征为进水、出水CODcr平均值分别为818、211 mg/L,平均去除率72.7%。氨氮分为低/高去除率(LS/HS)两个阶段,平均去除率分别为5.7%和70.8%。氨氮在氨氧化菌(AOB或AOA)作用下全部转化为亚硝酸根。亚硝酸根没有在NOB作用下转化为硝酸根,而是一部分在异养反硝化菌作用下转化为氮气。
2.2 细菌组成与水质动态特征相互关系
使用Illumina MiSeq高通量测序,基于16S rDNA基因,分析了细菌组成,结果如图3所示。图3(a)表明,在纲分类水平,主要包括β-变形菌(β-Proteobacteria)、α-变形菌(α-Proteobacteria)、γ-变形菌(γ-Proteobacteria)、拟杆菌(Bacteroidia)、梭菌(Clostridia)和浮霉菌(Planctomycetacia)等。分析结果显示对于LS(LA、LO和LM)和HS(HA、HO和HM)组内样品,在纲分类水平,占比虽略有波动,但变化较小,这是因为A/O-MBR运行过程中,MBR膜池污泥回流,使缺氧池、好氧池和膜池的活性污泥成为较均一的整体,只是在不同环境(缺氧条件、好氧条件)发挥不同的作用。
对于LS和HS组间样品,在纲分类水平,占比差异较大,其中LS样品的β-变形菌、α-变形菌占比分别为33.8%~35.2%和27.6%~32.2%,均显著高于HS样品的21.6%~25.7%和23.9%~29.3%;然而LS样品的γ-变形菌、拟杆菌占比分别为11.0%~12.2%和12.6%~14.9%,均显著低于HS样品的12.7%~20.8%和20.3%~24.9%。因此,LS和HS样品组间的这些差异,是产生本项目A/O-MBR水质动态特征的内在原因。
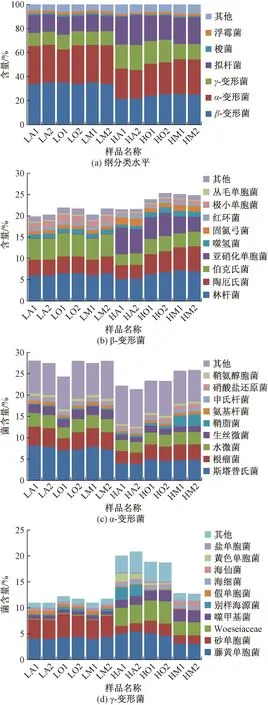
图3 细菌群落组成Fig.3 Microbial community of bacteria
在β-变形菌纲[图3(b)],优势菌为林杆菌(Limnobacter)、陶厄氏菌(Thauera)、伯克氏菌(Burkholderia),分别占比5.18%~7.25%、3.21%~5.82%和2.56%~5.44%,它们在LS和HS样品之间差异较小。研究表明,林杆菌可以降解复杂结构的酚类有机污染物[13],陶厄氏菌可用于环境修复和污水处理[14],说明它们可能在CODcr去除过程中发挥重要作用。对于亚硝化单胞菌(Nitrosomonas),在LS样品中占比0.11%~0.14%,均极低;但是在HS样品中占比3.46%~6.22%,显著升高;这说明亚硝化单胞菌占比差异,是影响A/O-MBR氨氮去除效率高低的关键因素。其他如噬氢菌(Hydrogenophaga)、固氮弓菌(Azoarcus)、红环菌(Rhodocyclus)等,占比均较少,最高只有1.78%。
图3(c)显示了α-变形菌组成,优势菌有斯塔普氏菌(Stappia)、根瘤菌(Rhizobium)、水微菌(Aquamicrobium)和生丝微菌(Hyphomicrobium),在LS样品中占比分别为6.97%~8.19%、2.93%~4.45%、2.59%~3.15%和1.85%~2.14%,均略高于HS样品的3.84%~4.93%、2.67%~3.67%、2.52%~2.92%和1.06%~1.63%。研究表明,斯塔普氏菌具有较好的好氧反硝化功能[15],水微菌可以降解联苯等复杂有机物[16],而生丝微菌可以在高含盐污水中使用甲醇反硝化代谢[17],因此水微菌可能在CODcr去除中发挥重要作用,而斯塔普氏菌和生丝微菌可能是反硝化代谢的关键功能菌。鞘脂菌(Sphingobium)、氨基杆菌(Aminobacter)、申氏杆菌(Shinella)和硝酸盐还原菌(Nitratireductor)的占比则均较少。另外,其他未分类的种属占比较高,最高达到8.99%,说明在α-变形菌纲内仍然存在大量未知的微生物,有待进一步研究。
对于γ-变形菌纲的成员[图3(d)],优势菌为藤黄单胞菌(Luteimonas)、砂单胞菌(Arenimonas)、Woeseiaceae和噬甲基菌(Methylophaga),其中藤黄单胞菌占比范围3.05%~5.37%,样品间差异较小;Cydzik-Kwiatkowska研究发现在富含双酚A的污水处理生物膜中,藤黄单胞菌占比显著增加[18]。在LS样品中砂单胞菌占比3.69%~4.51%,高于在HS样品的1.47%~2.41%;但是在LS样品中Woeseiaceae和噬甲基菌占比分别为0.15%~0.18%和0.64%~0.68%,均低于在HS样品中的2.51%~4.29%和1.54%~2.38%。研究表明,噬甲基菌是高效的耐盐反硝化菌[17]。其他如别样海源菌(Aliidiomarina)、假单胞菌(Pseudomonas)、海细菌(Marinobacterium)、海仙菌(Haliea)、黄色单胞菌(Xanthomonas)和盐单胞菌(Halomonas),占比均较低。
因此,细菌组成分析揭示关键功能菌群,在CODcr去除过程中主要有:林杆菌、陶厄氏菌、伯克氏菌、水微菌、藤黄单胞菌、砂单胞菌;在氨氮降解中主要有:亚硝化单胞菌;在反硝化代谢中主要有:斯塔普氏菌、生丝微菌和噬甲基菌。
2.3 氨氧化菌组成与氨氮去除相互关系
使用高通量测序,基于amoA基因,分析了LS(LA、LO和LM)和HS(HA、HO和HM)的氨氧化菌(AOB和AOA)组成,结果如图4所示。图4(a)显示了AOB组成,绝对优势菌是亚硝化单胞菌(Nitrosomonas),在LS样品中占比96.6%~99.8%;在HS样品中进一步增加,达到99.7%~99.9%。在LS样品中,还有少量亚硝化螺菌(Nitrosospira),率属于硝化螺旋菌门(Nitrospirae),占比最高仅2.3%。Li等[9]使用Illumina MiSeq检测了生活污水AOB富集培养物,结果主要是亚硝化单胞菌,亦有少量亚硝化螺菌。陈泽斌等人研究了滇池沉积物中AOB群落,发现优势种群为亚硝化单胞菌和亚硝化螺菌[19]。亚硝化单胞菌在LS和HS样品中均处于绝对优势地位,因此AOB组成不是影响LS/HS阶段氨氮去除率差异的主要因素。
图4(b)显示了AOA组成,优势菌是亚硝化球菌(Nitrososphaera)、亚硝化短小杆菌(Nitrosopumilus)、未分类亚硝化球菌(unclassifiedNitrososphaeraceae)和Nitrosocosmicus,均率属于奇古菌门;它们在LS样品中占比分别为19.2%~52.4%、3.1%~22.8%、14.0%~40.6%和5.0%~18.9%,均高于HS样品的7.2%~40.3%、0.0%~6.8%、6.5%~28.2%和2.0%~25.7%。在HS样品中,未分类其他占比19.6%~79.2%,说明存在大量AOA有待进一步研究。
AOA是重要的氨氧化菌,贺帅兵等[10]研究了艾比湖湿地芦苇根际土壤AOA多样性,发现主要集中在泉古菌门和奇古菌门。刘国辉等[20]研究了南海北部陆坡表层沉积物AOA组成,结果所有的amoA基因序列都隶属于奇古菌门。LS/HS样品AOA组成差异较大,这可能是导致氨氮去除率差异的另一个原因。
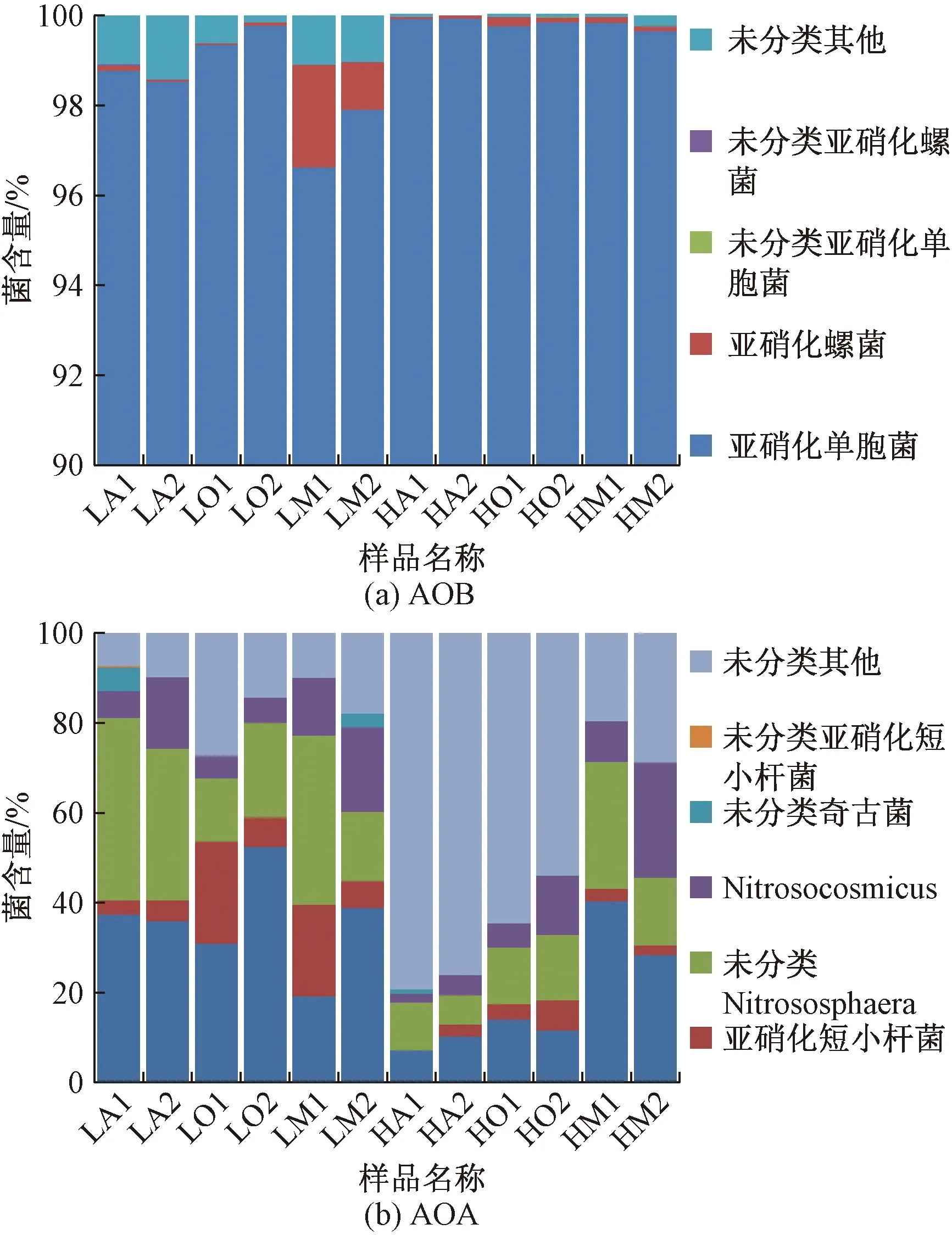
图4 AOB和AOA组成Fig.4 Microbial communities of AOB and AOA
2.4 菌含量与水质动态特征相互关系
使用荧光定量PCR技术,对LS/HS样品开展了细菌、AOB和AOA含量分析,结果如图5所示。图5(a)显示,LS样品的细菌含量范围2.99×109~3.04×109拷贝/g污泥,HS样品的2.83×109~4.01×109拷贝/g污泥,细菌含量均很丰富,且差异较小。
对于AOB含量,LS样品的为7.27×107~8.47×107拷贝/g污泥,而HS的为6.79×108~17.2×108拷贝/g污泥。研究表明,轻度富营养湖泊中AOB含量1.30×107拷贝/g沉积物[12],这与LS样品的AOB含量接近。定量分析结果显示HS样品的AOB含量是LS样品的9~20倍,这与细菌组成定性分析[图3(b)]显示的亚硝化单胞菌占比差异结果是一致的,说明这是决定LS/HS阶段氨氮去除率差异的决定性因素。
对于AOA含量,LS和HS样品分别为4.06×104~4.87×104、5.52×104~8.88×104拷贝/g污泥,二者差异不大,且均显著低于文献报道的中营养湖泊沉积物AOA的3.82×106拷贝/g沉积物[12]。LS/HS样品AOA含量均极低,说明AOA不是影响氨氮去除率差异的主要因素。

图5 细菌、AOB 和AOA含量Fig.5 Quantities of bacteria, AOB and AOA
3 结论
(1)A/O-MBR生化法处理高盐、高CODcr、高氨氮含硫气田采出水的特征是CODcr去除保持相对稳定,而氨氮表现出低/高去除率两个阶段(LS/HS)。氨氮在氨氧化菌作用下全部转化为亚硝酸根。亚硝酸根没有进一步转化为硝酸根,而是依靠反硝化菌部分转化为氮气。
(2)细菌组成揭示关键功能菌,涉及CODcr去除的主要有林杆菌、陶厄氏菌、伯克氏菌、水微菌、藤黄单胞菌、砂单胞菌,涉及反硝化的主要有斯塔普氏菌、生丝微菌和噬甲基菌。
(3)AOB组成中绝对优势菌是亚硝化单胞菌;AOA组成主要有亚硝化球菌、亚硝化短小杆菌和Nitrosocosmicus,均率属于奇古菌门。
(4)细菌含量丰富是高效生化处理高盐采出水的基础。AOB含量差异显著是导致氨氮去除率差异的决定性因素。AOA含量均较低,说明其不是氨氮生物降解的关键功能菌群。
未来,培育具有较高耐受水质变化冲击能力的耐盐菌,特别是耐盐AOB,是提高生化法处理油气田含盐污水效率的重要研究方向。
