黄芪多糖对呼吸道合胞病毒所致幼鼠肺部感染的抗病毒作用及其机制
2022-05-19吴振波邵淑蓉陈虹宇
吴振波,邵淑蓉,陈虹宇
1丽水市中心医院药学部,浙江丽水 323000;2宁波市妇女儿童医院药剂科,浙江宁波 315012
人呼吸道合胞病毒(respiratory syncytial virus,RSV)是导致婴幼儿急性和严重下呼吸道疾病的最常见病毒之一[1],在发展中国家的死亡率较高[2-3],且目前的治疗方案仍局限于支持治疗[4]。利巴韦林是唯一被批准用于治疗RSV感染所致呼吸道疾病的抗病毒药物,然而其疗效和不良反应限制了其在免疫功能低下患儿中的应用[5]。因此,临床迫切需要能有效治疗RSV的药物。既往研究证实植物提取物和草药化合物具有抗病毒和免疫调节作用[6-7]。黄芪长期被作为许多中药方剂的重要组成部分[8-9],具有止汗、降压、利尿和增补等作用[10]。黄芪多糖(Astragalus polysaccharide,APS)是从黄芪中提取的一种有效成分,研究证实其可调节免疫细胞功能和细胞因子的表达[11],增强抗炎活性[12-13]及减少气道重塑[14-15],从而在哮喘治疗中发挥重要作用。在抗病毒方面,有研究发现APS能够减轻由单纯疱疹病毒引起的星形胶质细胞损伤[16]。然而,目前尚无APS治疗RSV肺部感染的相关研究。本研究探讨了APS对RSV所致小鼠感染性肺炎的治疗作用及其可能机制,旨在为寻找治疗RSV所致呼吸道疾病的有效药物提供帮助。
1 材料与方法
1.1 细胞与试剂 APS和利巴韦林购自美国Sigma-Aldrich公司,人喉癌上皮细胞(HEp-2,ATCCCCL-23)和RSV Long株(ATCC-VR-26)购自美国ATCC,胎牛血清、DMEM培养基及100 U/ml青霉素-链霉素双抗购自美国Gibco公司,丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)和超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒购自南京建成生物工程研究所,白介素-1β(interleukin-1β,IL-1β)、IL-18及IL-33酶联免疫吸附(ELISA)试剂盒均购自中国Elabscience公司,10%多聚甲醛、1%结晶紫水溶液、RIPA强裂解液、PMSF蛋白酶抑制剂、BCA蛋白浓度测定试剂盒、封闭液、一抗及二抗稀释液、ECL发光液均购自上海碧云天生物技术有限公司,PVDF膜购自美国Merck-Millipore公司,抗小鼠CD3单克隆抗体(APC标记)、抗小鼠CD4单克隆抗体(FITC标记)、抗小鼠CD8单克隆抗体(PE标记)、小鼠Toll样受体4(Toll-like receptor 4,TLR4)、磷酸化的分裂素原活化蛋白激酶(phosphorylated mitogenactivated protein kinases,p-MAPK)、MAPK、磷酸化的核转录因子κB(phosphorylated nuclear factor κB,p-NF-κB)、NF-κB及β肌动蛋白(β-actin)抗体均购自英国Abcam公司。
1.2 RSV感染模型的建立及实验分组 60只雄性3周龄BALB/c小鼠(SPF级,12~14 g)购自常州卡文斯实验动物有限公司。将小鼠置于湿度为55%、温度为20~25 ℃、12 h光/暗循环的标准条件下饲养,自由饮水、进食。将小鼠按照随机数字表法分为6组(n=10):对照组、RSV组、利巴韦林组、APS低剂量组、APS中剂量组及APS高剂量组。具体操作步骤为:将小鼠用乙醚轻度麻醉后,对照组滴鼻50 μl生理盐水,其余各组小鼠均通过鼻腔滴注50 μl RSV-long株病毒溶液[含6.8×106个斑块形成单位(pfu)]制备模型。滴鼻2 h后开始灌胃,APS低、中、高剂量组分别给予100、200、300 mg/(kg.d)APS灌胃[17],利巴韦林组给予46 mg/(kg.d)利巴韦林灌胃,对照组及RSV模型组给予等体积生理盐水灌胃,1次/d,持续5 d。待气道高反应性实验检测结束后,采用颈椎脱臼法处死小鼠,留取肺组织,摘眼球取血,肝素管抗凝,4 ℃、5000×g离心20 min获得血清,储存于–80 ℃冰箱中待用。
1.3 测量小鼠体重及计算肺指数 各组小鼠于RSV感染前3 d及感染后5 d连续称重,然后取小鼠肺组织并称重。肺指数计算公式为:肺指数=肺重量/体重。
1.4 空斑减数实验检测病毒滴度 制备肺组织匀浆,600×g离心5 min,取上清液加至培养有HEp-2细胞的24孔板中。培养2 h后弃去培养基,用PBS洗涤细胞2次,加入琼脂糖覆盖培养基。待琼脂糖凝固后,将维持培养基添加至孔中,进一步培养5 d以形成菌斑。然后对细胞进行固定染色,计数斑块数。
1.5 ELISA法检测血清中炎性因子表达水平 使用ELISA试剂盒检测RSV感染小鼠血清中细胞因子IL-1β、IL-18和IL-33的水平。具体操作按照试剂盒说明书进行,绘制标准曲线,计算细胞因子水平。
1.6 肺组织抗氧化及氧化产物含量检测 制备肺组织匀浆,根据试剂盒说明书采用比色法分别测定抗氧化产物GSH、SOD及氧化指标MDA的水平。
1.7 流式细胞仪检测外周血T细胞亚群水平 取100 μl外周血加入相应CD3、CD4和CD8抗体各5 μl,涡旋混匀后室温、避光孵育30 min,然后加入1 ml稀释溶血素,涡旋混匀样品,室温静置15 min,400×g离心5 min后弃上清,加入2 ml PBS混匀,400×g离心5 min后弃上清,最后加入450 μl PBS重悬样品,并采用流式细胞仪进行检测。
1.8 Western blotting检测肺组织蛋白表达水平 使用含蛋白酶抑制剂的RIPA强裂解液处理肺组织,将溶解后的样品在13 000×g、4 ℃条件下离心30 min留取上清液,使用BCA蛋白浓度测定试剂盒测定蛋白浓度。取20 μg总蛋白进行SDS-PAGE电泳分离,将分离的蛋白转移至PVDF膜上,用封闭液室温封闭2 h,然后与一抗TLR4、p-MAPK、MAPK、p-NF-κB、NF-κB及β-actin抗体在4 ℃孵育过夜。次日回收一抗,洗膜后以相应二抗室温孵育PVDF膜1 h,使用ECL发光液进行目标蛋白可视化显影,并采用Photoshop进行蛋白条带灰度分析。
1.9 统计学处理 采用GraphPad Prism 5.0进行统计分析。计量资料以±s表示,多组间比较采用单因素方差分析,组间进一步比较采用Dunnett'st检验。P<0.05为差异有统计学意义。
2 结 果
2.1 APS对RSV感染小鼠肺组织病毒载量的影响与对照组(0)比较,RSV组[(98.3±4.5)个]、APS低剂量组[(77.0±3.6)个]、APS中剂量组[(61.7±2.5)个]、APS高剂量组[(33.0±2.0)个]及利巴韦林组[(33.7±3.5)个]的空斑数量均明显增加(P<0.05);与RSV组比较,APS低、中、高剂量组及利巴韦林组的空斑数量明显减少(P<0.05),且APS低、中、高剂量组的病毒载量呈剂量依赖性降低(P=0.0032);利巴韦林组的空斑数量与APS高剂量比较差异无统计学意义(P>0.05)(图1)。
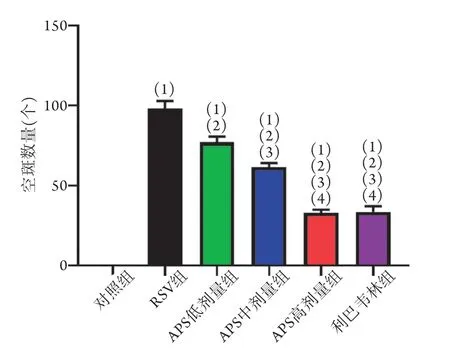
图1 APS对RSV感染小鼠肺组织病毒载量的影响(n=10)Fig.1 Effect of APS on the viral load in lung tissue of RSV infected mice (n=10)
2.2 APS对RSV感染小鼠体重及肺指数的影响 与对照组比较,RSV组小鼠体重明显降低(P<0.05),而给予低、中、高剂量APS及利巴韦林治疗后,小鼠体重明显增加(P<0.05),其中APS低、中、高剂量组小鼠体重呈剂量依赖性地增加(P<0.05);此外,APS高剂量组小鼠较利巴韦林组体重增加更明显(P<0.05)(图2A)。与对照组(0.83%±0.09%)比较,RSV组感染小鼠的肺指数(1.63%±0.09%)明显升高(P=0.0004);而APS低、中、高剂量组及利巴韦林组小鼠肺指数(分别为1.44%±0.06%、1.34%±0.04%、1.16%±0.08%、1.24%±0.11%)均明显低于RSV组(P=0.0424、0.0071、0.0027、0.0090),其中,APS低、中、高剂量组的肺指数呈剂量依赖性地降低(P=0.0038);此外,利巴韦林组的肺指数与APS高剂量组比较差异无统计学意义(P=0.3799)(图2B)。

图2 APS对RSV感染小鼠体重及肺指数的影响(n=10)Fig.2 Effects of APS on body weight and lung index of RSV infected mice (n=10)
2.3 APS对RSV感染小鼠血清中IL-1β、IL-18和IL-33水平的影响 ELISA检测结果显示,与对照组比较,RSV组,APS低、中、高剂量组及利巴韦林组小鼠血清中IL-1β、IL-18和IL-33水平均明显升高(P<0.05);与RSV组比较,APS低、中、高剂量组的IL-1β、IL-18和IL-33水平呈剂量依赖方式明显降低(P<0.05),利巴韦林组的IL-1β、IL-18和IL-33水平也明显降低(P<0.05);与APS高剂量组比较,利巴韦林组的IL-1β水平升高(P<0.05),而IL-18和IL-33水平无明显变化(P>0.05,图3)。
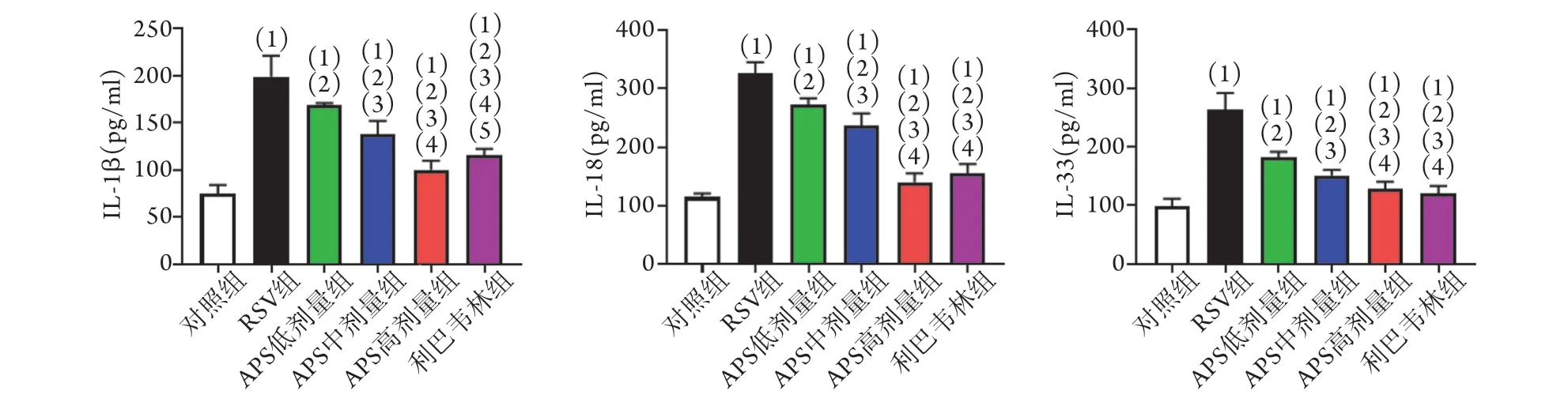
图3 APS对RSV感染小鼠血清IL-1β、IL-18和IL-33水平的影响(n=10)Fig.3 Effects of APS on the levels of IL-1β, IL-18 and IL-33 in serum of RSV infected mice (n=10)
2.4 APS对外周血CD4+、CD8+T细胞亚群水平的影响 流式细胞检测结果显示,与对照组比较,RSV组,APS低、中、高剂量组及利巴韦林组小鼠外周血中的CD4+T细胞百分比增高(P<0.05),CD8+T细胞百分比降低(P<0.05),CD4+/CD8+比值明显增高(P<0.05);与RSV组比较,低、中、高剂量APS及利巴韦林可明显逆转上述变化(P<0.05),其中,低、中、高剂量APS呈剂量依赖方式发挥作用(P<0.05)。此外,利巴韦林组的CD4+T细胞百分比及CD4+/CD8+比值明显高于APS高剂量组,而CD8+T细胞百分比明显低于APS高剂量组(P<0.05)(图4、表1)。
表1 各组小鼠外周血T细胞亚群水平比较(±s,n=10)Tab.1 Comparison of T cell subset levels among each group of mice (±s, n=10)

表1 各组小鼠外周血T细胞亚群水平比较(±s,n=10)Tab.1 Comparison of T cell subset levels among each group of mice (±s, n=10)
与对照组比较,(1)P<0.05;与RSV组比较,(2)P<0.05;与APS低剂量组比较,(3)P<0.05;与APS中剂量组比较,(4)P<0.05;与APS高剂量组比较,(5)P<0.05
组别 CD4+(%) CD8+(%) CD4+/CD8+对照组 23.55±1.07 8.70±0.66 2.72±0.26 RSV组 31.82±1.21(1) 6.20±0.70(1) 5.18±0.62(1)APS低剂量组 30.48±1.59(1)(2) 7.03±0.40(1)(2) 4.35±0.46(1)(2)APS中剂量组 26.20±2.72(1)(2)(3) 7.77±1.03(1)(2)(3) 3.44±0.74(1)(2)(3)APS高剂量组 24.53±1.70(1)(2)(3)(4) 8.10±0.40(1)(2)(3)(4) 3.04±0.30(1)(2)(3)(4)利巴韦林组 26.55±1.09(1)(2)(3)(5) 7.20±0.46(1)(2)(3)(4)(5) 3.70±0.27(1)(2)(3)(4)(5)F 9.979 4.578 8.981 P 0.0044 0.0379 0.0061

图4 APS对外周血CD4+、CD8+ T细胞亚群的影响(n=10)Fig.4 Effects of APS on CD4+ and CD8+ T cell subsets in peripheral blood of RSV infected mice (n=10)
2.5 APS对肺组织MDA、SOD、GSH含量的影响与对照组比较,RSV组,APS低、中、高剂量组及利巴韦林组小鼠肺组织中抗氧化产物SOD、GSH水平明显降低(P<0.05),而氧化产物MDA含量明显升高(P<0.05);APS低、中、高剂量组的SOD、GSH水平以剂量依赖方式明显升高(P<0.05),而MDA水平则呈现出相反的变化趋势(P<0.05);与RSV组比较,利巴韦林组的SOD、GSH水平明显升高(P<0.05),而MDA水平降低(P<0.05)。此外,利巴韦林组的SOD活性与APS高剂量组比较差异无统计学意义(P>0.05),但GSH水平明显低于APS高剂量组,MDA水平明显高于APS高剂量组(P<0.05)(图5)。

图5 APS对肺组织SOD、GSH和MDA含量的影响(n=10)Fig.5 Effects of APS on the contents of SOD, GSH and MDA in lung tissue (n=10)
2.6 APS对TLR4/MAPK/NF-κB信号通路的调节作用 Western blotting检测结果显示,与对照组
比较,RSV组,APS低、中、高剂量组及利巴韦林组TLR4、p-MAPK、p-NF-κB蛋白水平明显升高(P<0.05);与RSV组比较,APS中、高剂量组及利巴韦林组的TLR4、p-MAPK、p-NF-κB蛋白水平明显降低(P<0.05)。此外,利巴韦林组的TLR4、p-MAPK及p-NF-κB表达水平明显高于APS高剂量组(P<0.05)(图6)。

图6 APS对TLR4/MAPK/NF-κB信号通路的调节作用(n=10)Fig.6 Regulating effects of APS on TLR4/MAPK/NF-κB signaling pathway (n=10)
3 讨 论
RSV是下呼吸道感染的重要原因,可导致毛细支气管炎和肺炎[18]。目前临床上仍无有效、安全的RSV治疗药物。既往研究报道,利巴韦林具有抑制RSV复制的作用[19],但近年的数据表明,利巴韦林对RSV感染引起的炎症反应作用有限[18],与本研究结果一致。因此,寻找可抑制RSV感染引起的炎症反应的药物具有重要意义。
APS具有抗氧化、抗炎、抗病毒及免疫调节等多种生物活性[20]。本研究发现,APS可抑制RSV诱导的小鼠体重减轻,并可降低肺指数,提示其可有效减轻RSV感染引起的肺水肿,改善小鼠的身体状况。本研究还检测了小鼠血清中的促炎细胞因子水平,发现高剂量APS可抑制RSV感染诱导的炎症相关因子IL-1β、IL-18及IL-33的分泌,从而发挥抗炎作用。此外,空斑减数实验发现,APS有降低RSV滴度、抑制病毒复制的作用。有研究发现,RSV肺炎小鼠体内的MDA水平升高,GSH和SOD活性降低[21]。已知MDA是自由基作用于脂质发生过氧化反应的氧化终产物,具有细胞毒性[22];细胞内GSH水平降低可使细胞对有害刺激的敏感性升高[23];SOD活性降低可导致机体超氧化物的过量利用,进而产生自由基类物质损伤细胞[22]。本研究在小鼠RSV肺炎中发现,高剂量APS治疗可逆转MDA、GSH及SOD水平的变化,提示APS具有抗氧化作用。
本研究还探讨了APS的免疫调节作用。已知在正常情况下,人体内辅助性T淋巴细胞(CD3+CD4+T细胞,简称CD4+T细胞)和细胞毒性T淋巴细胞(CD3+CD8+T细胞,简称CD8+T细胞)的比值相对稳定。本研究发现,当小鼠感染RSV后,CD4+、CD8+T细胞百分比及CD4+/CD8+比值发生变化,提示RSV感染可诱导机体免疫平衡紊乱;而高剂量APS可调节CD4+/CD8+比值趋于正常,另外APS治疗还可增高CD8+T细胞百分比,降低CD4+T细胞百分比,提示APS具有激活免疫反应及调节免疫失衡的双向作用,从而发挥调节炎症反应的作用。
此外,本研究还进一步探讨了APS发挥抗炎、调节免疫作用的潜在机制。已知Toll样受体(TLRs)是一类进化保守的模式识别受体,在机体识别病毒感染方面,具有调节干扰素和促炎性细胞因子产生等作用。Marchant等[24]发现,TLR4明显集中于病毒与细胞的相互作用部位,可参与RSV病毒的内化。Marzec等[25]发现,TLR4参与了RSV所致小鼠肺部疾病的发生发展,可激活细胞免疫,促进炎症复合物的产生。MAPK和NF-κB信号通路的激活在TLR4信号轴中起着至关重要的作用,最终可导致炎性细胞因子的释放[26]。本研究发现,RSV可促进TLR4蛋白表达增多,并促使MAPK和NF-κB蛋白发生磷酸化,而APS可呈剂量依赖性地逆转上述蛋白变化,从而抑制TLR/MAPK/NF-κB信号通路的激活,提示APS可能通过该通路抑制RSV感染引起的炎症反应和氧化反应。鉴于动物实验的局限性,虽然本研究发现高剂量APS可明显抑制RSV诱导幼鼠肺炎的发生发展,但其对人体的有效治疗浓度仍需进一步探索。
综上所述,APS可抑制RSV病毒复制,调节免疫反应,减轻RSV引起的炎症及氧化反应,且其机制可能与抑制TLR4/MAPK/NF-κB通路的激活有关。然而动物研究与人群研究相比存在其固有的局限性,因此,为明确APS对幼儿RSV肺炎的作用,今后仍需进行更为深入的人群研究,对APS应用于临床的可能性加以探索。
