胰腺癌CAR-T免疫治疗研究进展
2022-05-19涂东于杰蔡文科罗小迪高阳陈瑜余冰玉罗国军
涂东,于杰,蔡文科,罗小迪,高阳,陈瑜,余冰玉,罗国军
解放军联勤保障部队第920医院心胸外科,昆明 650032
胰腺癌是一种高侵袭性、高致命性的恶性肿瘤[1],全球癌症统计数据显示,2020年胰腺癌新发病例495 773例,死亡466 003例,死亡病例占新发病例的90%以上,在全球癌症死亡原因中居第8位[2],在中国居第6位[3],在美国居第3位[4],预计2030年在美国将升至第2位[5]。目前胰腺癌仍缺乏较好的检测和治疗手段,超过90%的胰腺癌患者确诊时已是晚期并发生转移,生存期不超过1年,5年生存率仅7%[6];其主要治疗手段仍是手术切除结合辅助疗法[7],但仅20%的患者适合手术,且术后80%的患者出现复发并最终死亡[8]。嵌合抗原受体T细胞(CAR-T)免疫疗法是一种过继T细胞疗法,首先从患者血液中分离T细胞,然后通过基因工程手段使T细胞可以识别肿瘤细胞上的抗原并杀死肿瘤细胞,被认为是一种安全可靠的免疫疗法。目前CAR-T疗法已在血液系统肿瘤治疗中取得巨大成功,靶向CD19的CAR-T对耐药性B细胞恶性肿瘤展示出持久的缓解效果[9-11],对于复发和难治的急性B淋巴细胞白血病患者治愈率达80%~90%[12];目前已有4项靶向CD19、1项靶向B细胞成熟抗原(B cell maturation antigen,BCMA)的CAR-T产品被美国FDA批准上市,分别用于治疗B细胞型急性淋巴细胞白血病(B-ALL)、弥漫性大B细胞淋巴瘤(DLBCL)[13]和复发或难治性多发性骨髓瘤,这标志着肿瘤免疫治疗进入了新时代。CAR-T疗法在血液系统肿瘤治疗中的成功也为实体瘤的治疗带来了希望,目前已发现一系列实体瘤CAR-T细胞靶抗原,并用于早期临床试验[14],如间皮素(mesothelin,MSLN)[15-16]、表皮生长因子(epidermal growth factor,EGFR)或表皮生长因子突变体Ⅲ(epidermal growth factor receptor variant Ⅲ,EGFRvⅢ)[17-18]、上皮细胞黏附因子(epithelial cell adhesion molecule,EpCAM)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)[19]、黏蛋白1(Mucin 1,MUC1)、癌胚抗原(carcinoembryonic antigen,CEA)[20]、前列腺特异性膜抗原(prostate-specific membrane antigen,PSMA)[21]等。胰腺癌CAR-T疗法已有较多研究报道,目前已发现多个抗原靶点,如MUC1、MSLN、HER2(ERBB2)、CE A(CE ACAM5)、CD133(PROM1)、前列腺干细胞抗原(prostate stem cell antigen,PSCA)等,并开展了多项临床试验。本文综述了基于上述靶点的胰腺癌CAR-T治疗的最新研究进展,以期为CAR-T用于胰腺癌的临床治疗提供新思路。
1 CAR-T疗法与实体瘤
近10年来CAR-T发展迅速,目前已发展到第4代,包含胞内信号域CD3ζ、共刺激域CD28和4-1BB、跨膜结构域、胞外scFv以及细胞因子(添加细胞因子基因,能在CAR-T细胞被活化后高表达,从而增强T细胞的活性)[22-23]。其中4-1BB属于坏死因子受体超家族(tumor necrosis factor receptor superfamily,TNFRSF),通过激活核因子-κB(nuclear factor kappa-B,NF-κB)、c-Jun和p38等信号通路促进CAR-T的体内存活并延长留存时间[24-25];CD28通过激活磷酸肌醇-3激酶/蛋白激酶(phosphoinositol 3 kinase-protein kinase B,PI3K/AKT)、NF-κB、Fos等信号通路促进T细胞增殖和细胞因子的产生[26];CD3ζ通过招募Zap-70激活C-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、活化T细胞核因子(nuclear factor of activated T cells,NFAT)及Fos等,进而激活T细胞[27]。CAR-T细胞scFv与肿瘤细胞表面抗原结合后,胞内信号被激活,从而发挥杀伤肿瘤细胞的作用:第一,CAR-T细胞分泌细胞毒性颗粒、穿孔素和颗粒酶,其中穿孔素可在肿瘤细胞表面“打洞”,随后颗粒酶被输送到肿瘤细胞内部,通过物理作用对肿瘤细胞进行杀伤或者诱导肿瘤细胞发生凋亡;第二,CAR-T细胞表面高表达肿瘤坏死因子(tumor necrosis factor,TNF)配体,这些配体可以诱导肿瘤细胞凋亡[28];第三,CAR-T细胞分泌特定的细胞因子,如γ干扰素(interferon-γ,IFN-γ)、白细胞介素-12(interleukin-12,IL-12)、肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)等[29-30],这些细胞因子可以增强CAR-T细胞的活性,改变肿瘤微环境,进一步增强其抗肿瘤活性。
在血液系统肿瘤治疗中取得的成功使CAR-T应用于实体瘤的治疗成为可能,但绝不是简单的平移,实体瘤治疗仍面临以下难题:(1)抗原异质性导致难以鉴定肿瘤细胞特异的抗原[31];(2)T细胞很难浸润到实体瘤内部[32];(3)肿瘤微环境的免疫抵抗,实体瘤微环境非常复杂,包含各种基质细胞、炎性细胞、脉管系统、细胞外基质等[33]。尽管采取一些措施,如设计多靶向的CAR分子以增加靶抗原的表达,增强CAR-T细胞的浸润能力和增殖能力,以及改变Tregs介导的免疫抑制作用等可以部分解决上述难题,但实体瘤CAR-T治疗的效果仍不理想。在众多实体瘤中,胰腺癌的肿瘤微环境尤为极端,包括极端低氧、高密度纤维基质、脉管系统少等,因此其CAR-T治疗较其他实体瘤更加困难,未来靶向胰腺癌微环境可能成为突破口。
2 胰腺癌CAR-T治疗靶点的选择
选择理想的靶点是CAR-T治疗的第一步,也是最关键的一步。目前的设计思路是根据胰腺癌的分子特征,找到胰腺癌中高表达的膜蛋白,并以这些蛋白作为抗原靶点,通过在体外改造外周血中分离培养的T细胞,使T细胞可以特异性识别这些抗原靶点,从而起到杀死肿瘤细胞的作用。具体思路如图1所示。

图1 CAR-T细胞体外改造流程及胰腺癌靶点选择Fig.1 The in vitro modification process of CAR-T cells and target selection for pancreatic cancer
目前胰腺癌CAR-T治疗的临床研究使用较多的抗原靶点包括MUC1、MSLN、HER2(ERBB2)、CEA(CEACAM5)、CD133(PROM1)、PSCA等,这些蛋白均在胰腺癌中高表达,且与患者预后明显相关(图2)。
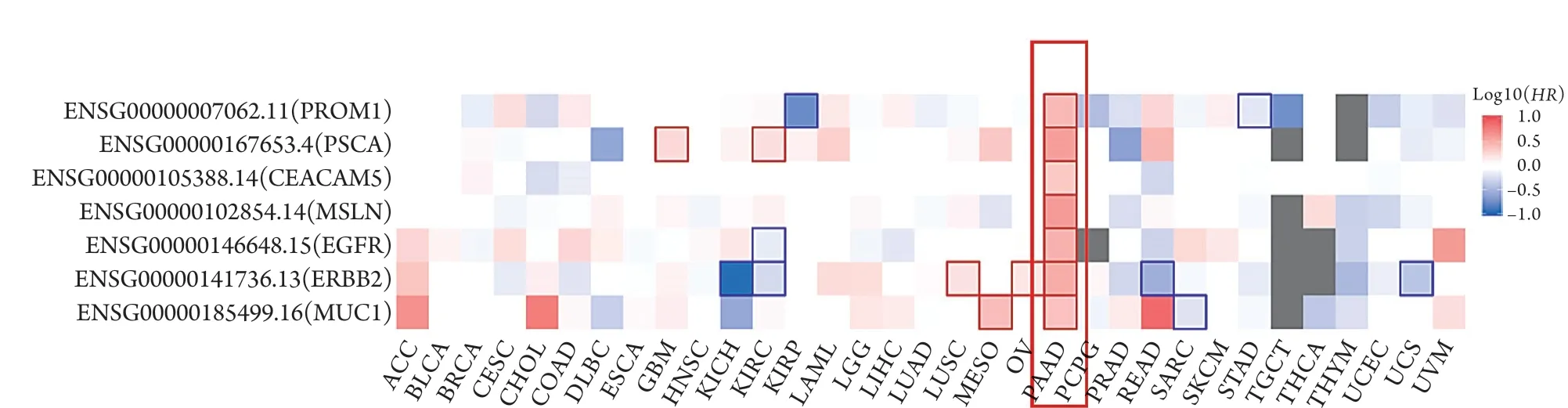
图2 胰腺癌CAR-T抗原靶点蛋白与患者预后的关系Fig.2 Relationship between the CAR-T antigen target of pancreatic cancer and the prognosis of patients
2.1 MUC1 MUC1是一种表达在细胞膜上的跨膜糖蛋白,在80%以上的胰腺癌中高表达[34-35],在75种潜在的肿瘤抗原中被国家癌症研究所(National Cancer Institute,NCI)列为第二适合免疫治疗的抗原靶点[36]。通过TCGA数据库分析发现,MUC1高表达的胰腺癌患者预后较差,可能是胰腺癌CAR-T治疗的理想靶点之一。
Posey等[37]设计了一种针对糖基化MUC1的CAR-T,并用人胰腺癌原位移植瘤测试其对胰腺癌的作用,发现5×105个CAR-T细胞处理可有效抑制小鼠胰腺癌生长,113 d后小鼠生存率仍为100%,而用未处理的T细胞和CD19 CAR-T细胞处理的小鼠生存率分别为40%和33%。另有研究发现,靶向MUC1的CAR-T细胞对Capan-1、Panc-1、Bxpc-3、Miapaca2、人胰腺腺泡上皮癌(human acinar epithelial carcinoma of the pancreas,HPAC)等多种胰腺癌细胞系均有较好的杀伤作用,并能明显抑制肿瘤在体内的生长[38]。上述两项研究结果表明,靶向MUC1的CAR-T能有效杀死胰腺癌细胞并抑制其体内生长,提示MUC1可作为胰腺癌治疗的潜在靶标。
2.2 MSLN MSLN是一种在正常组织中表达量很低,但在间皮瘤、卵巢癌、胰腺癌等多种肿瘤中高表达的细胞表面抗原,是肿瘤治疗的潜在靶点。目前已有多种针对MSLN的CAR-T被用于治疗实体瘤[39-41]。MSLN在80%以上的胰腺癌中高表达,且与患者预后呈负相关,因此也是胰腺癌潜在的治疗靶点之一。一项Ⅰ期临床试验对6例胰腺导管腺癌患者给予靶向MLSN的CAR-T治疗,每周1次,持续3周,发现3例肿瘤活性保持稳定,1例下降69.2%,2例无进展生存期(PFS)分别延长了3.8个月和5.4个月[15]。有研究利用转座子系统构建靶向MSLN的CAR-T,其在体外可以快速杀死胰腺癌细胞系Aspc-1,并能明显抑制用Aspc-1细胞构建的裸鼠移植瘤的生长[42]。有研究发现,靶向MSLN和CEA的双CAR-T具有更强的抗胰腺癌活性[43]。
2.3 CEA CEA是一种糖蛋白,在75%以上的胰腺癌中高表达[44]。通过TCGA数据库分析发现,CEA高表达的胰腺癌患者预后更差。一项靶向CEA的临床试验中,53%接受治疗的胰腺癌患者6周后病情保持稳定,但由于4例出现肺毒性而被迫停止。有研究发现,靶向CEA的CAR-T可以消除67%小鼠的移植瘤[45]。
2.4 HER2 HER2在20%~60%的胰腺癌中高表达,且与患者预后呈负相关。研究发现,基于曲妥单抗设计的二代HER2 CAR-T,可在1周内有效减小胰腺癌移植瘤的体积;结合使用CD24 CAR-T,可使90%的小鼠14周后仍存活[46]。另一项研究发现,接受HER2 CAR-T治疗后,患者15 min内出现呼吸窘迫等严重不良反应[47]。因此,HER2 CAR-T的应用有待进一步研究。
2.5 PSCA PSCA在60%~80%的胰腺癌中表达[48-49],且严重影响患者的生存,但在正常组织中表达量很低,因此也是胰腺癌免疫治疗的理想靶点之一。Abate-Daga等[50]和Katari等[51]的研究证实,靶向PSCA的CAR-T具有较好的抗胰腺癌活性,为PSCA作为胰腺癌的免疫治疗靶点提供了有效证据。
2.6 CD133 研究发现,肿瘤干细胞是肿瘤增殖、侵袭、转移和复发的主要原因[52-54],CD133是胰腺癌肿瘤干细胞的表面标志物,尽管仅在极少数细胞中被检测到,但这部分细胞的成瘤能力较普通肿瘤细胞强百倍[55-57]。因此,CD133可能是胰腺癌治疗的潜在靶点。有研究发现,CD133 CAR-T可以有效清除胰腺癌患者肿瘤中的CD133+细胞,有效抑制肿瘤复发[58]。
3 胰腺癌CAR-T治疗的临床研究
2010年1月1日-2021年1月1日美国国立卫生院(National Library of Medicine,NLM,www.clinicaltrials.gov)收录的胰腺癌CAR-T治疗的临床研究如表1所示,这些临床研究涉及多个抗原靶点,包括MSLN、CEA、MUC1、EpCAM、HER2、Claudin18.2、PSCA、CD133、CD70、受体酪氨酸激酶样孤儿素受体2(ROR2)等。目前虽然有多项胰腺癌CAR-T临床试验还在进行中,但均处于临床早期,因此胰腺癌CAR-T临床治疗亟需深入研究。

表1 胰腺癌CAR-T治疗临床试验Tab.1 Clinical trial of CAR-T therapy for pancreatic cancer
4 胰腺癌CAR-T治疗的安全性评估
实体瘤CAR-T治疗的主要障碍之一为其毒性,包括脱靶效应、神经毒性、细胞因子风暴及过敏反应等[47,59-60]。一项靶向EGFR的胰腺癌CAR-T Ⅰ期临床试验(NCT01869166),在接受治疗的16例患者中,2例出现胸腔积液、肺间质渗出毒性、细胞因子明显升高等严重不良反应,1例出现呼吸困难、血氧不足、胸腔积液及C反应蛋白、IL-6等快速升高,8例出现发热症状,14例出现淋巴细胞减少,6例出现血小板减少症状[17]。一项靶向HER2的Ⅰ期临床试验(NCT01935843)中,81.8%的患者出现淋巴球减少,其中54.5%的患者症状达到3~4级;72.7%的患者出现恶心呕吐;63.6%的患者出现疲劳;所有患者均出现急性发热,其中1例症状达到3级;1例出现转氨酶异常升高[61]。一项靶向MLSN的临床试验(NCT01583686)中,1例患者死亡,40%的患者发生严重不良反应,20%的患者出现缺氧、呼吸窘迫,所有患者均出现粒细胞、淋巴细胞、血小板减少症状。一项靶向HER2的胰腺癌CAR-T治疗结果显示,接受治疗后,患者15 min内出现呼吸窘迫、急性肺浸润,血清中IFN-γ、IL-6、IL-10、TNF-α、粒细胞巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GMCSF)等细胞因子水平明显升高,并在5 d后死亡[47]。上述研究结果表明,胰腺癌CAR-T治疗的安全性仍是一个严峻的问题,在临床治疗前必须全面评估CAR-T治疗的安全性。
有学者用非人灵长类猕猴建立了CAR-T安全性测试模型,用猕猴自体同源的CD20 CAR-T注射猕猴,发现猕猴血清中IL-6、IL-8、IL-1受体拮抗剂(interleukin1 receptor antagonist,IL1RA)、IFN-γ诱导的单核细胞(monokine induced by gamma interferon,MIG)和干扰素诱导的T细胞α趋化剂(interferon-inducible T-cell alpha chemoattractant,I-TAC)水平明显升高,脑脊液中IL-6、IL-2、GMCSF和血管内皮生长因子(vascular endothelial growth factor,VEGF)水平升高,表现出明显的细胞因子风暴和神经毒性[62]。由于非人灵长类猕猴与人的亲缘关系较为接近,因此该研究为CAR-T安全性评估建立了一个可靠的模型。
5 总结与展望
CAR-T疗法在血液系统肿瘤中取得的成功为胰腺癌的临床治疗带来了新的希望,但却面临着诸多挑战,如胰腺癌肿瘤微环境的免疫抑制性、抗原缺乏或逃逸、T细胞难以进入肿瘤内部等。对于血液系统肿瘤,CAR-T细胞进入血液后可直接接触到肿瘤细胞,而胰腺癌的组织学特征阻止了CAR-T细胞进入肿瘤内部,因此很难彻底清除肿瘤;此外,CD19抗原存在于所有B细胞表面,因此靶向CD19
的CAR-T可在血液肿瘤治疗中取得成功,而异质性是实体瘤的主要特征之一,导致不同个体、不同肿瘤细胞的表面抗原可能不同,因此CAR-T治疗实体瘤的难度较大;胰腺癌微环境较复杂,肿瘤内部大部分是由纤维基质组成,而肿瘤细胞仅占10%左右,微环境一方面阻止T细胞浸润,另一方面对T细胞具有抑制作用,使T细胞不能长时间存活。因此CAR-T在实体瘤中的应用仍需要进一步探索,可能需要更复杂的治疗策略,如联合使用抗体抑制免疫检查点或者抑制CAR-T细胞内部程序性细胞死亡蛋白1(programmed cell death protein 1,PD-1)等[63-64]。
CAR-T细胞疗法在胰腺癌治疗中面临的另一项挑战是其安全性,包括脱靶效应、神经毒性、细胞因子风暴及过敏反应等[47,59-60]。针对脱靶问题,有学者提出使用肿瘤细胞内部的天然抗原受体构建CAR-T细胞,可能有助于改善脱靶或抗原逃逸[65];针对神经毒性、细胞因子风暴等问题,有学者提出,在开展正式临床试验前,可以先用与人类亲缘关系近的物种测试CAR-T细胞的安全性,如非人灵长类动物猕猴,后者被认为是最接近人类的大型实验动物[66]。将猕猴来源的CAR-T细胞注射到对应的个体体内,通过检测猕猴的反应,包括食欲、发热、呼吸、腹泻、过敏等,并用ELISA检测血清中细胞因子及神经毒性相关因子的释放水平,进而综合评价CAR-T治疗的安全性,可为其临床应用提供可靠的依据。
通过改造CAR-T细胞本身的结构来提高其有效性、特异性及存活时间等是胰腺癌CAR-T治疗未来的发展方向,如构建Dual-CAR、添加趋化因子受体、基于天然配体-受体构建CAR-T等。考虑到胰腺癌中丰富的纤维基质,因此同时靶向肿瘤细胞和基质细胞的Dual-CAR可能具有更好的治疗效果;趋化因子受体如CCR2b、CCR4、CXCR2等可使细胞在肿瘤内的迁移能力增强[67-68],如在小鼠实验中证实,CCR2b表达可使T细胞在肿瘤中的迁移能力提高12.5倍[69];基于天然配体-受体构建的CAR-T较常规基于抗体的CAR-T具有一定优势,如同一个受体可以靶向多个受体,避免抗原丢失造成的免疫逃逸,基于天然配体构建的靶向NKG2D的CAR-T在胶质瘤和肝癌中已显示出较好的抑瘤作用[70-71]。上述类似的方法同样适用于胰腺癌的免疫治疗。
综上,CAR-T疗法在胰腺癌治疗中应用前景广阔,但仍需解决多个问题:(1)探索表达稳定、具有普遍性的抗原靶点;(2)改造CAR的结构,增强CAR-T细胞的活性、存活能力及侵袭能力等;(3)改善CAR-T的毒性;(4)探索靶向胰腺癌微环境的CAR-T;(5)探索联合治疗方法,如联合免疫检查点抑制剂、PD-1抑制剂或Dual-CAR-T等;(6)建立基于天然配体-受体的CAR-T。
