Nrf2敲除加重铝诱导小鼠海马神经元的损伤作用研究
2022-05-19杨玲玲梁仲威庞雅琴李文学岑育芳韦俊宏王一涵漆光紫
杨玲玲,梁仲威,庞雅琴,李文学,岑育芳,韦俊宏,王一涵,漆光紫
(1. 右江民族医学院,广西 百色 533000;2. 中山大学公共卫生学院,广东 广州 510080;3. 广东省广州市疾病预防控制中心,广东 广州 510440)
铝(Aluminum,Al) 是自然界中含量最丰富的金属元素,且被广泛应用于人类的工农业生产和日常生活。正常情况下,铝在生物体内含量很少,但长期慢性的铝摄入可致体内铝蓄积。研究表明[1],铝暴露与阿尔茨海默氏病(Alzheimer’s disease,AD)、帕金森氏病、多发性硬化等多种神经系统疾病有关。铝暴露可以导致Aβ异常蓄积[2-3], Aβ 的异常蓄积会导致体内活性氧增加,发生氧化应激损伤[4],大脑极易受到氧化应激的影响[5],从而引起线粒体损伤及脂质过氧化,甚至导致细胞凋亡或坏死,最终发展成为AD。
核因子E2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)是机体内重要的抗氧化应激调节因子。体内活性氧的增加会激活Nrf2,激活下游通路发挥其抗氧化应激作用[6]。而研究表明在AD模型中Nrf2表达受到抑制[7],而Nrf2信号通路在铝暴露诱导的神经毒性的抗氧化作用及其机制研究还不清楚。本研究主要通过敲除Nrf2,探讨Nrf2在铝诱导海马神经元损伤的作用,为进一步探讨铝致海马神经毒性机制提供科学思路。
1 材料与方法
1.1 主要试剂与仪器 乳酸铝(美国Sigma公司);Nissl染色试剂盒(中国Beyotime公司);兔抗小鼠Nrf2抗体(美国proteintech公司,CAS:16396-1-AP);抗山羊抗体IgG(中国Beyotime公司),Morris水迷宫,显微成像系统。
1.2 实验动物 取8周龄Wild-Type(以下简称(WT)和Nrf2-/-(以下简称HO)的FVB小鼠[购自南京大学-南京生物医药研究院,动物生产许可证号为SCXK(苏)2015-0001],各20只,饲养于广州市疾病预防控制中心的SPF环境中,温度(22±2) ℃,湿度(50±15)%,光照/黑暗周期为12 h(07:00~19:00)。垫料饮水均经过高压灭菌处理,小鼠实验期间自由饮水摄食。实验前适应性饲养1周,按体重将WT组和HO组小鼠各随机分为对照组和铝暴露组,每组10只。然后对铝暴露组小鼠采用220 mg/kg(0.73 mmol/kg)乳酸铝灌胃[8],对照组采用蒸馏水灌胃,灌胃染毒时间为3个月。
1.3 动物取材处理 染毒结束后,各组小鼠用1%戊巴比妥钠腹腔注射麻醉,行腹腔静脉采血;然后行冰上迅速取脑,一半脑组织用4%多聚甲醛固定,用于后续HE染色、Nissl染色和免疫组化,一半脑组织用于分离海马,海马用液氮速冻,-80 ℃保存,用于蛋白和RNA检测。
1.4 Nrf2 mRNA的表达含量测定 采用Trizol法提取各组小鼠海马总RNA。按照试剂盒说明书的程序,用1 μg RNA反转录成模板cDNA。以β-actin 作为内部参照,采用实时荧光定量PCR检测Nrf2 mRNA表达水平,具体程序为95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火/延伸30 s,扩增40个循环,目的基因相对表达量采用2-△△ct计算。引物序列见表1。每组4只,共重复4次。

表1 q-PCR引物序列
1.5 Nrf2蛋白的表达含量测定 取脑组织用4%多聚甲醛固定24 h以上,梯度乙醇脱水,二甲苯透明,石蜡包埋,使用切片机切片,二甲苯和梯度酒精脱蜡,然后3%的H2O2室温孵育5~10 min灭活内源性酶,柠檬酸缓冲液微波炉加热煮沸后冷却至室温,PBS清洗两次,10%血清封闭,兔抗小鼠Nrf2抗体(1∶50),4 ℃孵育过夜,用PBS清洗3次,加山羊抗兔IgG室温孵育1 h,DAB显色,苏木素染核,脱水透明,中性树胶封片并观察。用Image J 软件分析图片的平均光密度值,将对照均化为1,统计分析Nrf2的蛋白相对表达含量。
1.6 小鼠海马区病理变化的观察 脑组织石蜡切片用二甲苯和梯度酒精脱蜡,水洗,用苏木素染色5 min,然后1%盐酸酒精分化,用返蓝液返蓝,在伊红染液中染色3 min,梯度酒精与二甲苯脱水,中性树胶封片,镜下观察海马区病理变化。
1.7 小鼠海马区尼氏小体变化的观察 石蜡切片二甲苯和梯度酒精脱蜡,水洗,置于37 ℃温箱内Nissl试剂染色30 min,水洗,95%酒精分化5 s,梯度酒精与二甲苯脱水,最后使用中性树胶封片。在光学显微镜下观察海马区尼氏形态。

2 结果
2.1 各组小鼠Nrf2 mRNA表达情况 q-PCR结果显示4组小鼠Nrf2 mRNA表达含量差异有统计学意义(F=160.596,P<0.001),提示4组小鼠Nrf2 mRNA表达含量不完全相同。经两两比较,发现与WT对照组相比,WT铝暴露组、HO对照组、HO铝暴露组的Nrf2 mRNA表达量均明显下降,差异有统计学意义(P<0.05),提示铝暴露和Nrf2敲除均可下调小鼠的Nrf2 mRNA表达。但与HO对照组相比,HO铝暴露组的Nrf2 mRNA表达量差异无统计学意义(P>0.05),提示Nrf2敲除小鼠Nrf2 mRNA表达量处于较低水平,且铝暴露不会影响敲除Nrf2后小鼠Nrf2 mRNA表达量的改变。见表2。

表2 各组小鼠Nrf2 mRNA表达含量
2.2 各组小鼠海马区Nrf2的蛋白表达情况 免疫组化结果显示4组小鼠Nrf2蛋白表达含量差异有统计学意义(F=55.348,P<0.001),提示4组小鼠Nrf2蛋白表达含量不完全相同。经两两比较,发现与WT对照组相比,WT铝暴露组、HO对照组、HO铝暴露组的Nrf2蛋白表达量均明显下降,差异有统计学意义(P<0.05),提示铝暴露和Nrf2敲除均可下调小鼠的Nrf2蛋白表达。但与HO对照组相比,HO铝暴露组的Nrf2蛋白表达量差异无统计学意义(P>0.05),提示Nrf2敲除后小鼠的Nrf2蛋白表达量处于较低水平,且铝暴露不会影响Nrf2敲除小鼠Nrf2蛋白表达量的改变。见图1、图2。
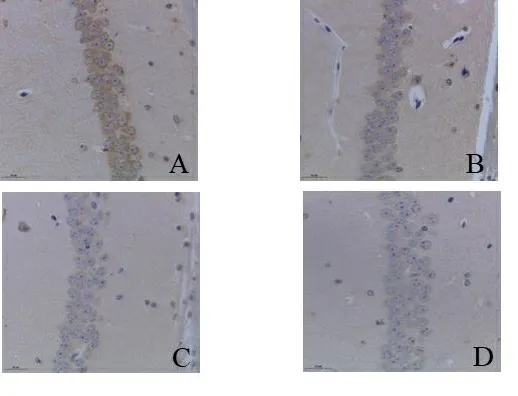
注:A.WT对照组;B.WT铝暴露组;C.HO对照组; D.HO铝暴露组。
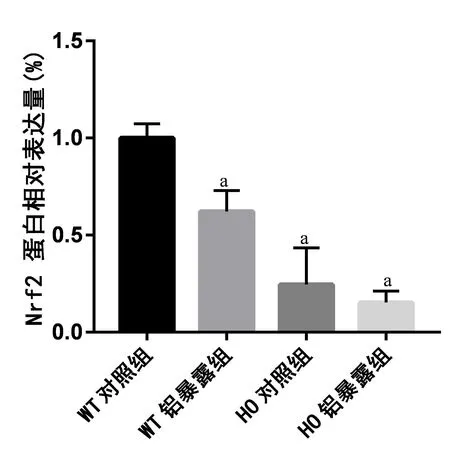
注:a表示与WT对照组相比,P<0.05。
2.3 各组小鼠海马区病理变化 与WT对照组相比,WT铝暴露组有少量细胞出现核固缩,胞体变小,提示铝暴露可以导致小鼠海马区神经元细胞发生病理损伤;与WT对照组相比,HO对照组神经元排列整齐,未出现损伤,提示Nrf2敲除不会损伤小鼠的海马神经元;与HO对照组相比,HO铝暴露组有大量海马神经元出现明显的形态不规则,核固缩,胞体变小,胞浆变少。与WT铝暴露组相比,HO铝暴露组海马神经元病理损伤更为明显,提示Nrf2敲除会加重铝诱导的海马神经元损伤。见图3。
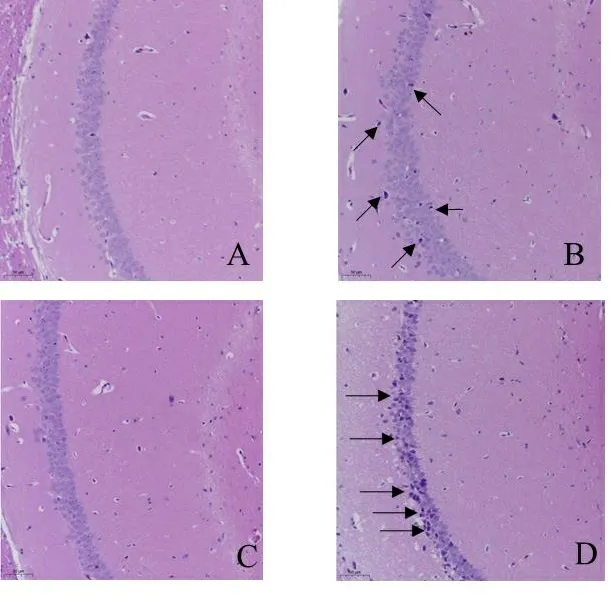
注:A.WT对照组; B.WT铝暴露组;C.HO对照组;D.HO铝暴露组。
2.4 Nissl染色检测小鼠海马神经元尼氏小体形态 与WT对照组相比,WT铝暴露组无明显尼氏小体数量减少,仅有少量尼氏小体染色深染,形状不规则,提示铝暴露可以导致小鼠海马区神经元尼氏小体发生损伤;与WT对照组相比,HO对照组尼氏小体数量与形态无明显改变,提示Nrf2敲除不会损伤小鼠的海马神经元尼氏小体形态;与HO对照组相比,HO铝暴露组的尼氏小体出现明显的形态不规则,轮廓和边界不清;与WT铝暴露组相比,HO铝暴露组尼氏小体数量明显减少,大部分尼氏小体形态不规则,排列疏散,着色变深,提示Nrf2敲除会加重铝诱导的海马神经元损伤。见图4。
3 讨论
铝作为日常生活中常见的暴露物被认为是各种神经系统疾病和神经退行性疾病的病理因素之一[9]。研究表明,长期职业铝暴露会出现轻度认知障碍,导致神经元功能受损[10]。流行病学研究结果显示,AD患者的脑中有一定程度的铝蓄积[11]。也有动物实验表明,亚慢性铝暴露会导致神经元发生凋亡和坏死[10,12],体外也有研究表明,铝暴露会导致神经细胞发生细胞周期停滞,导致神经细胞发生凋亡[13]。但其中的作用机制尚不明确。
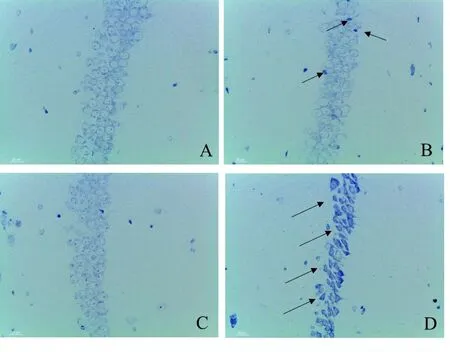
注:A.WT对照组; B.WT铝暴露组;C.HO对照组; D.HO铝暴露组。
本研究对小鼠灌胃3个月后,病理观察到小鼠海马区有神经元出现核固缩,胞体变小和尼氏小体形态改变,结果提示铝暴露导致小鼠神经元细胞坏死或凋亡,而神经元坏死与凋亡是导致认知障碍的关键原因,由此提示铝暴露有可能会通过损伤海马神经元进而影响其学习认知功能。神经元细胞内活性氧激活是导致细胞坏死与凋亡的重要原因,研究表明,铝暴露会导致大脑活性氧增加,破坏体内抗氧化系统平衡,导致细胞发生凋亡,使神经元发生不可逆性损伤[14],最终导致AD发生[15]。Nrf2是目前已知的体内重要的抗氧化应激通路,研究已证实其可调控大脑多种生理功能,例如氧化应激[16]、线粒体损伤[17]、自噬和凋亡等[18]。正常情况下,Nrf2与细胞质中的Keap1结合,处于失活状态,当机体发生氧化应激时,活性氧增多会激活Nrf2,活化后的Nrf2进入到细胞核与ARE结合,激活一系列下游通路发挥保护作用。本研究中通过铝染毒3个月观察到,与对照组相比,染毒组小鼠海马组织中Nrf2表达明显降低,结果进一步提示铝可能通过激活活性氧导致神经细胞凋亡或坏死,这与前人的研究基本一致[19],而Nrf2可能在其中具有重要作用。因此,本研究进一步采用Nrf2敲除小鼠模型来探讨Nrf2在铝诱导神经损伤中的作用,结果发现,Nrf2敲除后小鼠较未敲除小鼠相比铝暴露小鼠出现更明显的海马神经元病理改变,尼氏小体形态异常,数量减少,神经元活性明显下降。结果进一步证实铝通过抑制Nrf2表达导致神经元损伤,进而导致认知障碍。其可能是通过降低Nrf2的稳定性,使其泛素化水平升高,从而降低Nrf2的表达[20]。
综上,铝染毒3个月可导致小鼠海马神经元凋亡与坏死,主要是通过抑制海马组织中Nrf2表达,导致细胞内氧化应激激活所致,但其具体作用机制待进一步分析。
