Box-Behnken响应面法优化瓜蒌皮中总核苷和总氨基酸的提取工艺
2022-05-19吴雪邹纯才鄢海燕刘静雨杨燕
吴雪,邹纯才,鄢海燕,刘静雨,杨燕
(1. 皖南医学院药学院,安徽 芜湖 241002;2. 安徽省芜湖市中医医院,安徽 芜湖 241002)
瓜蒌皮是瓜蒌成熟干燥果皮,具宽胸散结、清热化痰之功效,是中医临床治疗“胸痹”“心痛”的经典药材[1-2]。瓜蒌皮中的化学成分及药理活性物质已经取得相关的研究进展[3-6],如其中所含核苷类成分腺苷具有很强的抗血小板活性,而氨基酸是人体必需活性物质,也是瓜蒌皮注射液[7-9]的质量评价指标。现已上市的瓜蒌皮注射液的提取工艺采用的是水提醇沉法对瓜蒌皮提取物进行精制,为同时兼顾核苷类物质和氨基酸这两类成分并使二者都最大程度地保留,需要进一步考察并优化瓜蒌皮的水提醇沉提取工艺。为此,本研究采用紫外-可见分光光度法测定瓜蒌皮提取物的总核苷和总氨基酸含量[10-12],并以总核苷和总氨基酸为评价指标,通过响应面优化法[13-17]优化瓜蒌皮的水提醇沉提取工艺,为瓜蒌皮药效成分的有效提取和利用提供理论依据。
1 仪器与材料
1.1 仪器 UV5100型紫外-可见分光光度计(日本株式会社日立高新技术科学那珂事业所);AUW-220D型电子天平(日本岛津公司);Heidolph-LR4010/4011旋转蒸发仪(德国海道尔夫公司);KQ-250DE型数控超声波清洗器(昆山市超声仪器有限公司);DF-1集热式磁力加热搅拌器(常州容华仪器制造有限公司);101-1-5型电热恒温鼓风干燥箱(上海跃进医疗器械有限公司);KNT-2-20科特宁纯水机(合肥科宁特水处理设备有限公司)。
1.2 材料 瓜蒌皮(批号:20171202,河北安国市御颜坊中药材有限公司);乙醇(批号:20130513,天津市百世化工有限公司);腺嘌呤核苷(腺苷,批号:N68291,山东西亚化学股份有限公司);L-精氨酸(批号:20150528,国药集团化学试剂有限公司);水合三酮氢茚(茚三酮,批号:20200601,上海展云化工有限公司);其余试剂为分析纯,纯化水(自制)。
2 方法与结果
2.1 溶液的制备
2.1.1 瓜蒌皮样品溶液的制备 取瓜蒌皮10.00 g,精密称定,置具塞锥形瓶中,按一定料液比加入水,按规定提取次数和提取时间超声提取(功率200 W,超声频率40 Hz),合并滤液并减压浓缩至10 ml,得瓜蒌皮浓缩液。取瓜蒌皮浓缩液,按一定比例加95%乙醇至规定醇沉浓度,4 ℃醇沉至规定时间,取上清液,减压浓缩后加水定容至10 ml,得瓜蒌皮样品溶液,备用。
2.1.2 腺苷对照品溶液的制备 取腺苷对照品0.5013 g,精密称定,置5 ml量瓶中,加水定容至刻度制得浓度为0.1003 g·ml-1的腺苷对照品溶液,备用。
2.1.3 L-精氨酸对照品溶液的制备 取L-精氨酸对照品0.5001 g,精密称定,置5 ml量瓶中,加水定容至刻度制得浓度为0.1000 g·ml-1的L-精氨酸对照品溶液,备用。
2.1.4 茚三酮溶液 取茚三酮1.0005 g,精密称定,置50 ml棕色量瓶中,以无水乙醇定容至刻度,即得。
2.2 总核苷和总氨基酸含量测定方法的建立
2.2.1 检测波长的选择
2.2.1.1 核苷测定波长的确定 精密量取“2.1.1”项下瓜蒌皮提取物样品溶液一定量,并用水稀释成一定浓度;另精密量取“2.1.2”项下腺苷对照品溶液0.5 ml置100 ml量瓶中加水定容至刻度,制得核苷对照品稀释液。以水为空白对照,照紫外-可见分光光度法,于200~400 nm范围内扫描。结果表明,腺苷和瓜蒌皮样品溶液在259 nm处均有最大吸收,因此选择259 nm作为总核苷的测定波长。见图1。

注:1为瓜蒌皮样品溶液,2为腺苷对照品。
2.2.1.2 总氨基酸测定波长的确定 精密量取“2.1.1”项下瓜蒌皮样品溶液0.1 ml置10 ml量瓶中,加水定容至刻度,得瓜蒌皮样品稀释溶液;精密量取“2.1.3”项下L-精氨酸对照品溶液0.1 ml置10 ml量瓶中,加水定容至刻度得L-精氨酸对照品稀释溶液。取1 ml瓜蒌皮样品稀释溶液和L-精氨酸对照品稀释溶液1 ml分别置10 ml量瓶中,加0.5 ml磷酸缓冲盐(pH=6.86)、0.5 ml茚三酮溶液,水浴15 min,迅速冷却至室温后用水定容至刻度。同法做空白,照紫外-可见分光光度法,于400~800 nm波长范围内进行扫描。结果表明,瓜蒌皮样品稀释溶液和L-氨基酸对照品稀释溶液均在568 nm波长处有最大吸收,故选择568 nm作为总氨基酸含量的测定波长。见图2。
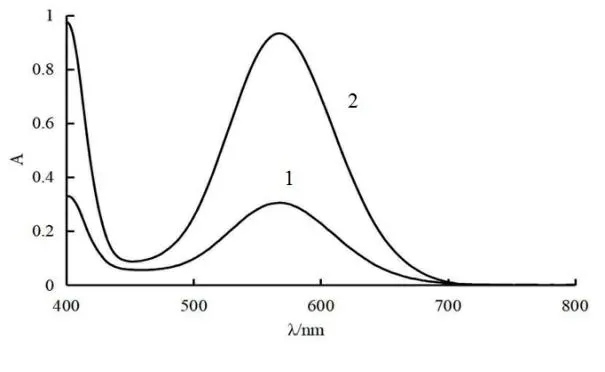
注:1为瓜蒌皮样品溶液,2为L-精氨酸对照品。
2.2.2 标准曲线的建立
2.2.2.1 腺苷标准曲线的建立 精密量取“2.1.2”项下腺苷对照品溶液0.1 ml置100 ml量瓶中,用水定容至刻度,得腺苷对照品稀释液,备用。分别精密量取腺苷对照品稀释液0.2 ml、0.4 ml、0.8 ml、1.6 ml、3.2 ml置10 ml量瓶中,加水定容至刻度,在259 nm处分别测定其吸光度。以吸光度值A为纵坐标(y),以腺苷浓度(mg·ml-1)为横坐标(x),建立回归方程为:y=53.93x+0.0017,r=0.9995。结果表明腺苷在0.002~0.032 mg·ml-1线性关系良好。
2.2.2.2 L-精氨酸标准曲线的建立 精密量取“2.1.3”项下L-精氨酸对照品溶液0.1 ml置100 ml 量瓶中,用水定容至刻度,得L-精氨酸对照品稀释液,备用。分别精密量取L-精氨酸对照品稀释液0.25 ml、0.5 ml、1 ml、2 ml、4 ml置10 ml 量瓶中,加0.5 ml磷酸缓冲盐(pH=6.86)、0.5 ml茚三酮溶液,水浴15 min,迅速冷却至室温后用水定容至刻度,同法做空白,于568 nm处分别测定吸光度。以吸光度值A为纵坐标(y),以浓度(mg·ml-1) 为横坐标(x),建立回归方程为:y=53.63x+0.0094,r=0.9997。结果表明L-氨基酸在0.0025~ 0.04 mg·ml-1线性关系良好。
2.3 方法学验证
2.3.1 精密度试验
2.3.1.1 精密度试验(总核苷测定用) 取“2.1.1”项下瓜蒌皮样品溶液,按“2.2.2.1”项下方法平行测定5次,记录吸光度值。结果5次测定吸光度值的 RSD值为0.11% ,表明该方法精密度良好。
2.3.1.2 精密度试验(总氨基酸测定用) 取“2.1.1”项下瓜蒌皮样品溶液,按“2.2.2.2”项下方法平行测定5次,记录吸光度值。结果5次测定吸光度值的RSD值为0.34%,表明该方法精密度良好。
2.3.2 稳定性试验
2.3.2.1 稳定性试验(总核苷测定用) 取“2.1.2”项下瓜蒌皮样品溶液7份,分别放置0 min、30 min、60 min、90 min、120 min、150 min、180 min,按“2.2.2.1”项下方法测其吸光度值A,计算RSD值为0.36%。结果表明该方法稳定性良好。
2.3.2.2 稳定性试验(总氨基酸测定用) 取“2.1.1”项下瓜蒌皮样品溶液7份,分别放置0 min、30 min、60 min、90 min、120 min、150 min、180 min,按“2.2.2.2”项下方法测其吸光度值A,计算RSD值为3.07% 。结果表明该方法稳定性良好。
2.3.3 重复性试验
2.3.3.1 重复性试验(总核苷测定用) 取瓜蒌皮(批号:20171202)5份,分别按“2.1.1”项下方法制备瓜蒌皮样品溶液,按“2.2.2.1”项下方法测定吸光度值A,计算RSD值为0.61%。结果表明该方法重复性良好。
2.3.3.2 重复性试验(总氨基酸测定用) 取瓜蒌皮(批号:20171202)5份,分别按“2.1.1”项下方法制备瓜蒌皮样品溶液,按“2.2.2.2”项下方法测定吸光度值A,计算RSD值为0.10%。结果表明该方法重复性良好。
2.3.4 加样回收率试验
2.3.4.1 加样回收率(总核苷测定用) 取已知总核苷含量的样品溶液9份,分别精密量取适量的核苷对照品溶液置于样品溶液中(核苷质量分别为所取样品溶液中总核苷质量的80%、100%和120%,各3份),按“2.2.2.1”项下方法处理,记录吸光度值A,计算样品加样回收率。见表1。结果表明该方法测定结果准确可靠。
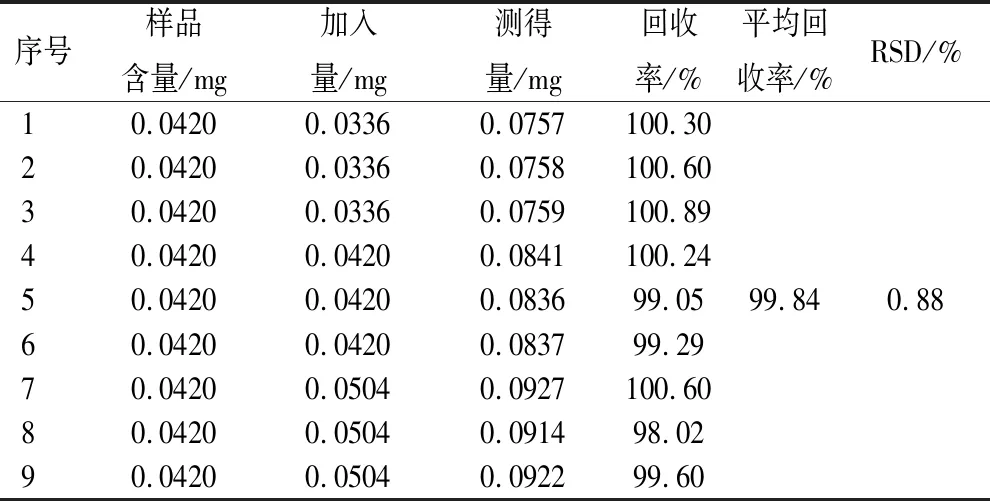
表1 总核苷加样回收率试验结果
2.3.4.2 加样回收率(总氨基酸测定用) 取已知总氨基酸含量的样品溶液9份,分别精密量取适量的L-精氨酸对照品溶液置于样品溶液中(L-精氨酸质量分别为所取样品溶液中总氨基酸质量的80%、100%和120%,各3份),按“2.2.2.2”项下方法处理,记录吸光度值A,计算样品加样回收率。见表2。结果表明该方法测定结果准确可靠。

表2 总氨基酸加样回收率试验结果
2.4 提取工艺的优化
2.4.1 单因素考察 主要考察料液比、提取次数、醇沉浓度、提取时间、静置时间对总核苷和总氨基酸含量的影响。在前期预试验的基础上,料液比(g·ml-1)定为1∶5、1∶10、1∶15、1∶20、1∶25;超声提取次数定为1次、2次、3次、4次、5次;超声提取时间定为25 min、35 min、45 min、55 min、65min;加入95%乙醇至醇沉浓度为50%、60%、70%、80%、90%;静置时间为12 h、24 h、36 h、48 h、60 h。在各项考察条件中选一项最优条件作为后续提取条件并为最后的响应面提供依据。
2.4.2 料液比的单因素考察 按“2.1.1”项下提取方法,分别按料液比1∶5、1∶10、1∶15、1∶20、1∶25加入纯水进行超声提取3次,提取时间为45 min,提取次数为3次,醇沉浓度为70%,静置36 h,制备瓜蒌皮样品溶液。按“2.2.2”项下方法测定不同料液比下的总核苷及总氨基酸吸光度值。不同料液比(g·ml-1)下总核苷和总氨基酸吸光度A,见图3。由图 3可知,在料液比为1∶15时,总核苷和总氨基酸吸光度较高且趋于平稳,暂定料液比为1∶15。

图3 料液比单因素考察
2.4.3 静置时间单因素考察 按“2.1.1”项下提取方法,按料液比1∶15(g·ml-1)加水进行超声提取,提取次数为3次,提取时间为45 min,醇沉浓度为70%,分别静置12 h、24 h、36 h、48 h、60 h,制备瓜蒌皮样品溶液。按“2.2.2”项下方法测定不同静置时间下的总核苷及总氨基酸吸光度值。不同静置时间下总核苷和总氨基酸吸光度A,见图 4。图4可知,在静置时间为36 h时,总核苷和总氨基酸吸光度较高,暂定静置时间为36 h。
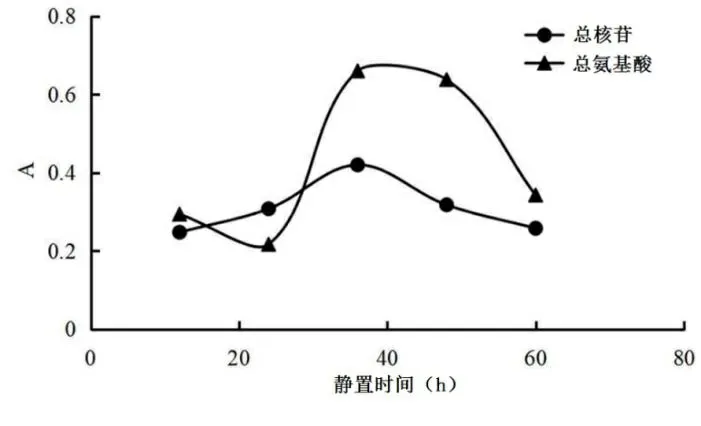
图4 静置时间单因素考察
2.4.4 提取次数单因素考察 按“2.1.1”项下提取方法,按料液比1∶15加入纯水进行超声提取,提取次数分别为1次、2次、3次、4次、5次,提取时间为45 min,醇沉浓度为70%,静置36 h,制备瓜蒌皮样品溶液。按“2.2.2”项下方法测定不同提取次数的总核苷及总氨基酸吸光度值。不同提取次数下总核苷和总氨基酸吸光度A,见图5。由图5可知,在提取次数为4次时,总核苷和总氨基酸吸光度较高,暂定提取次数为4次。

图5 提取次数单因素考察
2.4.5 醇沉浓度单因素考察 按“2.1.1”项下提取方法,按料液比1∶15加入纯水进行超声提取,提取次数分别为4次,提取时间为45 min,醇沉浓度分别为50%、60%、70%、80%、90%,静置36 h,制备瓜蒌皮样品溶液。按“2.2.2”项下方法测定不同醇沉浓度下的总核苷及总氨基酸吸光度值。不同醇沉浓度下总核苷和总氨基酸吸光度A,见图6。由图6可知,在醇沉浓度为60%时,总核苷和总氨基酸吸光度较高,暂定醇沉浓度为60%。
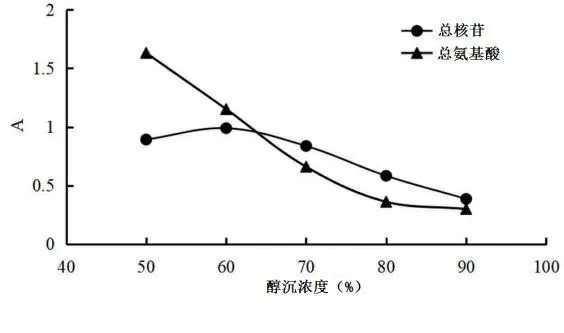
图6 醇沉浓度单因素考察
2.4.6 提取时间单因素考察 按“2.1.1”项下提取方法,按料液比1∶15加入纯水进行超声提取,提取次数分别为4次,提取时间为25 min、35 min、45 min、55 min、65 min,醇沉浓度为60%,静置36 h,制备瓜蒌皮样品溶液。按“2.2.2”项下方法测定不同提取时间下的总核苷及总氨基酸吸光度值。不同提取时间下总核苷和总氨基酸吸光度A,见图 7。由图7可知,在提取时间为55 min,总核苷和总氨基酸吸光度较高,暂定提取时间为55 min。
2.5 响应面优化设计 将单因素中获得的最优条件为0条件代码带入Design-Expert 8.0.6软件,选择料液比(A)、提取时间(B)、醇沉百分比(C)、静置时间(D)为考察因素,以总核苷和总氨基酸为评价指标,采用四因素三水平L29(34)共计29组实验进行响应面优化,确定最佳提取工艺。
2.5.1 响应面优化设计 在单因素试验的基础上,根据Box-Benhnken响应面优化试验原理进行优化试验设计,选取影响总核苷和总氨基酸最大的4个因素:料液比(A)、提取时间(B)、醇沉浓度(C)、静置时间(D),并将这4个因素进行响应面优化试验组合,响应面分析因素水平设计见表3。

表3 响应面分析因素水平
2.5.2 Box-Behnken试验结果 通过响应面优化设计,共进行29组试验,结果见表4。

表4 Box-Behnken 试验安排及结果
2.5.3 响应面回归模型各项方差分析
2.5.3.1 总核苷响应面回归模型各项方差分析 使用Design-Expert 8.0.6软件对Box-Behnken设计数据处理,以总核苷吸光度为指标进行线性、2FI、二项式、三项式方程拟合。总核苷吸光度以二项式回归为最优,其回归方程分别为:总核苷=0.72-0.04A+0.10B-0.041C+8.917×10-3D+0.027AB-1.000×10-3AC-0.063AD+0.083BC-0.072BD+0.13CD-0.11A2-0.084B2-0.066C2-0.048D2。见表5。由表5方差分析和显著性检验结果可知,对于核苷模型F=2.5,P<0.05,说明实验采用的二次多项式回归方程模型是显著的;失拟项P=0.1324,无显著性差异,说明此回归模型拟合程度较好,因此可通过这个模型来反映瓜蒌皮中总核苷的提取工艺中各因素与响应值之间的关系。

表5 核苷响应面回归模型各项方差分析
2.5.3.2 总氨基酸响应面回归模型各项方差分析 使用Design-Expert 8.0.6软件对Box-Behnken设计数据处理,以总氨基酸吸光度为指标进行线性、2FI、二项式、三项式方程拟合。总氨基酸吸光度以二项式回归为最优,其回归方程分别为:总氨基酸=1.17+0.013A+0.11B-0.2C-0.26D+0.22AB-0.099AC+0.025BC-0.14BD+0.33CD+0.027A2-0.040B2-0.019C2-3.883×10-3D2。见表6。由表 6 方差分析和显著性检验结果可知,对于氨基酸模型F=2.49,P<0.05,说明实验采用的二次多项式回归方程模型是显著的;失拟项P=0.1116,无显著性差异,说明此回归模型拟合程度较好,因此可通过这个模型来反映瓜蒌皮中总氨基酸的提取工艺中各因素与响应值之间的关系。
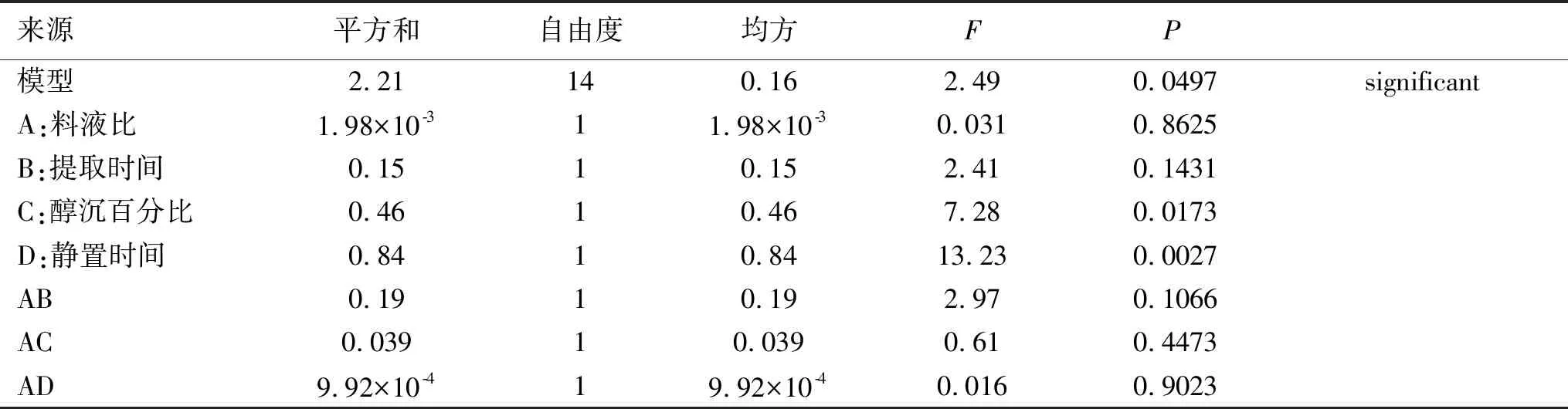
表6 氨基酸响应面回归模型各项方差分析

表6(续) 氨基酸响应面回归模型各项方差分析
2.5.4 响应面分析与优化 使用Design-Expert 8.0.6软件,选择对各指标有显著影响的2个因素,根据总核苷和总氨基酸模型回归方程分别绘制料液比、提取时间、醇沉浓度、静置时间对总核苷和总氨基酸吸光度值的响应面图。从图8和图9三维效应图可知各影响因素间的交互作用对响应值的影响,曲面越陡说明影响越大。从图8可知总核苷吸光度值 A 受料液比和提取时间影响较大。从图9可知总氨基酸吸光度值A受静置时间和醇沉浓度影响较大。
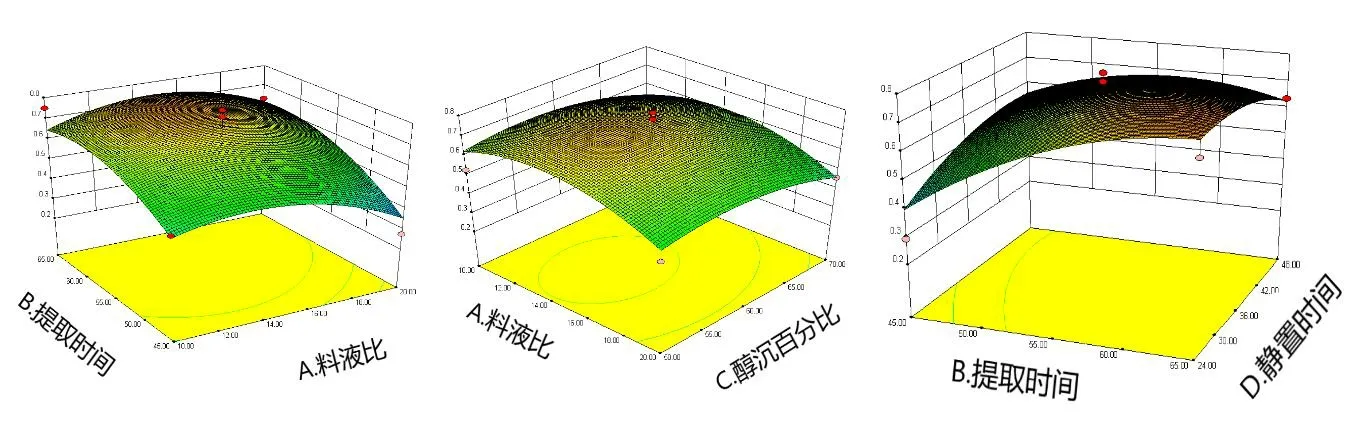
图8 各因素交互作用对总核苷的影响

图9 各因素交互作用对总氨基酸的影响
2.6 优选工艺的验证 采用Design-Expert 8.0.6软件对提取工艺进行优化,得到的优化工艺条件为A=1∶16.60,B=62.32 min,C=50%,D=24 h。根据实验的实际操作情况,确定最佳工艺条件为 A=1∶15,B=60 min,C=50%,D=24 h,即选择料液比(g·ml-1)为1∶15,提取时间为60 min,醇沉浓度为50% ,静置时间为24 h。根据该工艺条件,经5次平行验证试验,总核苷吸光度A平均值为0.785,RSD=0.42%,模型的预测结果为0.788,结果显示实际测定结果与模型预测结果差值为0.003;总氨基酸吸光度A平均值为2.112,RSD=0.07%,模型的预测结果为2.168,结果显示实际测定结果与模型预测结果差值为0.056,表明优化后的提取工艺可行。
3 讨论
瓜蒌皮注射液为瓜蒌皮经水煎煮4次共计4 h后减压浓缩并加入90%乙醇使含醇量为70%,静置72 h后进一步精制后制得的灭菌溶液。鉴于瓜蒌皮注射液用药不便,本研究后期拟对瓜蒌皮注射液进行剂型改进制备瓜蒌皮缓释微丸。鉴于瓜蒌皮中总核苷和总氨基酸的生理活性,本研究拟在瓜蒌皮提取的过程中,同时最大可能地保留总核苷和总氨基酸的含量。为此,对瓜蒌皮的提取工艺进行了考察。课题组前期比较了回流提取和超声提取对瓜蒌皮中总核苷和总氨基酸含量的影响,发现无统计学意义。但超声提取法提取时间短、提取效率高,有其独特的优势,为此,本研究采用了超声提取法提取瓜蒌皮中总核苷和总氨基酸。
瓜蒌皮样品溶液在 259 nm处的吸收峰不明显,可能原因是瓜蒌皮中多种核苷类物质在259 nm 附近的光谱叠加而致。结合课题组前期采用薄层色谱-紫外光谱联用[18-20]对核苷的分离分析和本文的方法学验证可知,选择259 nm作为总核苷的测定波长方法可靠。瓜蒌皮中的氨基酸虽然较稳定,但在测定过程中受水浴的影响,各组需要降至相同温度后进行定容,减小温度波动对量瓶体积的影响,降低测量误差。在前期大量预实验的基础上,先进行了各影响因素较大梯度的考察,再进行单因素考察并通过 Design-Expert 8.0.6 软件进行响应面优化获得最佳提取工艺。利用该提取工艺可最大程度地保留瓜蒌皮提取物中总核苷和总氨基酸的含量,为后期的瓜蒌皮提取物的深入研究和开发利用奠定了基础。
