褪黑素通过NRF2对氯胺酮诱导的尿路上皮损伤保护作用研究
2022-05-19李松恒米华
李松恒,米华
(广西医科大学第一附属医院泌尿外科,广西 南宁 530021)
氯胺酮(ketamine,KET)是苯环已哌啶(phencyclidine,PCP)的衍生物,已作为麻醉剂应用于临床和镇痛领域。根据《2020年中国毒情形势报告》,截至2020年底,全国现有吸毒人员180.1万名[1]。根据《2019 年中国毒品形势报告》,全国滥用氯胺酮4.9万名,占比为2.3%[2]。长期使用氯胺酮会造成膀胱黏膜及肌层的损伤,可出现类间质性膀胱炎的症状,这一临床表现由Shahani R等[3]于2007年首次报道,自此,氯胺酮相关性泌尿系统损害(ketamine associated urinary dysfunction,KAUD)才逐渐引起医生及研究人员的重视。氯胺酮引起的KAUD在临床上主要表现为严重的下尿路症状(lower urinary tract symptoms,LUTS),这些症状包括如排尿困难、尿频、尿急、急迫性尿失禁、尿痛、血尿等,随着病情加重可能会导致膀胱挛缩,甚至引起肾损伤。氯胺酮滥用导致的LUTS会严重影响患者生活质量,我们称之为氯胺酮相关性膀胱炎(ketamine cystitis,KC)。研究表明,氯胺酮及其代谢物可以直接损伤尿路上皮细胞,继而导致膀胱炎[4]。在临床上,对KC的治疗手段主要包括药物治疗和手术干预,虽然手术治疗可以较理想的缓解患者症状,但术后并发症的发生率比较高[5]。尽管目前已有KET滥用导致泌尿系统损害的相关研究,但由于对该病的认识不充分,传统的治疗手段效果不佳,其症状给患者生活质量带来的影响和巨大的经济负担使得此病的诊疗成为临床工作中非常棘手的工作。临床上迫切需要针对此类病人的有效而明确的药物和治疗手段。因此,深入探讨KC发生发展的分子机制,对于寻找KC诊治的特异性分子靶点,发展更精准个性化的诊断和治疗方法,具有重要意义。
最近的研究表明,氧化应激损伤可能是KC的重要病理学基础,维持细胞内的氧化/抗氧化失衡可能是减轻尿路上皮损伤的有效途径[6]。核因子E2相关因子2(nuclear factor E2-related factor 2,NRF2)含有6个高度保守的结构域,是调节细胞氧化应激反应的关键因子。在氧化应激的情况下,NRF2的功能对细胞存活至关重要。NRF2可以促进抗氧化酶如血红素加氧酶-1(heme oxygenase-1,HO-1)的表达,阻止胞内脂质过氧化物的形成,从而防止细胞损伤[7- 8]。研究发现,在NRF2高表达的疾病环境中,细胞可以利用抗氧化系统来防止脂质过氧化物积累以利于生存;而在NRF2低表达的疾病中,下游NRF2靶点的失活可能显著增强蛋白质的脂质过氧化,从而进一步促进疾病的进展[9]。除此之外,NRF2还能够抵消NF-κB驱动的炎症反应[10- 11]。然而,NRF2是否能够调控KC的发展过程还未见有明确报道。
褪黑素由松果体分泌,除了负责调节昼夜节律之外,还参与了许多关键的生理过程[12-15]。据报道[16],褪黑素是一种强大的抗氧化剂,它可以减轻氧化应激,清除自由基。然而,褪黑素是否可以通过调节NRF2蛋白表达来减轻氯胺酮导致的尿路上皮损伤仍不清楚。因此,本研究旨在通过细胞模型探究NRF2在氯胺酮导致的尿路上皮损伤中的保护作用,并探讨褪黑素通过调节NRF2表达作为治疗KC潜在药物的可能性。
1 实验材料和方法
1.1 细胞培养和试剂 永生化人膀胱上皮细胞系SV-HUC-1购自中国科学院细胞库;褪黑素购自北京索莱宝科技有限公司有限公司;细胞恒温培养箱(正航仪器设备有限公司);10%热灭活胎牛血清(Gibco);DMEM/F12K(Gibco)培养基;1%抗生素(Hyclone);盐酸氯胺酮注射液(福建古田制药有限公司,100 mg/2 ml);胰酶(Gibco);RIPA裂解液(Solarbio);CCK-8试剂盒(同仁化学,日本);RNA 提取试剂盒(9108)、RNA 逆转录试剂盒(RR047A)、RNA 扩增试剂盒(RR820A)(TaKaRa 公司,日本);光学显微镜(OLYMPUS 公司,日本);Bioford蛋白定量试剂盒(BioRad Laboratories,CA,USA);聚偏二氟乙烯(PVDF)膜(Millipore Corporation,Bedford,MA);一抗:NRF2(PTG,#16396-1-AP)、 HO-1(PTG,#10701-1-AP)、β-actin(CST,#4970);电泳、转膜仪(北京六一公司);流式凋亡检测试剂盒(联科生物);SOD检测试剂盒(南京建成);慢病毒及病毒转染试剂购自吉凯生物。
1.2 细胞与药物共培养 将细胞分为空白对照组(CON)、氯胺酮组(KET)、KET+褪黑素组(KET+褪黑素)、褪黑素组。将细胞接种于T25培养瓶内,细胞在补充有10%热灭活胎牛血清(GibcoTM,Thermo Fisher)和1% 抗生素(Hyclone)的DMEM/F12K (GibcoTM) 培养基中培养。待细胞铺满培养瓶底部大约80%时,更换培养液。使KET组和KET+褪黑素组中氯胺酮浓度为2 mmol/L,KET+褪黑素组和褪黑素组的褪黑素浓度为100 μmol/L,CON组培养基中加入等量PBS作为空白对照,将细胞置于培养箱中孵育24 h,用于刺激细胞。
1.3 细胞活力测定 采用细胞计数试剂盒(CCK-8)比色法评价氯胺酮及褪黑素对SV-HUC-1细胞的细胞毒作用。将细胞接种于96孔板,待细胞铺满底部大约80%时,向每个孔中分别滴加氯胺酮2 mM及褪黑素(0 μmol/L、50 μmol/L、100 μmol/L、200 μmol/L、500 μmol/L),置于培养箱中孵育24 h后,根据CCK-8试剂说明书,向每个孔中加入CCK-8溶液(10 μl),在37 ℃和5%CO2的厌氧条件下培养1.5 h后。在450 nm处测定吸光度。
1.4 Western blot分析 将培养后的细胞样品在含有蛋白磷酸酶抑制剂的RIPA缓冲液中裂解,然后用BCA法测定蛋白质浓度。等量的蛋白质(25 μg)在10%SDS-聚丙烯酰胺凝胶(SDS-PAGE)上装载和分离,然后转移到PVDF膜上。膜与一抗在4 ℃孵育过夜,然后用TBST洗涤,与HRP二抗在37 ℃孵育1 h。洗涤3次后用ECL发光试剂盒在暗室内曝光,检测免疫印迹条带的信号强度。使用Image J 软件分析条带灰度值,将目的蛋白和同一内参灰度值相比后得出相对表达量。主要抗体为: NRF2(1∶1000)、HO-1(1∶1000),以β-actin(1∶5000)作为内参对照。
1.5 实时荧光定量PCR与数据分析 将培养24 h后的细胞样品按RNA提取试剂盒的说明书提取总RNA,按逆转录试剂盒的说明书将RNA 逆转录成cDNA,按扩增试剂盒的说明书对目的基因进行扩增。PCR 反应条件:预处理95 ℃30 s;PCR循环(40循环):95 ℃5 s,60 ℃30 s,72 ℃15 s。获得目的基因的扩增曲线和熔解曲线。以β-actin为内参基因,用2-△△CT法计算目的基因相对表达量。引物序列见表1。

表1 引物序列
1.6 慢病毒转染 将细胞以5×104个/毫升接种在6孔板中,待细胞贴壁后,将细胞分为沉默NRF2组(si-NRF2组)和空载病毒组(si-NC组)。根据细胞的MOI及病毒滴度,加入适宜体积的病毒悬液和相应的增强液,让细胞在完全培养基下孵育。12~16 h后,将各组的细胞培养液更换为无特殊处理的完全培养基。观察转染效率,待细胞融合度达到80%时,对细胞进行传代,并加入嘌呤霉素筛选,得到转染后的稳定细胞株,用于后续实验。
1.7 流式细胞术检测细胞凋亡 将处于对数生长期的si-NRF2组细胞及NC组细胞按照5×105个/孔接种于6孔板内,待细胞贴壁后,根据预先设置好的分组对细胞的培养基进行更换,具体为:si-NC组和si-NRF2组中加入无特殊处理的F-12K完全培养基,si-NC+氯胺酮组和si-NRF2+氯胺酮组中加入含有浓度为2 mM氯胺酮的F-12K完全培养基。将处理好的细胞在培养箱中孵育24 h后,根据流式凋亡试剂盒说明书进行凋亡检测操作。
1.8 SOD检测 利用RIPA裂解液提取各组细胞的总蛋白,接着根据试剂盒说明书对细胞进行超氧化物歧化酶(superoxide dismutase,SOD)检测,检测后的SOD值与总蛋白浓度的比值就是该组细胞的SOD浓度。

2 结果
2.1 氯胺酮可降低SV-HUC-1细胞中NRF2的表达水平 在光学显微镜下观察了0 mM、1 mM、2 mM、4 mM的氯胺酮对SV-HUC-1细胞的影响,观察到随着氯胺酮浓度的增高,细胞大量死亡,细胞体肿胀,解体(见图1A~图1D)。选取2 mM为氯胺酮工作浓度。为了探究NRF2是否参与了KC的形成过程,利用Western blot检测了0 mM、1 mM、2 mM、4 mM氯胺酮共培养后的SV-HUC-1中NRF2的表达丰度,结果如图1E所示。结果显示氯胺酮共培养的各组SV-HUC-1细胞中的NRF2表达丰度较CON组显著降低(P<0.001)。

注:A~D:不同氯胺酮浓度(0 mM、1 mM、2 mM、4 mM)共培养后的细胞形态;E:不同浓度(0 mM、1 mM、2 mM、4 mM)氯胺酮共培养后的SV-HUC-1中NRF2的表达丰度;与CON组比较,**P<0.01,***P<0.001。
2.2 构建稳定转染的沉默NRF2基因SV-HUC-1细胞 利用慢病毒载体对细胞进行转染,通过反复的药物筛选,成功构建了沉默NRF2的细胞株,为了对慢病毒转染的效果进行评估,首先对si-NRF2和si-NC组的细胞进行了荧光显微镜下成像的观察,发现经过慢病毒转染后的细胞均产生大量绿色荧光(见图2C)。随后,对si-NRF2和si-NC组细胞的NRF2蛋白表达丰度进行了检测,结果显示,si-NRF2组(0.654±0.086)的SV-HUC-1细胞的NRF2的表达丰度显著低于si-NC组(0.868±0.096),P<0.05(见图2A、图2B)。
2.3 NRF2表达降低可增加氯胺酮刺激后的细胞凋亡率 通过沉默NRF2,以进一步探究其对SV-HUC-1细胞所受氯胺酮损伤的保护作用。对慢病毒转染后的各组细胞按照分组进行相关处理后,利用流式细胞术对各组细胞的凋亡率进行了分析。发现si-NRF2+氯胺酮组(14.717±0.601)%和si-NC+氯胺酮组(10.890±0.429)%的细胞凋亡率显著高于si-NC组[(8.560±0.846)%,P<0.01]和si-NRF2组[(9.023±0.703)%,P<0.01];且si-NRF2+氯胺酮组的凋亡率显著高于si-NC组+氯胺酮组(P<0.001),见图3。这项结果表明沉默NRF2后可能会让SV-HUC-1细胞更易受到氯胺酮的直接损伤,进一步证明了NRF2可能是KC的重要保护性靶点。
2.4 褪黑素可增加NRF2的表达水平并提高氯胺酮刺激后的细胞活力 褪黑素作为一种常见的抗氧化剂,且可通过上调NRF2通路保护细胞免受多种损伤。为了探究褪黑素是否可通过上调NRF2而减少氯胺酮导致的尿路上皮细胞损伤,首先利用CCK-8检测了2 mM氯胺酮与不同浓度褪黑素共培养后的SV-HUC-1细胞活力的差异。当褪黑素浓度为50~100 μM时,褪黑素能上调氯胺酮引起的SV-HUC-1细胞活力的降低(P<0.0001)(见图4A)。除此之外,KET+褪黑素组SV-HUC-1细胞的抗氧化蛋白SOD(20.521±1.351)显著高于CON组(15.461±2.018,P<0.0001)和KET组(15.763±2.216,P<0.0001)(见图4C),我们进一步推测褪黑素对SV-HUC-1细胞的保护作用可能是通过提高其在受到病理刺激后的抗氧化能力而实现的。同时,我们利用实时荧光定量PCR检测了各组细胞炎性指标IL-6 mRNA水平的变化,结果显示KET组的IL-6 mRNA表达水平(1.415±0.286)显著高于CON组(1.024±0.230,P<0.01);KET+褪黑素组(1.026±0.344)的IL-6 mRNA表达水平显著低于KET组(P<0.01)(见图4B)。我们接下来利用Western blot分析了各组细胞的蛋白表达丰度差异(见图4D)。结果显示,KET组SV-HUC-1细胞NRF2的表达丰度(0.428±0.101)低于CON组(1.500±0.081,P<0.0001);KET+褪黑素组的NRF2表达丰度(0.804±0.100)高于KET组(P<0.01)。除此之外,KET+褪黑素的HO-1的表达丰度(1.419±0.098)高于CON组(0.352±0.168,P<0.0001)和KET组(0.199±0.046,P<0.0001)。我们推测,褪黑素能够引起SV-HUC-1细胞中NRF2蛋白表达水平升高,并减少细胞所受的氯胺酮导致的直接损伤。结果证明了褪黑素作为治疗KC药物的可能性,而NRF2可能是治疗药物的重要靶点,进一步证明了NRF2对于改善尿路上皮损伤的重要性。

注:A为利用Western blot展示的慢病毒转染后的各组细胞NRF2表达丰度;B为灰度分析;C为慢病毒转染后各组细胞的荧光表现。*P<0.05。

注:**P<0.01,***P<0.001。
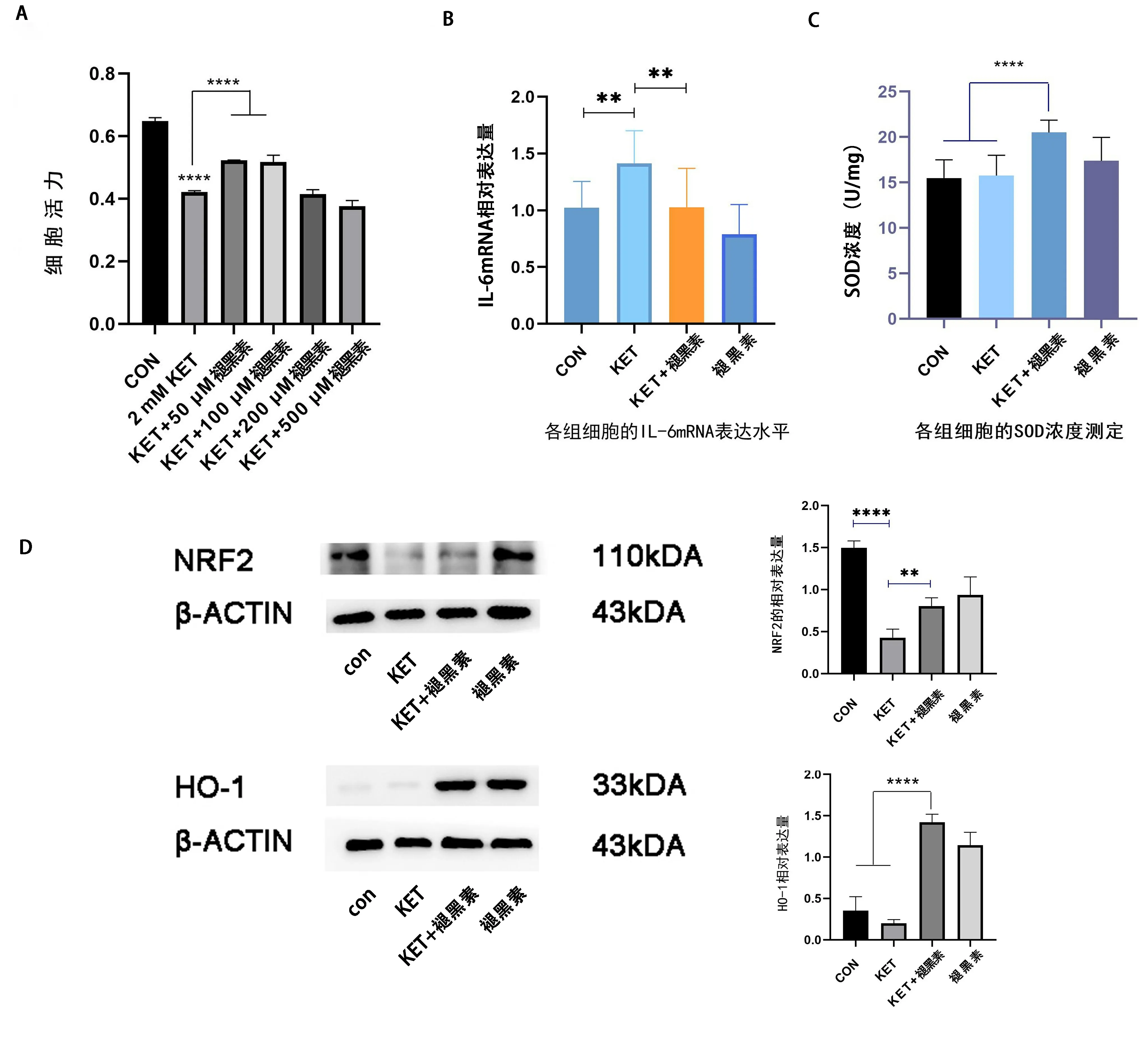
注:A为2 mM氯胺酮与不同浓度褪黑素共培养后的细胞活力比较;B为氯胺酮与褪黑素共培养后的各组细胞的IL-6 mRNA表达差异;C为胞内SOD浓度变化;D为氯胺酮与褪黑素共培养后的各组细胞的NRF2和HO-1表达丰度。**P<0.01,****P<0.0001。
3 讨论
KC作为一种化学药物引发的尿路上皮损伤,由于其发病机制不明,治疗方式单一,自发现以来就一直是泌尿系统中的一种非常棘手的疾病。本研究通过慢病毒转染的方式沉默NRF2,探讨了NRF2在KC中的保护作用;我们还在细胞层面验证了褪黑素作为保护药物的可能性。
自从2007年首次报道KC以来,已经有很多学者对KC的发生发展进行了研究。尿液中的高浓度的氯胺酮和去甲氯胺酮的长期刺激可能会直接损伤膀胱黏膜,引起KC患者膀胱黏膜减少和间质纤维化,从而引起膀胱炎[17]。多项研究也通过建造大鼠KC模型证明了氯胺酮增加了大鼠膀胱组织的活性氧(reactive oxygen species,ROS)含量,并促进了膀胱黏膜的损伤和纤维化,这与我们的设想是一致的[18]。ROS包括过氧化氢(H2O2)、羟基自由基(-OH)、超氧阴离子(O2-)和一氧化氮 (NO),这些物质不稳定且具有高反应性。ROS通常在细胞中水平较低,正常范围内的ROS对于维持细胞稳态和功能至关重要[19]。机体由于各种病理情况导致体内氧化/抗氧化失衡会导致ROS的过量积累,这种生理机制的不平衡会引起炎性细胞因子和趋化因子的表达增加,从而导致细胞内多种大分子结构和功能的改变。在ROS产生增加的情况下,细胞会激活针对ROS的抗氧化防御机制,这种防御机制会帮助去除细胞内的ROS分子[20-21]。在这个过程中,SOD可过将O2-转化为H2O2来防止氧化应激,而H2O2会被过氧化氢酶进一步消除。NRF2/HO-1信号轴是生物体进化过程中形成对外界刺激防御的一种抗损伤机制,也是氧化应激的主要细胞传感器[22]。当NRF2激活时,它可进入细胞核并结合到特定的位点来激活抗氧化酶HO-1。HO-1有助于维持细胞内氧化还原平衡,从而保护细胞免受氧化应激损伤。我们的结果表明,NRF2的表达降低可增加细胞受到损伤后的凋亡率,而褪黑素可能是一种通过上调NRF2以治疗KC的潜在药物。褪黑素能逆转多种因素导致的损伤,并可以通过增加谷胱甘肽含量来诱导抗氧化能力[23]。NRF2及其相关途径的进一步研究对炎症相关疾病的临床治疗仍具有重要意义[24]。据报道,褪黑素可以激活NRF2并抑制MC3T3-E1的铁死亡,还可减轻氧化应激和炎症从而保护脑组织[25-26]。我们的结果表明,褪黑素可以提高细胞内NRF2蛋白的表达水平,能够上调氯胺酮诱导的SV-HUC-1细胞活力的降低,提高了受损细胞的SOD表达量,并减少SV-HUC-1细胞所受的炎性损伤。这些研究都揭示了褪黑素在维持SV-HUC-1细胞氧化/抗氧化平衡中的作用。然而有研究发现NRF2的持续过度表达可能是有害的,最近的研究提出了还原性应激的概念,NRF2也可能参与了这一过程,还原性应激是由细胞内产生过量的还原型辅酶Ⅱ,以及抗氧化系统的巨大激活和氧化活性的抑制而引起的,这也解释了为何我们加入过量的褪黑素会降低细胞活力[27-28]。
这项研究还存在一些局限性,褪黑素的保护作用可能存在时效性,我们只对单个时间点的相关指标进行检测,没有设立多时间点检测相关指标的变化;其次,我们没有设置褪黑素的预处理组,预处理后的细胞可能具有更强的保护作用;除此之外,氯胺酮对细胞的损伤机制是及其复杂的,除了氧化应激损伤之外,可能还会因ROS的过量产生导致脂质过氧化,进而引发铁死亡。以上缺陷将在接下来的研究中进一步解决。
综上所述,我们利用细胞模型探究了NRF2对尿路上皮所受氯胺酮损伤的保护作用。我们的结果表明,氯胺酮可引起NRF2表达水平降低,且NRF2表达减少后的细胞对氯胺酮的刺激更为敏感;而褪黑素可能会通过上调细胞的NRF2表达水平减少细胞所受损伤,我们猜测NRF2可能是治疗和预防KC的关键靶点。
