丁苯酞对硝苯地平在大鼠体内药动学及机制的影响研究Δ
2022-05-19薛朝军杜雨晗董占军
薛朝军,杜雨晗,赵 越,董占军#
(1.河北省人民医院药学部,石家庄 050051; 2.河北省人民医院神经内五科,石家庄 050051)
丁苯酞是从芹菜籽中提取的挥发油中的一种药理活性成分,作为Ⅰ类新药于2004年获批上市,用于改善急性缺血性脑卒中患者的神经功能缺损。近年来研究结果显示,丁苯酞对血管性痴呆[1]、帕金森病[2]等疾病也有一定的疗效。丁苯酞的药理作用包括抗血小板聚集、抗血栓、线粒体保护、神经元保护、抗氧化应激和促进神经再生等[3-4]。系统评价[5]与大量的临床研究[6-7]结果显示,丁苯酞治疗缺血性脑卒中的疗效和安全性良好,已被纳入《中国脑卒中防治指导规范(2021年版)》[8]和《缺血性卒中基层诊疗指南(2021年)》[9]等最新的临床实践指南。
《中国脑卒中防治报告2019》[10]指出,我国的脑卒中整体发病率可达39.9%,居世界首位,近年来脑卒中已成为第一死亡原因,给我国造成沉重的经济负担,且其发病率呈快速升高趋势。值得注意的是,在我国人群中,脑卒中最主要的心脑血管风险为高血压。临床上,钙通道阻滞剂为治疗高血压病的一线药物,也是脑卒中一级预防与二级预防中抗高血压药的首选[8]。钙通道阻滞剂与丁苯酞在临床存在广泛联合应用的现象[11-12]。但钙通道阻滞剂与丁苯酞相互作用的研究较少。杨秀岭等[13]的研究结果表明,丁苯酞可使大鼠体内硝苯地平吸收减少、消除加快。Wang等[14]的研究结果显示,丁苯酞与尼莫地平在比格犬中没有显著的药动学相互作用。丁苯酞与硝苯地平的相互作用可能导致脑卒中患者的高血压不能达到治疗目标。因此,进一步研究丁苯酞与硝苯地平可能的药物相互作用及作用机制对临床联合用药有着重要意义。本研究旨在探讨丁苯酞对硝苯地平在大鼠体内药动学的影响及其相关作用机制。
1 材料
1.1 动物
本研究所使用的雄性SD大鼠[平均体重(250±20)g]由河北医科大学实验动物中心提供,生产合格证号为1707095,使用许可证号为SCXK(冀)2013-10003。
1.2 仪器
Sciex 5500型三重四级杆串联质谱仪(美国AB公司);Shimadzu LC-30AD型超高效液相色谱系统(日本岛津公司);Zentrifuge 1602型高速低温离心机(德国Hettich公司);AB204-S型标准型分析天平(瑞士Mettler Toledo公司);平衡透析袋(扁宽31 mm,截留分子量500 D)、PBS溶液(北京索莱宝科技有限公司)。
1.3 药品与试剂
丁苯酞(石药集团,纯度>98%);硝苯地平(索莱宝生物科技有限公司,批号201404,纯度>98%),尼莫地平(索莱宝生物科技有限公司,批号201424,纯度>98%)。
2 方法
2.1 应用超高效液相色谱-串联质谱法(LC-MS/MS)建立生物样品中硝苯地平的分析方法
2.1.1 色谱条件:色谱柱为Waters ACQUITY®UPLC HSS T3(100 mm×2.1 mm,1.8 μm);流动相为乙腈(B)-0.1%甲酸水(A),梯度洗脱(0.5 min,50% B;1 min,60% B;3 min,80% B;4 min,90% B;4.5 min,停止);流速为0.3 mL/min;进样量为5 μL。
离子源选择电喷雾电离源,使用多反应监测模式下的正离子扫描,离子源喷射电压为5 500 V;离子源温度为500 ℃;源内气流速(GS1,GS2)为50 L/min;气帘气压力为68.95 kPa;碰撞气压力为68.95 kPa。Compound参数,硝苯地平DP 120 eV,CE 25 eV;尼莫地平DP 95 eV,CE 10 eV;EP均为10 eV,CXP均为14 eV。离子对,硝苯地平m/z347.1→254.1;内标尼莫地平m/z419.2→343.2。
2.1.2 储备液和工作液制备:精密称取适量的丁苯酞、硝苯地平和尼莫地平标准品,使用甲醇于10 mL棕色容量瓶溶解稀释至刻度后摇匀,配制成储备液。精密吸取适量储备液后稀释定容,制备成系列浓度的工作液。储备液与工作液均需置于4 ℃冰箱中保存备用。
2.1.3 生物样品预处理:取大鼠血浆50 μL,加入内标5 μL,涡旋30 s,加入甲醇150 μL作为沉淀剂后涡旋混匀2 min,转速11 573 r/min,离心半径8 cm,离心10 min,取50 μL用于LC-MS/MS分析。
2.1.4 标准曲线和质控样品:精密量取相应工作液5 μL,用大鼠空白血浆45 μL稀释得到硝苯地平终浓度为1、5、10、50、100、500和1 000 ng/mL的血浆标准曲线及硝苯地平终浓度为 2、50和800 ng/mL的低、中及高浓度质量控制(QC)样品。
2.1.5 专属性考察:分别取6只大鼠的空白血浆,按照“2.1.4”项下要求,制备1 ng/mL的硝苯地平和尼莫地平血浆样品,考察血浆成分是否干扰硝苯地平和尼莫地平的测定。
2.1.6 线性和最低定量限考察:按照“2.1.4”项下要求,制备3条标准曲线样品,同批次处理并分析,以硝苯地平浓度为横坐标,硝苯地平和尼莫地平的峰面积比值为纵坐标,回归运算使用加权最小二乘法,使用软件绘制标准曲线,计算线性回归系数r2。当信噪比S/N>10时,最低定量为标准曲线的最低浓度。
2.1.7 精密度和准确度考察:按照“2.1.4”项下要求,制备平行5份的3个浓度的QC样品,连续检测3 d。每日计算QC样品的浓度,对3 d的结果进行方差分析,得到QC样品的日内和日间精密度。
2.1.8 回收率和基质效应考察:按照“2.1.4”项下要求,制备3个QC浓度的血浆样品,为样本Ⅰ。取大鼠的空白血浆100 μL,加入甲醇300 μL,涡漩30 s。转速11 573 r/min,离心半径8 cm,离心10 min后取上清液,取适量工作液配置成3个QC浓度的样品,为样本Ⅱ。取3个浓度的QC工作液,直接进样,为样本Ⅲ。计算公式为回收率=样本Ⅰ/样本Ⅱ;基质效应=样本Ⅱ/样本Ⅲ。
2.1.9 稳定性:本研究考察了血浆样品在室温(25 ℃)放置4 h、经历3次冷冻-解冻循环以及血浆样品-20 ℃冷冻15 d的稳定性。使用低、中和高浓度的QC血浆样品,进行稳定性分析。用空白大鼠血浆稀释工作液,考察稀释稳定性,稀释倍数为10、20、50和100。
2.1.10 生物样品试用性:按照“2.1.4”项下要求,制备3个浓度的细胞裂解液QC样品用来考察生物样品试用性。
2.2 大鼠体内药动学实验
实验前,大鼠禁食过夜,不限饮水。将实验药物混悬于0.5% CMC-Na溶液,对照组大鼠给予硝苯地平10 mg/kg,实验组大鼠给予硝苯地平10 mg/kg联合丁苯酞80 mg/kg,每组6只,灌胃给药。在0、0.08、0.25、0.5、0.75、1、1.5、2、4、6、8、10和12 h于眼底静脉丛取血0.5 mL,立即3 000 r/min(离心半径8 cm)离心10 min,取血浆于-20 ℃保存。
2.3 大鼠体外翻转肠实验
实验分组如下:单用组大鼠给予硝苯地平4 mg/L;合用1组、合用2组和合用3组大鼠分别给予硝苯地平4 mg/L+丁苯酞4、16和32 mg/L。取SD大鼠12只,麻醉后于腹中线打开腹腔,取约10 cm空肠,每只大鼠取2段共24段空肠,每组6段。将取出的空肠于冰冷的PBS中小心除去肌肉与脂肪,轻柔翻转后使黏膜向外。将近心端固定于取样口并结扎远心端。肠囊内加入5%葡萄糖作为受药体系,用预热的37 ℃ PBS配制各实验组浓度的药液作为供药体系,将肠囊垂直放入供药体系温孵平衡,受药体系液面应高于供药体系。于30、60和90 min收集受药体系内溶液50 μL,保存于-20 ℃待测。
2.4 平衡透析法
2.4.1 透析袋预处理:将透析袋剪成10 cm小段,在2%NaHCO3(w/v)、1 mmol/L乙二胺四乙酸溶液中煮10 min,蒸馏水清洗后在1 mmol/L乙二胺四乙酸溶液(pH=8.0)中煮10 min,自然冷却后于4 ℃中保存备用。
2.4.2 平衡透析实验:处理过的透析袋一端折叠后用缝线扎紧,在另一端加入新鲜大鼠血浆2 mL后用缝线扎紧,注意留一小段气泡,将加入大鼠血浆的透析袋悬浮于20 mL含药透析液的广口棕瓶中。分组如下,对照组给予硝苯地平4 mg/L;丁苯酞低、中及高剂量组分别给予硝苯地平4 mg/L+丁苯酞2、4及8 mg/L。每组平行3次。根据预实验结果,平衡时间12 h,平衡温度2~8 ℃。待透析平衡后,精密吸取透析袋内外液各200 μL并测定,透析袋内药物浓度为总浓度(Ct);透析外液中的药物浓度为离药物浓度(Cf)。药物血浆蛋白结合率=(Ct-Cf)/Ct×100%。
2.5 统计学方法
3 结果
3.1 生物样品中硝苯地平LC-MS/MS分析方法
3.1.1 专属性、标准曲线和最低定量限:本方法专属性高,硝苯地平和内标尼莫地平的保留时间分别为2.53和3.47 min,空白血浆中的内源性物质不干扰硝苯地平和内标的测定。标准曲线方程为Y=0.018 4X+0.026 7,r=0.995 6。线性范围为1~1 000 ng/mL。硝苯地平在上述范围内线性良好,最低定量限为1 ng/mL,RSD为5.50%<15%。结果见图1。

A.硝苯地平保留时间;B.尼莫地平保留时间;C.硝苯地平空白血浆;D.尼莫地平空白血浆;E.硝苯地平最低定量限A. retention time of nifedipine; B. retention time of nimodipine; C. blank plasma of nifedipine; D. blank plasma of nimodipine; E. minimum limit of quantitation of nifedipine图1 硝苯地平与尼莫地平的保留时间、空白血浆及硝苯地平最低定量限质谱图Fig 1 Mass spectrum of retention time and blank plasma of nifedipine and nimodipine, and the minimum limit of quantitation of nifedipine
3.1.2 方法学验证结果:(1)精密度和准确度。硝苯地平QC样品(2、50及800 ng/mL)的日内精密度RSD为3.8%~10.5%;日间精密度RSD为-1.8%~11.5%;准确度RSD为4.5%~7.9%,均<15%。精密度、准确度符合方法学要求。(2)回收率和基质效应。硝苯地平QC样品回收率均>90%,无显著差异,基质效应>85%,基质效应恒定。(3)稳定性。硝苯地平QC样品室温放置4 h、经历3次冷冻-解冻循环、血浆样品-20 ℃冷冻15 d,与新配制样品相比,检测结果无显著差异。稳定性符合方法学要求。(4)稀释10、20、50及100倍后,硝苯地平的精密度和准确度可满足要求,表明样品可被稀释。
3.2 大鼠体内药动学结果
实验组与对照组大鼠体内硝苯地平的药时曲线见图2,主要药动学参数见表1。与对照组相比,实验组大鼠硝苯地平的药时曲线下面积(AUC)、峰浓度(Cmax)明显降低,表观分布容积(V/F)明显升高,差异均有统计学意义(P<0.05);半衰期(T1/2)缩短,清除率(CL/F)升高,差异无统计学意义(P>0.05)。

图2 硝苯地平在大鼠体内的药时曲线Fig 2 Drug-time curve of nifedipine in rats
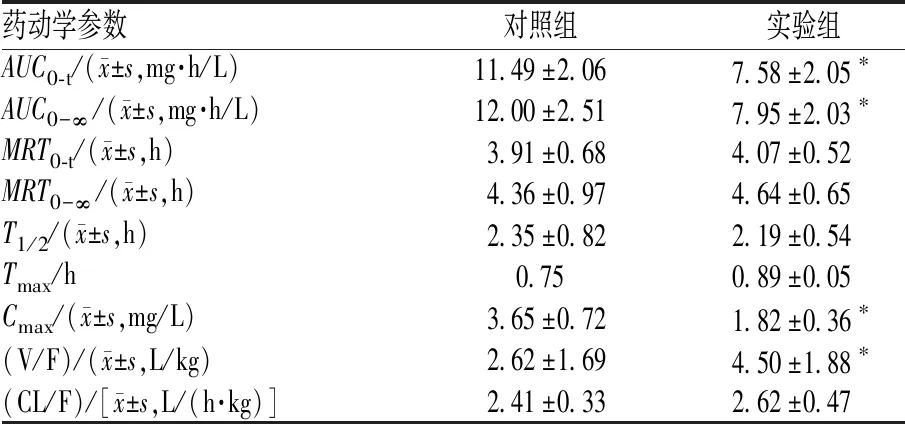
表1 硝苯地平在大鼠体内的药动学参数Tab 1 Pharmacokinetic parameters of nifedipine in rats
3.3 大鼠体外翻转肠实验
翻转肠肠囊内硝苯地平浓度结果见图3。丁苯酞抑制硝苯地平在大鼠肠道的吸收,在30、60 min 2个时间点,与单用组相比,各合用组肠囊内硝苯地平浓度均降低,其中合用2组、合用3组与单用组的差异有统计学意义(P<0.05)。合用组中随着丁苯酞浓度的增加,肠囊内硝苯地平浓度降低,丁苯酞对硝苯地平吸收的抑制作用表现出浓度依赖性。

图3 丁苯酞对硝苯地平体外肠道吸收的影响Fig 3 Effects of butylphthalide on in vitro intestinal absorption of nifedipine
3.4 血浆蛋白结合率
丁苯酞对硝苯地平血浆蛋白结合率的作用见图4。对照组硝苯地平的平均血浆蛋白结合率为(93.25±2.32)%;丁苯酞低、中及高剂量组硝苯地平的平均血浆蛋白结合率分别为(93.75±2.82)%、(94.50±2.35)%和(93.00±2.59)%,各组间的差异均无统计学意义(P>0.05)。

图4 丁苯酞对硝苯地平血浆蛋白结合率的影响Fig 4 Effects of butylphthalide on plasma protein binding rate of nifedipine
4 讨论
一项约14 000名中老年高血压受试者参与的临床研究结果表明,收缩压标准差增加5 mm Hg(1 mm Hg=0.133 kPa),死亡风险、心血管事件风险分别增加10%、15%[15]。临床上,脑卒中患者常合并高血压,因此,脑卒中患者的高血压达标治疗对疾病预后有重要意义。血压变异性(BPV)与靶器官损伤(包括左心室肥厚、脑小血管疾病和肾功能降低[16]等)、心脑血管事件及死亡率密切相关。因此,除了降低平均血压外,控制BPV应该是一个新的目标[17]。药物相互作用是影响BPV的重要因素[18]。脑卒中伴高血压患者常联合应用多种药品,药物相互作用对血压控制的影响不容忽视。本实验在大鼠体内证明了丁苯酞抑制硝苯地平的吸收(AUC、Cmax显著降低)并增强其代谢(T1/2缩短、CL/F升高),提示BNP与硝苯地平合用时可能影响患者的血压控制,增加BPV。
药物在吸收相的相互作用主要发生在肠道,通过体外翻转肠囊实验证明,丁苯酞抑制了硝苯地平在大鼠肠道的吸收,其抑制作用随着丁苯酞浓度的升高有增强趋势,表现出浓度依赖性。P糖蛋白(P-gp)是肠道药物相互作用的重要靶点[19]。硝苯地平为P-gp的底物。P-gp的抑制剂吡格列酮[20]、氟伐他汀和辛伐他汀[21]等可以在肠道抑制硝苯地平的外排从而显著增加硝苯地平在肠道的吸收。但P-gp的强抑制剂环孢素与硝苯地平合用并不引起硝苯地平药动学参数的显著变化,提示P-gp在肠道处置硝苯地平的过程并不占主要地位[22]。有研究结果表明,血脑屏障中P-gp参与了丁苯酞主要代谢物3-OH-NBP的外排,提示3-OH-NBP为P-gp的底物[23]。但丁苯酞与P-gp的关系尚未见报道。转运体介导的丁苯酞与硝苯地平在大鼠肠道的相互作用尚需进一步研究探讨。
硝苯地平主要经CYP3A4代谢[24],丁苯酞主要经CYP3A4、CYP2E1和CYP1A2代谢[25]。两者的主要代谢酶均为CYP3A4。但有研究结果表明,体外较高浓度丁苯酞仅对人CYP2C19有一定的抑制作用,且丁苯酞对肝微粒体CYP450主要同工酶无显著诱导和抑制作用[26]。丁苯酞增强硝苯地平代
谢可能有其他机制的参与。硝苯地平血浆蛋白结合率为92%~98%,丁苯酞可能与硝苯地平竞争血浆蛋白结合位点从而增加硝苯地平的游离药物浓度,由于肝脏只能摄取游离的药物进行代谢,因此硝苯地平游离浓度的升高可能导致其代谢加快。但实验结果表明,丁苯酞在体外并不能影响硝苯地平的蛋白结合率。值得注意的是,丁苯酞在体内的代谢产物多达49种,血浆中的主要代谢物分别为3-OH-NBP、M286-8和M284-2[25],其主要代谢物3-OH-NBP的血浆蛋白结合率约为80%[23]。丁苯酞代谢物对硝苯地平的蛋白结合率的影响仍需进一步探究。
