人工卵巢的研究进展和应用前景
2022-05-18黄嫦嫦殷伟蔚金敏封纯
黄嫦嫦,殷伟蔚,金敏,封纯*
(1.浙江大学医学院附属第二医院,杭州 310009;2.杭州市临平区第一人民医院妇科,杭州 311100)
随着肿瘤诊断和治疗技术的发展,肿瘤患者的生存率明显提高,但肿瘤治疗中的化疗和放疗可能会破坏女性卵巢储备功能,导致不孕不育、更年期症状、骨质疏松和内分泌功能障碍等,从而降低女性的生育力和生活质量。目前,胚胎冷冻、卵母细胞冷冻是可行的生育力保存方式,但有一些肿瘤患者因病情不允许或青春期前的女性不能进行促排卵治疗而不能使用该技术[1]。此外,胚胎冷冻、卵母细胞冷冻技术局限于肿瘤治疗后可恢复生育能力的患者,其并不能改善因卵巢功能减退导致其他副作用的患者的生育需求。为解决上述问题,有研究者采用放、化疗前冻存卵巢组织,肿瘤治愈后再植入的方法保存生育力。有研究发现,冻融卵巢组织移植术后可获得妊娠或者活产[2]。目前,冻融卵巢组织移植术的活产率可达到35%以上[3]。
尽管卵母细胞没有引入肿瘤的风险,但周边卵巢组织可能被侵犯,如血液淋巴系统及卵巢的恶性肿瘤可能将癌细胞重新引入体内,所以,更安全的方法是构建人工卵巢(artificial ovary)。Laronda等[4]通过3维(3D)打印技术将明胶制成生物支架,在支架中植入卵泡后分别移植到9只小鼠体内,随后在7个人工卵巢中发现了存活的卵泡,且卵泡分泌激素刺激乳汁生成,提示人工卵巢具有生育力保存和维持正常内分泌的功能,也证明组织工程学与生殖医学的结合是未来发展的可行方案。Pors等[5]通过去除人卵巢组织中易造成癌细胞生长的成分,制作出“脱细胞支架”,再将未成熟的人和小鼠卵泡与其整合后移植到雌性小鼠中,发现大约有25%的人类和小鼠卵泡可以恢复活性,这标志着人类卵泡首次在“脱细胞支架”上存活下来。由此推断,人工卵巢可能解决肿瘤患者的生育问题并提高生活质量。
一、人工卵巢简介
人工卵巢是指在生物材料构成的半固体3D骨架结构内种植未成熟卵泡、卵巢基质细胞和内皮细胞后形成的复合物[6-7]。其常用的生物材料包括藻酸盐、壳聚糖、细胞外基质、纤维蛋白、透明质酸、胶原蛋白、聚乙二醇(PEG)等[8]。人工卵巢移植入生物体内后,未成熟卵泡可发育成熟并分泌性激素。患者可以选择冷冻保存卵巢组织或整个卵巢,需要妊娠时从解冻的卵巢组织中分离卵泡,放置在配有生长因子、内皮细胞和卵巢基质细胞的支架中构建人工卵巢。人工卵巢移植成功后,卵母细胞为后续的生殖过程提供配子,颗粒细胞和卵泡细胞提供雌性类固醇激素[9]。
二、人工卵巢的制作过程
1.卵巢组织的获取及冷冻保存:切除多少卵巢组织主要与未来的治疗计划和现有的卵巢容积相关。由于大多数卵泡位于卵巢皮质中,少量的卵巢皮质组织足以进行生育力保存,但如果患者丧失生育能力的风险很高,冷冻保留整个卵巢可以确保获得最大数量的原始卵泡,为后续治疗提供更多的机会[10]。
目前,用于卵巢组织冷冻的方法有程序化慢速冷冻和玻璃化快速冷冻两种(表1)。关于卵巢组织低温保存的最佳技术还没有达成共识,但是,目前已获得活产的病例都是采用程序化慢速冷冻保存[11]。研究表明,程序化慢速冷冻在原始卵泡保存、卵泡细胞增殖、血管生成、抗苗勒管激素表达和脱氧核糖核酸损伤方面均优于玻璃化快速冷冻[12]。但就整个卵巢而言,冷冻过程中细胞内、外冰晶的形成,特别是血管内冰晶的形成会破坏器官的结构并损害其功能。冷却速率也受到冷冻器官尺寸和几何形状的限制,冷却所需的低温很难在有限时间内均匀地传递给所有细胞,所以,目前还没有最有效的冷冻保存方案[13]。至今为止,冷冻小块卵巢组织以防止卵泡丢失和损伤是比较理想的选择。

表1 程序化慢速冷冻和玻璃化快速冷冻方法比较
2.卵泡的分离和选择:目前,机械法、酶法和机械/酶结合法广泛用于从卵巢组织中分离卵泡。其中,机械法(手动搅拌器或手术刀)分离卵泡能保持卵泡基底膜的完整性但获卵率相对较低。酶法获卵率较高,但卵泡的基底膜损伤,卵泡发育欠佳。大多数原始卵泡分布在卵巢皮层纤维中,将机械法和酶法结合消化卵巢皮质可获得较高的获卵率且获得的卵泡质量高,此法在临床较为常用[8]。目前,形态正常和颗粒细胞层完整的存活卵泡的回收率仍然不尽如人意。研究发现,用Lymphosep分离液进行颗粒细胞分离,使得获取卵泡更可行,成本更低[14]。恶性肿瘤患者的卵巢组织行卵泡分离时需重点关注的问题是恶性细胞可能污染悬浮液。Soares等[15]设计了一种洗涤步骤,将分离的卵泡从一个液滴转移到另一个液滴,从而将其与周围细胞分离,在分离前66%的卵巢组织和消化的卵巢悬浮液中可检测到白血病细胞,分离后所有的卵泡样本的白血病细胞检测结果均呈阴性。有研究表明,人工卵巢中移植次级卵泡的卵泡生存率和生长率均优于移植原始卵泡[16]。
3.卵巢基质细胞和内皮细胞:卵泡的生存和生长取决于卵泡与周围卵巢细胞和细胞外基质之间的对话,早期卵泡的发育是由卵泡和卵巢基质的卵巢自分泌/旁分泌调节控制的。在原始卵泡激活后,原始卵泡分泌因子从卵巢基质招募成纤维细胞样前体细胞或干细胞并分化成功能细胞,基质细胞的缺乏可能影响卵泡的存活[5]。因此,卵巢基质细胞与人工卵巢的结合可重建卵泡与周围基质细胞之间的交互,促进卵泡发育[17]。内皮细胞负责卵巢组织的血管重建,运输旁分泌因子、氧和营养物质以及去除代谢废物,提高移植后的血运重建有助于多种细胞的存活。内皮细胞可以在患者完成化疗、放疗后从新鲜的卵巢活检组织中分离出来,化疗并不影响细胞行为[18]。联合使用新鲜卵巢髓质组织的基质细胞和内皮细胞与卵泡联合移植,可以提高人工卵巢的效率[18-19]。另外,小鼠脂肪来源干细胞与早期卵泡的共包埋,有助于颗粒细胞和卵膜细胞的功能和存活,促进卵泡发育[20]。
4.人工卵巢的支架:卵泡3D培养采用以生物材料为基础的支架,对维持卵泡的球形结构具有重要的作用。生物功能化的3D支架通过维持3D卵泡结构、细胞间相互作用和旁分泌信号传导来模拟自然卵巢环境,诱导卵泡发育[21]。理想情况下,支架植入后应具有生物相容性和可降解性,不影响卵泡的生长和运动,并通过提供氧气和营养促进新生血管形成[22]。从广泛的生物材料中选择一种适合人工卵巢的生物材料是具有挑战性的。卵巢支架成分依赖于卵泡发育阶段和特异性,该材料必须复制相应的功能性卵泡周围细胞外基质,并尊重卵巢组织的异质性,以保证其生物模拟性[23]。在研究了胶原蛋白、纤维蛋白、血浆凝块、藻酸盐、壳聚糖水凝胶、脱细胞化卵细胞外基质等天然聚合物和合成聚合物如PEG后,提示合成材料在降解率和机械性能方面更稳定[17],而天然聚合物在细胞粘附、迁移、增值和分化等方面更有优势,进一步通过天然聚合物与合成聚合物相结合而获得混合聚合物水凝胶[24],相关研究的具体信息见表2。
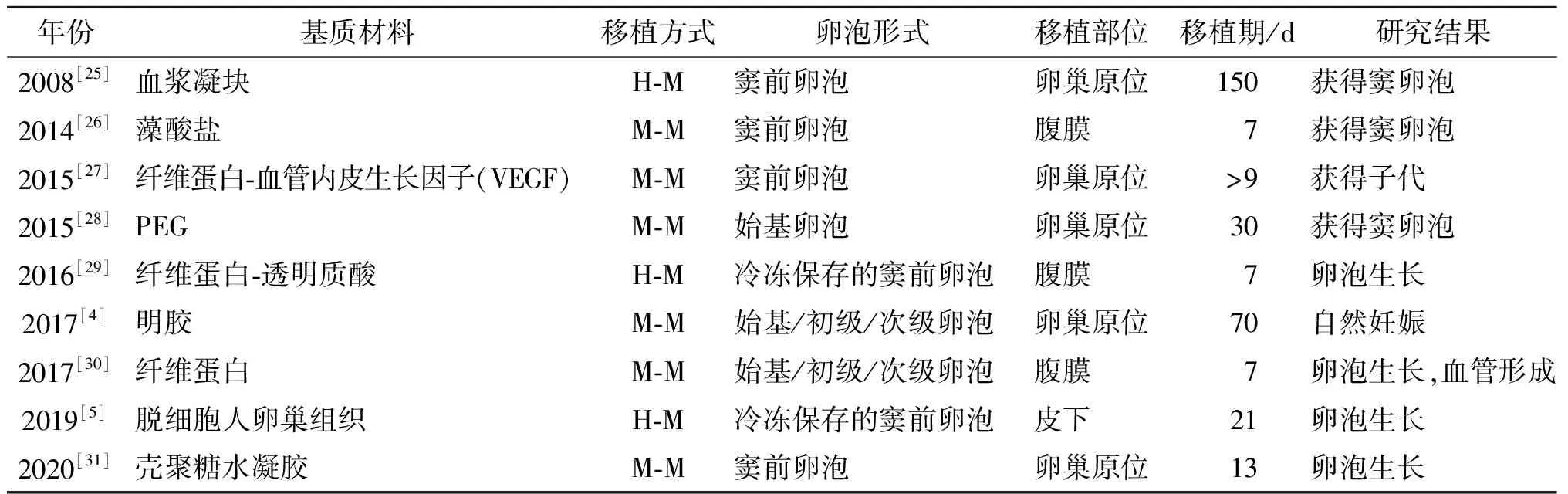
表2 人工卵巢基质材料及相关研究
三、人工卵巢的植入及监测
1.人工卵巢移植部位及注意事项:人工卵巢的移植部位包括原位(盆腔、卵巢、腹膜窗)移植和异位(前臂、颈部、直肌)移植[9]。原位移植在输卵管保持完整及人工卵巢适当定位的情况下可以实现自然妊娠,而异位移植无法自然妊娠[27]。人工卵巢原位移植为卵泡发育提供了良好的环境,有病例报告证明原位移植是有效的[32]。人工卵巢进行异位移植时,应考虑患者的体温、血压、旁分泌因素和血液供应的差异[33]。异位移植移植过程相对简单,重复移植的成本更低。
人工卵巢移植手术后面临的主要问题是免疫排斥反应和缺血性损伤。人工卵巢支架生物材料的免疫反应仍然是一个值得注意的问题,支架设计应考虑缓解免疫反应。移植后机体血管生成和微循环灌注的时效性对人工卵巢的存活和功能恢复至关重要[34]。移植后超声靶向破坏微泡可增加血管生成,通过引起毛细血管内皮损伤造成短暂的炎症反应来增加血流灌注[35]。围手术期使用促红细胞生成素可促进有效血液运输系统的重建[36]。除此之外,血管生成生物材料、内皮细胞、血管内皮生长因子、维生素E、促性腺激素、褪黑素的使用可能改善人工卵巢的移植结局[37-38]。
2.评估与监测:在进行生育力保存手术之前,可以通过检测血清激素水平、B超评估卵巢体积、窦卵泡数及卵巢组织活检等方式评估卵巢储备功能。在解冻和移植卵巢组织后,可通过形态学评估和免疫组织化学了解解冻后和移植后的卵泡情况[38]。当人工卵巢应用于临床时,通过监测C-反应蛋白水平、CD4/WBC计数评估移植后的炎症免疫反应,通过血清激素水平和超声成像评估卵泡发育情况,通过多光谱光声层析成像选择有活力的卵母细胞[39]。此外,确认卵泡内卵母细胞的遗传信息在生育力保存过程中没有被改变非常重要,可在移植前、体内成熟和诱导后对卵母细胞分别进行遗传信息核对。
四、人工卵巢的应用前景
对于不能移植解冻卵巢组织的肿瘤患者以及卵巢功能衰竭患者,可以通过移植人工卵巢恢复生育能力并提高生活质量。人工卵巢提供了一个合适的微环境来研究卵巢干细胞,并评估它们重启人类配子发生的能力,也有助于理解卵泡发生过程。且人工卵巢在毒理学研究中可以为各类药物临床试验提供新的试验体,以阐明不同药物对生殖的影响。随着人工卵巢中卵巢细胞基质的制作技术发展,该技术可以扩展到制造其他人工器官。
一般患者自身冷冻卵巢组织的卵泡可以成为配子的来源,而卵巢早衰患者需要采用捐赠的卵母细胞或其他替代来源,各种来源的干细胞也可成为配子重要的储备。除了胚胎干细胞、诱导多能干细胞,还包括两种在成年哺乳动物卵巢表面上皮中发现的具有高核质比的球形干细胞:即微小胚胎样干细胞和卵巢生殖干细胞,也可作为卵母细胞的其他潜在来源[32]。另外,人卵巢卵泡液(human ovarian follicular fluid,HOFF)中含有蛋白质、卵母细胞和颗粒细胞生长和成熟所必需的细胞外基质。上皮细胞和干细胞可以从HOFF中分离出来,其在HOFF中的培养时间延长后,可以观察到卵母细胞样结构,以上结果证明,从卵泡液中提取的细胞具有干细胞特征,这可能有助于再生医学应用和细胞治疗[40]。
五、社会和生物伦理问题
首先,人工卵巢技术特殊,且其非常重要的特征是疾病风险不仅涉及患者本人,还涉及子代。卵泡体外操作可能会导致卵母细胞的遗传和表观遗传发生变化,这将直接影响子代健康。此外,恶性疾病常常是遗传性的,人工卵巢技术可能将与恶性肿瘤相关的遗传变异传给下一代,人为增加恶性肿瘤患者的占比[41]。其次,如果将人工卵巢的应用范围扩展到非肿瘤患者身上,问题就会变得更加复杂,人工卵巢可能成为因职业或个人原因而推迟生育的方法,但也可能成为遗传操纵工具[32]。除此之外,仍有许多问题需要考虑,如人工卵巢技术是否应该有年龄限制?如果患者已经有了孩子,是否允许再移植?人工卵巢是否影响患者的身心健康?资源如何合理分配?等等。但不可否认的是,人工卵巢技术的发展将为生殖医学领域的进步提供新的思路和方向。
六、小结
迄今为止,在动物研究和人体试验中,人工卵巢可分泌激素并产生卵泡。然而,考虑到其临床应用的遗传安全性和有效性,还需要优化设计人工卵巢支架、改良移植技术以防止术后缺血,并通过选择合理的卵巢组织保存方式及更可靠的卵泡分离方法来提高卵泡的复苏率。人工卵巢不仅为生育力保存带来新希望,也为未来人口老龄化提供了新的生育储备方式;还可能用于濒临灭绝物种的保护,维持生态多样性;同时也可为再生医学提供新的方向。如果未来人工卵巢可以实现临床应用,可能成为组织和器官工程领域新的突破点。
