PM2.5 对慢性阻塞性肺疾病患者巨噬细胞Toll 样受体表达及吞噬功能的影响①
2022-05-18曾晓丽包海荣刘晓菊兰州大学第一医院老年呼吸科兰州730000
曾晓丽 施 凯 庞 琪 包海荣 刘晓菊 (兰州大学第一医院老年呼吸科,兰州 730000)
PM2.5是指空气动力学直径≤2.5µm 的大气颗粒物,是大气污染的重要成分。PM2.5是慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)发病和急性加重的重要危险因素[1]。本研究小组前期研究显示PM2.5可降低COPD 患者及健康者单核细胞来源巨噬细胞(monocyte derived macrophage,MDM)的吞噬功能,机制有待进一步研究[2]。Toll 样受体(Toll-like receptor,TLR)2 和 TLR4 是巨噬细胞表面重要的模式识别受体,可识别并结合颗粒物上的病原体相关模式分子,启动TLR 信号通路,介导吞噬和免疫应答[3-4]。因此本文研究PM2.5对COPD患者MDM TLR 表达及吞噬功能的影响,探讨PM2.5 致COPD 患者MDM 吞噬功能降低是否与TLR2、TLR4相关。
1 资料与方法
1.1 资料
1.1.1 临床资料 选取兰州大学第一医院收治的COPD 急性加重 患 者 14 例,年龄 61~85 岁,符合COPD 诊断标准[5]。选择同期健康志愿者 14 例作为健康组,年龄60~76 岁。COPD 组与健康组年龄、性别、吸烟者构成比、吸烟指数差异均无统计学意义,两组一般资料详见表1。排除合并肺炎、支气管扩张症、肺间质纤维化、支气管哮喘、冠心病、高血压、糖尿病和恶性肿瘤等疾病患者。本研究经兰州大学第一医院伦理委员会批准(LDYYLL2016-0033),研究对象签署知情同意书。
表1 健康组和COPD组一般资料比较(,n=14)Tab.1 General data comparison between healthy group and COPD group(,n=14)
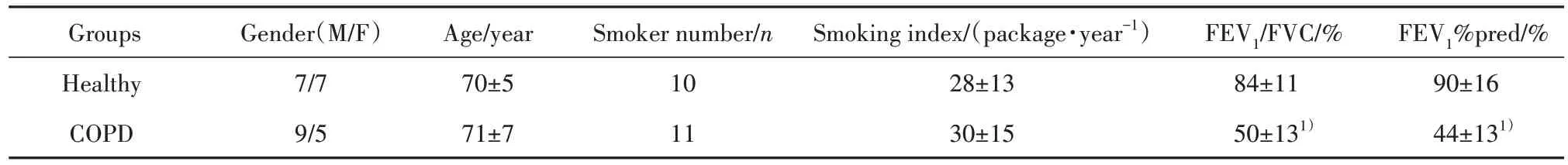
表1 健康组和COPD组一般资料比较(,n=14)Tab.1 General data comparison between healthy group and COPD group(,n=14)
Note:M.Male;F.Female;FEV1.Forced expiratory volume in 1 s;FVC. Forced vital capacity;%pred. %predicted;1)P<0.01 vs Healthy group.
FEV1%pred/%90±16 44±131)Groups Healthy COPD Gender(M/F)7/7 9/5 Age/year 70±5 71±7 Smoker number/n 10 11 Smoking index/(package·year-1)28±13 30±15 FEV1/FVC/%84±11 50±131)
1.1.2 试剂与仪器 重组人粒细胞巨噬细胞集落刺激因子(rhGM-CSF)购自美国RD 公司;qRT-PCR试剂盒购自日本TaKaRa 公司;TLR4 多克隆抗体、TLR2 单克隆抗体购自美国Santa Cruz 公司;荧光标记大肠杆菌吞噬试剂盒(FITC-E.coli)购自美国Invitrogen 公司;中流量悬浮微粒采样器购自武汉天虹仪器厂;PCR 仪购自澳大利亚Cotbett 公司;蛋白电泳、转印系统及化学发光成像系统购自美国Bio-Rad 公司;激光共聚焦显微镜购自日本Olympus公司;流式细胞仪购自美国Beckman Coulter公司。
1.2 方法
1.2.1 PM2.5悬液制备 采集兰州市区PM2.5,将附着PM2.5 的滤膜剪成1 cm×1 cm 小块浸于双蒸水中,超声振荡2 h洗脱PM2.5颗粒,纱布过滤,4 ℃离心(10 000 r/min,20 min),弃上清,下层悬混液倒入塑料平皿中冷冻干燥,收集PM2.5,称重后配制成PM2.5悬液储存液,灭菌备用。
1.2.2 MDM 培养与分组 抽取受试者肘静脉血20 ml,参照 TAYLOR 等[6]方法,分离单核细胞,细胞密度调整至 3×106个/ml,接种于 24 孔板,1 ml/孔,置于5%CO2、37 ℃培养箱培养2 h 后弃去未贴壁细胞,贴壁的单核细胞(5×105个/孔)在含rhGM-CSF(终浓度为2 ng/ml)的RPMI1640 完全培养基中诱导培养12 d获得MDM。倒置相差显微镜观察细胞形态,流式细胞仪检测细胞表面CD14 表达,鉴定MDM。将MDM 分为4 组,每组6 个复孔:①健康对照组(healthy control),健康者来源MDM;②健康+PM2.5组(healthy+PM2.5),健康者来源 MDM+PM2.5;③COPD组(COPD),COPD患者来源MDM;④COPD+PM2.5 组(COPD+PM2.5),COPD 患者来源 MDM+PM2.5。PM2.5悬液终浓度为100 mg/L。
1.2.3 qRT-PCR 检测 TLR2 和 TLR4 mRNA 表达提取RNA,合成cDNA。TLR2 正向引物:5'-CAGGAGCTCTTAGTGACCAAGTGAA-3',反向引物:5'-CACAAAGTATGTGGCATTGTCCAG-3';TLR4 正 向引物:5'-AGGATGATGCCAGGATGATGTC-3',反向引物:5'-TCAGGTCCAGGTTCTTGGTTGAG-3';内参GAPDH 正 向 引 物 :5'-GCACCGTCAAGGCTGAGAAC-3',反向引物:5'-TGGTGAAGACGCCAGTGGA-3'。扩增条件:95 ℃ 预变性30 s,95 ℃ 5 s,60 ℃ 30 s,共40个循环,基因表达分析采用2-ΔΔCt法。
1.2.4 Western blot检测TLR2和TLR4蛋白表达提取总蛋白,BCA 法测定蛋白浓度,取40µg 蛋白样品行SDS-聚丙烯酰胺凝胶电泳,转膜,5%脱脂奶粉室温封闭 1 h,加入 TLR4 一抗(1∶500)、TLR2 一抗(1∶500)及β-actin 一抗(1∶1 000)4 ℃孵育过夜,对应IgG 二抗(1∶5 000)室温孵育2 h。化学发光试剂显色并分析灰度值,计算相对蛋白的相对表达量。
1.2.5 激光共聚焦显微镜检测吞噬功能 将盖玻片置于24 孔板底部,使MDM 生长于盖玻片上,洗涤,加入终浓度为0.04 mg/ml 的FITC-E. coli悬液,培养箱内孵育4 h,2%台盼蓝溶液淬灭未吞噬的FITC-E. coli,洗涤,4%多聚甲醛室温固定30 min,Hoechst 染色液染细胞核10 min,洗涤,取出盖玻片,封片,激光共聚焦显微镜检测,FITC-E.coli呈绿色,细胞核呈蓝色。采用Leica Confcal 软件进行平均荧光强度(mean fluorescence intensity,MFI)分析,吞噬FITC-E. coli的数量越多,MFI 越高,表明吞噬能力越强。
1.3 统计学分析 采用SPSS19.0软件进行统计学分析,数据以表示,多组间比较采用单因素方差分析,相关性分析采用Pearson 相关检验。P<0.05为差异有统计学意义。
2 结果
2.1 MDM 鉴定 单核细胞体积小,呈圆形,细胞核居中,悬浮生长;单核细胞在rhGM-CSF 刺激下培养至第12天时,细胞体积明显变大,贴壁生长,多数为圆形或椭圆形,少数细胞周边可见板状伪足或突起,胞质透明,富含颗粒(图1A)。流式细胞术检测单核细胞CDl4 阳性率为(93.53±8.40)%,显著高于MDM(46.37±6.52)%,差异有统计学意义(P<0.01),表明单核细胞被诱导成为MDM(图1B)。
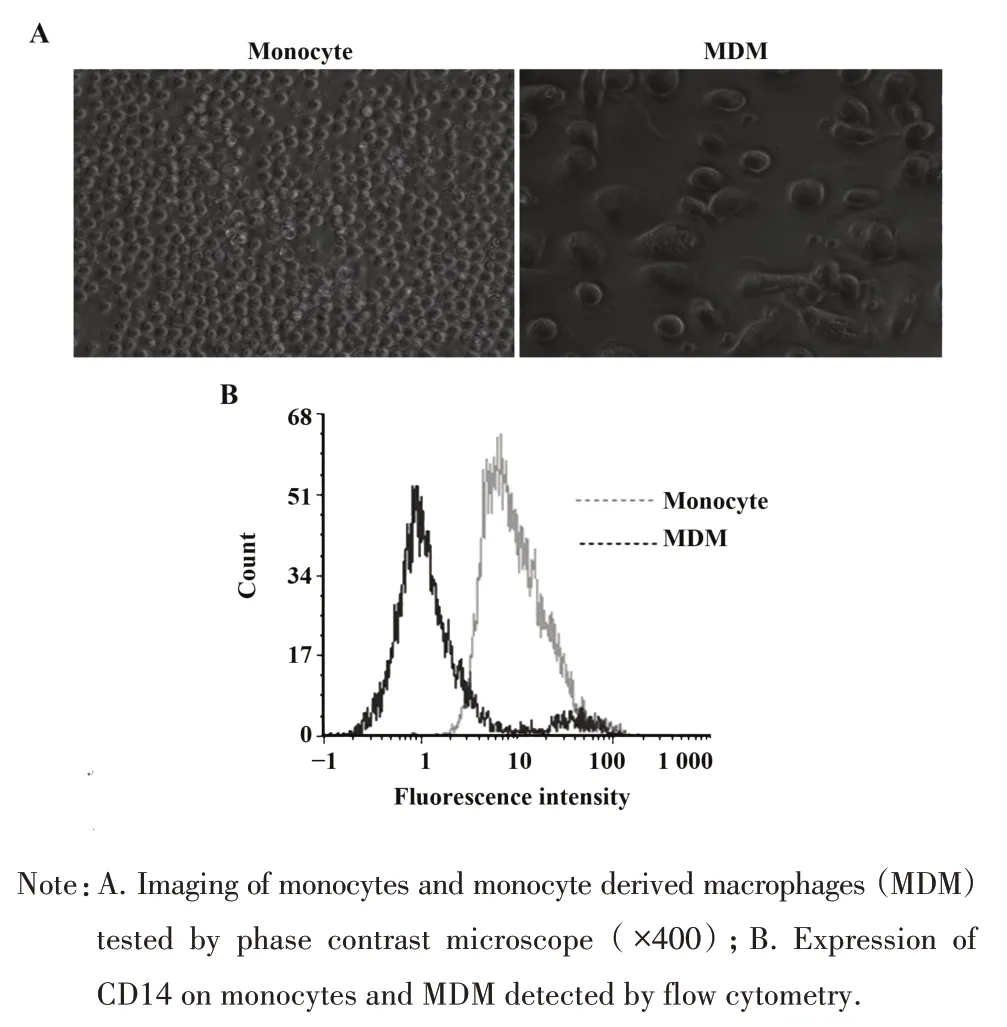
图1 MDM鉴定Fig.1 Identification of MDM
2.2 TLR2 和 TLR4 mRNA 和 蛋 白 表 达 COPD 组MDM TLR2、TLR4 mRNA 和蛋白表达明显高于健康对照组;PM2.5 干预后,COPD+PM2.5 组、健康+PM2.5 组上述指标分别较COPD 组、健康对照组降低(图2)。
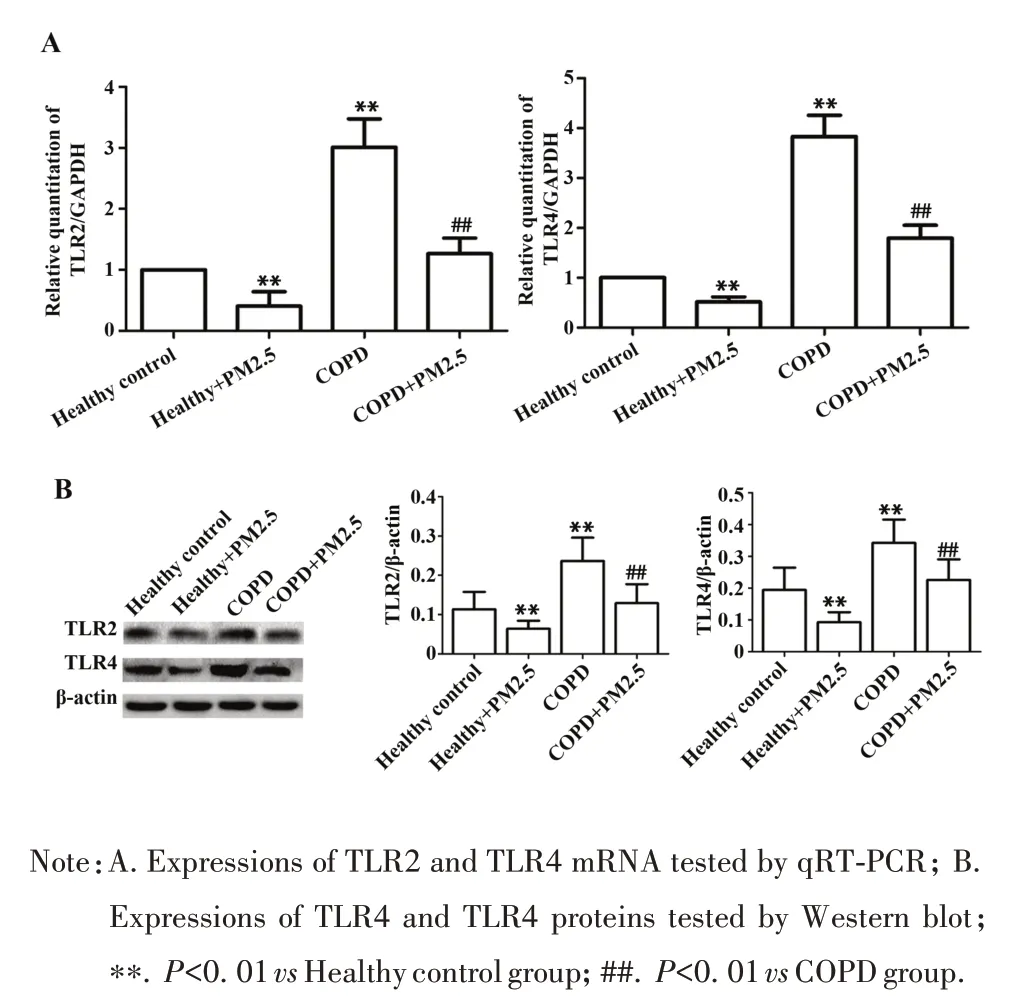
图2 PM2.5对单核细胞来源巨噬细胞TLR2、TLR4表达的影响Fig.2 Effects of PM2.5 on TLR2 and TLR4 expressions in monocyte derived macrophages
2.3 吞噬能力比较 COPD组MDM吞噬FITC-E.coli的MFI明显低于健康对照组;PM2.5干预后,COPD+PM2.5 组、健康+PM2.5 组分别较 COPD 组、健康对照组降低。健康+PM2.5 组MDM 形态不规则,吞噬的FITC-E. coli明显少于健康对照组,细胞内可见PM2.5 颗粒,细胞核固缩,有微核现象;COPD+PM2.5 组吞噬的 FITC-E. coli明显少于 COPD 组,细胞核致密,细胞内可见大小不一团块聚集的PM2.5颗粒,有微核现象(图3)。

图3 PM2.5对单核细胞来源巨噬细胞吞噬功能的影响Fig.3 Effects of PM2.5 on phagocytosis of monocyte derived macrophages
2.4 相关性分析 健康+PM2.5 组和COPD+PM2.5 组 MDM TLR2、TLR4 mRNA 和蛋白表达与吞噬FITC-E.coli的MFI呈正相关(表2)。
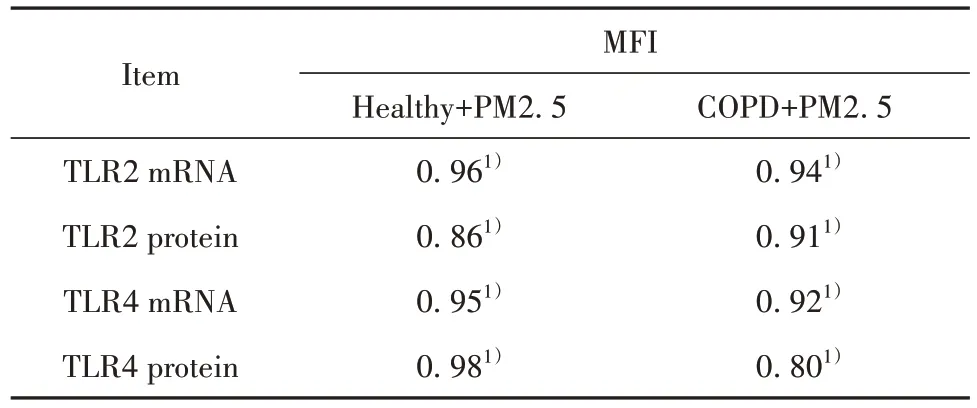
表2 TLR2、TLR4表达与吞噬功能相关性分析(r值)Tab.2 Correlation analysis of TLR2 and TLR4 expressions and phagocytosis(r value)
3 讨论
PM2.5 是空气污染的重要组成部分,已成为危害我国居民健康的重要因素。PM2.5 与COPD 密切相关,不仅是COPD 急性加重的高危因素,也是导致COPD 发生的病因[7]。研究显示当大气 PM2.5 浓度>30 µg/m3,COPD 发生与PM2.5 浓度呈直线相关[8]。PM2.5浓度每升高10 µg/m3,COPD 患者急诊就诊率上升5.3%,住院率升高3.1%,病死率升高2.5%[9-10]。
肺泡巨噬细胞(alveolar macrophage,AM)具有较强的吞噬活性,是呼吸道抵御PM2.5 的第一道防线,大部分颗粒物通过气管内黏液流动和纤毛运动排出体外,进入肺内的颗粒物则主要依赖于AM 的吞噬作用。研究显示,COPD 患者呼吸道易发生感染的原因是AM 吞噬功能降低,从而导致病原微生物定植于下呼吸道,引起COPD 反复急性加重[11]。研究还显示,PM2.5 可抑制小鼠AM 吞噬肺炎球菌,导致肺部感染迁延不愈[12]。MIGLIACCIO 等[13]研究也发现,PM2.5 能抑制AM 对淋巴细胞的激活作用,同时减少肺组织中AM 数量,使机体抵御感染能力下降,导致呼吸道病原微生物定植。由于通过支气管肺泡灌洗获取COPD 患者和健康体检者AM 较为困难,而MDM 与AM 在细胞表型及生理学功能包括吞噬功能相似,目前已成为体外研究AM 的经典细胞模型[2,6]。本研究显示,与健康组比较,COPD患者MDM 吞噬功能低下,与 TAYLOR 等[6]研究结果一致,可能与COPD 患者下呼吸道细菌定植及慢性炎症导致巨噬细胞长期活化而致功能耗竭有关。
TLR2、TLR4 是巨噬细胞表面重要的模式识别受体,可识别病原微生物表面高度保守的病原相关分子模式。PM2.5中含有少量微生物成分,TLR2和TLR4 是结合颗粒物的两种主要效应受体[2]。TLR4识别革兰氏阴性菌的脂多糖,而TLR2 识别革兰氏阳性菌的酵母多糖和脂多肽成分。ZHAO 等[14]研究显示,小鼠气管内滴注PM2.5 悬液24 h 后,小鼠肺泡灌洗液中TLR2、TLR4 阳性细胞数均显著减少。BECKER 等[15]研究也显示 PM2.5 能显著降低人 AM TLR4 mRNA 表达。本研究显示 COPD 患者 MDM 基础状态下TLR2、TLR4 mRNA 和蛋白表达显著高于健康组,PM2.5 能显著抑制COPD 患者和健康者MDM TLR2、TLR4 mRNA 和蛋白表达,与上述文献报道结果相似。
PM2.5 致巨噬细胞吞噬功能损伤的机制,目前研究发现可能与氧化损伤和细胞骨架重排有关。PM2.5 表面富含的重金属如铁、锌、锰等及有机成分如多环芳烃、脂多糖等可引发肺部氧化应激,活性氧增加,抗氧化成分耗竭。活性氧导致DNA 损伤,干扰线粒体功能并启动细胞程序性死亡,破坏细胞膜的正常结构和吞噬细胞表面的标志物,并导致肺巨噬细胞的吞噬功能下降[16]。研究还发现,PM2.5 可能会抑制肌动蛋白聚合,引起细胞骨架运动障碍,从而导致巨噬细胞吞噬能力下降[17-18]。TLR在巨噬细胞介导的固有免疫和适应性免疫中具有重要作用。一方面AM 通过细胞表面表达的TLR 识别并结合颗粒物上的病原体相关模式分子,启动TLR 信号通路,继而通过下游信号激活转录因子NF-κB 和AP-1,导致炎症介质和趋化因子的合成增加[3]。另一方面,PM2.5可引起AM介导的免疫反应延迟或抑制,导致呼吸道细菌的易感性提高[19]。本研究显示,PM2.5抑制MDM吞噬功能的同时也下调TLR2 和 TLR4 表达,相关分析显示 MDM TLR2、TLR4 mRNA 和蛋白表达与吞噬FITC-E.coli的MFI呈正相关,说明巨噬细胞吞噬能力与TLR2、TLR4表达相关。
综上所述,PM2.5 可损伤COPD 患者巨噬细胞吞噬功能,同时下调巨噬细胞TLR2、TLR4 表达;PM2.5 致巨噬细胞吞噬功能下降可能与TLR2、TLR4表达下降有关。
