血清Mac-2结合蛋白聚糖异构体对2型糖尿病患者肝纤维化的诊断价值
2022-05-18陈弘东潘慧钗徐筱青朱庆文
李 军, 陈弘东, 谭 方, 潘慧钗, 徐筱青, 朱庆文
(北京市和平里医院 内分泌科, 北京, 100000)
非酒精性脂肪肝病(NAFLD)是目前全球范围内最常见的慢性肝病之一, 2型糖尿病(T2DM)患者的NAFLD发病率为49%~70%[1]。相关研究[2]指出, T2DM和NAFLD的共病机制主要与肝脏和外周胰岛素抵抗有关。考虑到肝脏在T2DM病理生理学中的关键作用,鉴别肝纤维化具有重要的临床价值。肝活检是评估肝纤维化进展阶段的金标准,但存在一些局限性,如侵袭性、取样误差、高检测成本等[3]。血清生物学标志物可为疾病的临床诊断提供重要参考信息,有研究[4]显示, Mac-2结合蛋白聚糖异构体(M2BPGi)是一种新型肝纤维化标志物,然而M2BPGi能否用于T2DM患者的肝纤维化筛查尚未完全明确。本研究评估血清M2BPGi对T2DM合并NAFLD患者肝纤维化进展的诊断价值,现报告如下。
1 资料与方法
1.1 一般资料
本研究为病例对照横断面研究,招募2018年7月—2021年3月在北京市和平里医院确诊T2DM的272例患者为研究对象,男167例、女105例,年龄40~88岁。纳入标准: 年龄≥40岁,符合《中国2型糖尿病防治指南(2020年版)》中T2DM的诊断标准者。排除标准: 1型糖尿病患者; 妊娠期患者; 其他肝脏疾病患者; 合并肾脏疾病、重症感染、恶性肿瘤者; 长期服用肝毒性药物者; 饮酒者(男性饮酒量>210 g/周,女性饮酒量>140 g/周)。详细记录272例患者的人口社会学资料、体检资料、病程和药物治疗情况。NAFLD的诊断参照弥漫性肝细胞脂肪变的影像学或组织学证据,其中122例患者符合《非酒精性脂肪性肝病防治指南(2018更新版)》[5]中NAFLD的诊断标准,男77例,女45例; 年龄40~88岁。另收集同期在北京市和平里医院进行健康体格检查且年龄、性别与T2DM患者相匹配的150名健康志愿者的血清样本作为正常对照,健康志愿者的各项体格检查指标结果均在正常值范围内,男91名,女59名; 年龄40~92岁。本研究经北京市和平里医院机构伦理审查委员会批准,且获得参与者的书面知情同意。
1.2 分组方法
将150例无NAFLD的T2DM患者设为T2DM组,将122例T2DM合并NAFLD患者设为T2DM合并NAFLD组,将150名健康志愿者设为正常对照组。根据腹部彩色超声检查结果,计算NAFLD纤维化评分(NFS), 评估肝纤维化程度, NFS计算公式为-1.675+0.037×年龄+0.094×体质量指数(BMI)+1.13×是否空腹血糖受损或糖尿病(是=1, 否=0)+0.99×[谷草转氨酶(AST)/谷丙转氨酶(ALT)]-0.013×血小板计数-0.66×白蛋白。根据NFS将T2DM合并NAFLD组患者分为无肝纤维化亚组[NFS<-1.455分(65岁以下)或<0.120分(65岁及以上)]、不确定亚组[NFS为-1.455~0.676分(65岁以下)或0.120~0.676分(65岁及以上)]和肝纤维化亚组(NFS>0.676分)。
1.3 M2BPGi定量方法
所有受试者均于禁食12 h后采集肘部静脉血,离心后弃去下层沉淀物,取上层血清测定M2BPGi。采用化学发光酶免疫分析法检测M2BPGi水平, M2BPGiTM试剂盒和HISCL-5000型自动免疫分析仪购自日本Sysmex公司。将10 μL血清稀释,然后与紫藤凝集素(WFA)包被的磁珠颗粒混合。磁分离和清洗后,添加碱性磷酸酶(ALP)标记的抗Mac-2结合蛋白(M2BP)单克隆抗体,然后加入化学发光底物试剂。根据测定对照品的光强度测量光强度并计算截止指数(C.O.I), M2BPGi C.O.I即血清M2BPGi相对浓度。M2BPGi C.O.I=(M2BPGi样本-M2BPGi阴性对照)/(M2BPGi阳性对照-M2BPGi阴性对照)。阳性对照提供初步标准化的校准溶液, C.O.I为1.0。
1.4 观察指标
抽取患者静脉血约5 mL, 离心10 min, 3 000 转/min, 分离血清。采用全自动生化分析仪(美国Beckman Coulter 公司,型号AU5800)检测血清AST、ALT、总胆红素(TBIL)、间接胆红素(IBIL)、直接胆红素(DBIL)等指标水平。采用酶联免疫吸附法(ELISA)检测血清透明质酸(HA)、层粘连蛋白(LN)、Ⅲ型前胶原(PC Ⅲ)、Ⅳ型胶原(Ⅳ-C)这4项肝纤维化指标水平,酶联免疫吸附试剂盒购自上海酶生物技术有限公司。
1.5 统计学分析
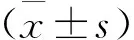
2 结 果
2.1 血清M2BPGi水平比较
正常对照组、T2DM组和T2DM合并NAFLD组的M2BPGi C.O.I分别为0.06(0.02, 0.10)、0.09(0.08, 0.15)和0.46(0.28, 0.91)。T2DM组、T2DM合并NAFLD组患者血清M2BPGi水平均高于正常对照组,且T2DM合并NAFLD组血清M2BPGi水平高于T2DM组,差异有统计学意义(P<0.001)。
2.2 血清M2BPGi对T2DM患者合并NAFLD的诊断效能
血清M2BPGi诊断T2DM患者合并NAFLD的曲线下面积(AUC)为0.919(95%CI为0.885~0.954), 截断值为0.795, 特异度、敏感度分别为0.873、0.869, 约登指数为0.742, 见图1。

图1 血清M2BPGi诊断T2DM患者合并NAFLD的ROC曲线
2.3 各亚组T2DM合并NAFLD患者临床特征和实验室检查指标水平比较
不确定亚组、肝纤维化亚组ALT水平低于无纤维化亚组, AST/ALT、糖化血红蛋白(HbA1c)、HA、LN、PC Ⅲ、Ⅳ-C、M2BPGi水平高于无纤维化亚组,差异有统计学意义(P<0.05); 肝纤维化亚组γ-谷氨酰转移酶(GGT)、TBIL、DBIL水平均高于无纤维化亚组、不确定亚组,差异有统计学意义(P<0.05); 肝纤维化组ALT水平低于不确定亚组, AST/ALT、HA、LN、PC Ⅲ、Ⅳ-C、M2BPGi水平高于不确定亚组,差异有统计学意义(P<0.05); 各亚组年龄、性别、糖尿病病程、BMI、腰围、AST、IBIL、总胆固醇(TC)、空腹血糖(FBG)、空腹胰岛素(FINS)比较,差异无统计学意义(P>0.05)。见表1。

表1 T2DM合并NAFLD患者临床特征和实验室检查指标比较
2.4 血清M2BPGi对肝纤维化的诊断效能
血清M2BPGi诊断T2DM合并NAFLD患者肝纤维化的AUC为0.993(95%CI为0.983~1.000), 截断值为0.765, 特异度、敏感度分别为1.000、0.966, 约登指数为0.966, 见图2。血清M2BPGi诊断肝纤维化的AUC均大于HA、LN、PC Ⅲ、Ⅳ-C单独诊断的AUC(P<0.05), 见表2。

图2 血清M2BPGi诊断T2DM合并NAFL患者肝纤维化的ROC曲线

表2 血清M2BPGi和4项肝纤维化指标对肝纤维化的诊断效能
2.5 T2DM合并NAFLD患者血清M2BPGi水平与其他指标的相关性分析
Spearman秩相关分析结果显示,血清M2BPGi水平与HA、LN、PC Ⅲ、Ⅳ-C水平均呈显著正相关(r=0.741、0.835、0.851、0.867,P<0.05), 与年龄(P=0.877)、糖尿病病程(P=0.117)、BMI(P=0.218)、AST(P=0.809)、ALT(P=0.233)、AST/ALT(P=0.413)、GGT(P=0.098)、TBIL(P=0.341)、DBIL(P=0.202)、IBIL(P=0.075)、HbAlc(P=0.436)、FBG(P=0.477)、TC(P=0.881)、FINS(P=0.075)均无相关性。
3 讨 论
T2DM患者中有49%~62%可伴发NAFLD, 肥胖T2DM患者的NAFLD患病率更可高达70%[6]。近年来,医学研究人员热衷于寻找非侵入性的临床诊断工具来筛查和评估T2DM合并NAFLD的肝纤维化进程。M2BPGi是活化的肝星状细胞(HSCs)合成的糖基化分泌蛋白,在胰岛素抵抗、代谢紊乱和肝脏脂肪变性与纤维化的发展中起着重要作用。目前, M2BPGi相关研究多集中于细胞和分子水平层面,关于其在糖尿病患者中的应用研究尚较少见。本研究发现, T2DM患者血清M2BPGi较正常对照组显著升高,而合并NAFLD的T2DM患者升高尤其显著,当血清M2BPGi≥0.795时可以敏感地区分T2DM患者是否合并NAFLD。本研究还发现, T2DM合并NAFLD患者血清M2BPGi与4项肝纤维化指标均呈显著正相关,提示血清M2BPGi可能成为筛查和评估T2DM合并NAFLD患者肝纤维化进展的新指标。
T2DM与NAFLD存在双向关系,会共同导致不良代谢和心血管不良事件发生风险升高。NAFLD通常被认为是与代谢综合征相关的肝脏疾病表现,胰岛素抵抗是NAFLD和糖尿病的共同病理机制[7]。在高糖和毒性脂质(如神经酰胺、甘油三酯、游离脂肪酸和胆固醇)的影响下,肝脏发生糖脂毒性,接下来可能诱导肝脏细胞死亡、氧化应激、内质网应激、线粒体应激等多个机制而引发肝脏变性,继而发展为肝纤维化[8]。过量的甘油三酯可增强线粒体氧化应激,导致自由基和过氧化物酶的释放增加,此外脂肪细胞来源的细胞因子(瘦素、肿瘤坏死因子-α等)产生过多,而脂联素水平不足,最终HSCs被激活,促进胶原蛋白的产生以及结缔组织生长因子、细胞外基质的增加,导致肝脏纤维化和肝硬化。HSCs是肝源性细胞亚群中M2BPGi的主要来源,该细胞亚群中包括肝源性细胞、Kupffer细胞、内皮细胞、上皮细胞和肝细胞。体外研究[9-11]发现,外源性 M2BPGi的加入上调了Kupffer细胞Mac-2的表达。以上研究从分子水平层面证明, M2BPGi是肝纤维化过程中由HSCs向Kupffer细胞发送的一种具有肾小球旁分泌作用的信使,因此可能是肝纤维化发展过程中的关键因子。
M2BPGi也被称为高糖基化WFA阳性M2BP, M2BP是具有多支化和唾液酸化的N-聚糖, WFA可识别N-聚糖和O-聚糖的半乳糖残基和聚半乳糖结构。M2BP存在于多个器官(如肝脏)的细胞外基质和循环血清中,肝纤维化会导致M2BP的糖基化和糖链结构的特异性修饰[12-13]。由此提示, M2BPGi水平应该与肝纤维化进展显著相关。M2BPGi是近年来发现的预测肝纤维化的有效指标,在病毒性肝炎肝纤维化、糖尿病肝纤维化和糖尿病血管病变的诊断中均具有较高的应用价值。SALEH S A等[14]发现, M2BPGi可用于无创评估和预测接受抗病毒药物治疗后出现上腔静脉血栓的丙型肝炎患者的肝纤维化消退,且未治疗时M2BPGi预测F4期肝纤维化患者具有最大的AUC。另外, HASHIMOTO Y等[15]证实, (M2BPGi+1)的对数值与NAFLD纤维化分数呈正相关。PARK H等[16]发现,血清M2BPGi水平随着肝脂肪变性程度和纤维化程度的增加而升高,且血清M2BPGi水平与基于4因子的纤维化指数(FIB-4)、谷草转氨酶-血小板比值指数(APRI)呈正相关。本研究结果显示, T2DM患者中血清M2BPGi水平异常者更容易出现肝纤维化进展,且与非肝纤维化的T2DM合并NAFLD患者比较,发生肝纤维化的患者血清M2BPGi水平显著升高。肝纤维化由持续性肝损伤引起,以肝纤维化组织过度堆积和正常肝脏结构变形为主要特征[17-18]。本研究中, T2DM合并NAFLD患者血清M2BPGi水平与HA、LN、PC Ⅲ、Ⅳ-C水平均呈显著正相关,且血清M2BPGi诊断肝纤维化的AUC均大于HA、LN、PC Ⅲ、Ⅳ-C单独诊断的AUC, 提示M2BPGi在评估T2DM患者肝纤维化方面具有一定优势。
综上所述, T2DM合并NAFLD患者血清M2BPGi水平普遍升高,且M2BPGi水平与肝纤维化进展有关。血清M2BPGi水平有助于筛查和评估T2DM合并NAFLD患者肝纤维化及进展,有望成为该领域的新型诊断标志物。
