罗非鱼臭氧水杀菌技术的工艺优化及其对鱼肉品质的影响
2022-05-17刘恒阁王海燕吴文锦高瑞昌弋景刚汪金林白帆赵元晖
刘恒阁,王海燕,吴文锦,高瑞昌,弋景刚,汪金林,白帆*,赵元晖*
(1.中国海洋大学食品科学与工程学院,山东 青岛 266003;2.海信(山东)冰箱有限公司,山东 青岛 266000;3.湖北省农业科学院农产品加工与核农技术研究所,湖北 武汉 430064;4.江苏大学食品与生物工程学院,江苏 镇江 212013;5.河北农业大学机电工程学院,河北 保定 071066;6.衢州鲟龙水产食品科技开发有限公司,浙江 衢州 324002)
罗非鱼(Oreochromis mossambicus)属于辐鳍鱼纲鲈形目丽鱼科罗非鱼属,原产于非洲,是联合国粮农组织(Food and Agriculture Organization of the United Nations,FAO)向全球推广的优良养殖淡水鱼类。据《中国渔业统计年鉴2020》统计,2019年,我国罗非鱼养殖产量高达164万吨[1]。罗非鱼肉质鲜嫩、鱼刺较少、价格低廉、营养丰富,含有多种蛋白质、不饱和脂肪酸与微量元素[2]。因此,罗非鱼被广泛应用于鱼类加工产业,产品类型主要包括整条罗非鱼、罗非鱼片、罗非鱼罐头、罗非鱼鱼糜制品等[3-4]。
臭氧水是一种安全、环保、高效、广谱的杀菌剂,其杀菌机理主要是O3分子产生氧自由基(O·),通过自由基链式反应引起膜蛋白的氧化损伤,从而改变细胞膜的通透性,最终导致微生物裂解死亡[5-6]。通过臭氧水对水产品进行清洗杀菌处理,在国内罗非鱼加工与贮藏领域逐渐普及应用[7]。然而,臭氧的强氧化性可能导致蛋白质与脂质的氧化[8],从而会对产品的营养成分产生不良影响。根据Bao等[9]的研究发现,其强氧化性可能还会导致蛋白质的溶解性与交联聚集特性下降,从而影响产品的弹性与嫩度。目前,水产品加工过程中的杀菌处理仍是大多数加工企业的难题,而现有文献对于臭氧水处理罗非鱼的报道,大多为探究臭氧水杀菌的优缺点以及对罗非鱼杀菌后品质的探究,针对罗非鱼臭氧杀菌适宜杀菌工艺条件的报道仍较少。
基于以上问题,本文以臭氧水清洗杀菌装置对罗非鱼肉进行处理,确定臭氧水浓度后,通过对不同浸泡时间下罗非鱼肉气味成分差异、杀菌率、蛋白质和脂质氧化程度以及感官品质的考察,探究臭氧水处理罗非鱼肉的最佳工艺条件及其对鱼肉品质的影响,以期为臭氧水对罗非鱼清洗杀菌技术的进一步优化提供理论基础。
1 材料与方法
1.1 材料与试剂
吉富罗非鱼:市售;牛血清白蛋白(生物试剂):上海源叶生物科技有限公司;羰基含量检测试剂盒、总巯基含量检测试剂盒、Ca2+-ATPase检测试剂盒:北京索莱宝科技有限公司;脂肪酸标准品、丁基羟基甲苯(均为优级纯):西格玛奥德里奇贸易有限公司;碘化钾、硫酸、硫代硫酸钠、氯化钾、三羟甲基氨基甲烷盐酸盐、碳酸氢钠、氢氧化钠、硫酸铜、酒石酸钾钠、十二烷基硫酸钠、乙二胺四乙酸、三氯乙酸、乙二胺四乙酸二钠、硫代巴比妥酸(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
去鱼鳞设备(JL-10GY)、去鱼内脏设备(JL-70KF):青岛建亮科技有限公司;臭氧发生器(CF-G-3-20 g):青岛国林环保科技股份有限公司;酶标仪(Powerwave XS):美国Biotek仪器有限公司;多功能氮吹仪(SZ-N-20):山东桑泽仪器仪表有限公司;气相色谱仪(Agilent 7890 A):安捷伦科技有限公司;电子鼻(iNose):上海瑞玢智能科技有限公司。
1.3 试验方法
1.3.1 臭氧水的制备及浓度测定
1.3.1.1 臭氧水的制取
采用臭氧发生器制取臭氧,将新制取的臭氧气体持续通入20 L、25℃的无菌蒸馏水中,并使气体流速保持在2.0 L/min。通过改变臭氧气体通入时间(1min~5 min),即可制得不同浓度的臭氧水[10]。
1.3.1.2 臭氧水浓度的确定
取100 mL新制得的臭氧水,加入20 mL 2%碘化钾溶液与3 mL 0.5 mol/L硫酸,避光反应5 min。反应结束后加入1%淀粉溶液,此时溶液显蓝色。采用0.01 mol/L硫代硫酸钠溶液进行滴定,滴定终点为蓝色刚好消失并且30 s后不恢复蓝色。
1.3.2 鱼片的臭氧水处理
选取体表颜色、尺寸相近的鲜活罗非鱼,采用高压水去鱼鳞和去鱼内脏设备对其进行处理。按图1所示方法取鱼肉,鱼肉尺寸为3 cm×2 cm×0.5 cm。将鱼肉片置于6倍体积的臭氧水中浸泡(容器为无菌的密闭容器),设定浸泡时间为5、10、15 min。同时以蒸馏水浸泡5 min作为对照。浸泡结束后,倒掉臭氧水,将鱼肉片用封口袋封装并标记,放入-4℃冰箱贮藏备用[7,10]。
图1 取鱼片方法示意图Fig.1 Schematic diagram of method of taking fish fillets
1.3.3 杀菌率的测定
取新制得的鱼片样品测定菌落总数。参考GB 4789.2—2016《食品安全国家标准食品微生物学检验菌落总数测定》测定。杀菌率计算公式如下[11]。

1.3.4 电子鼻试验气味成分分析
将相同浸泡时间下的鱼肉分为两组,分别进行生肉绞碎和蒸制3 min后的熟肉绞碎处理,处理后的鱼肉称取2 g置入50 mL棕色瓶中,采用封口膜密封,待气体富集2 h后检测。电子鼻采用顶空抽样的方法取样并检测,同时获取并记录数据,检测时间设定为90 s。取样前后,软件自动对传感器进行清洗,清洗时间设定为120 s,每组设8个平行[12-13]。
1.3.5 蛋白质和脂质氧化指标的测定
1.3.5.1 蛋白质氧化指标的测定
1)肌原纤维蛋白的提取:提取方法参考Zhang等[14]的方法并适当修改。称取鱼肉样品5 g,加入50 mL蒸馏水均质1 min,于4℃下10 000 r/min离心15 min,弃上清,留沉淀。向沉淀中加入50 mL Tris-HCl缓冲液1(0.05 mol/L氯化钾,0.02 mol/L三羟甲基氨基甲烷盐酸盐,pH 7.0),4℃搅拌30 min后于10 000 r/min离心15min,弃上清,留沉淀。向沉淀中加入50 mL Tris-HCl缓冲液2(0.6 mol/L氯化钾,0.02 mol/L三羟甲基氨基甲烷盐酸盐,pH 7.0),4℃搅拌30 min后于10 000 r/min离心15 min,取上清液,即为肌原纤维蛋白样液[14-19]。
2)肌原纤维蛋白含量的测定:测定方法参考福林酚法[15-16]。向 7 支试管中分别加入 0、0.1、0.2、0.4、0.6、0.8、1.0 mL牛血清白蛋白溶液(0.25 mg/mL),用蒸馏水补足至1 mL,即为标准曲线溶液。取0.2 mL稀释20倍的样液,向其中加入1 mL试剂1(50 mL碳酸氢钠+1 mL硫酸铜),即刻混匀,常温反应10 min。再向其中加入0.1 mL试剂2(福林酚),即刻混匀,于25℃下反应30 min后,测定500 nm处吸光度。同时测定标准溶液与空白。绘制标准曲线,计算肌原纤维蛋白样液浓度。
3)羰基含量的测定:参照羰基含量检测试剂盒指导方法测定。
4)总巯基含量的测定:参照总巯基含量检测试剂盒指导方法测定。
5)活性巯基含量的测定:参考薛勇[10]的方法并适当修改。取0.5 mL样液,加入4.5 mLTris-HCl缓冲液3(2%十二烷基硫酸钠,0.01 mol/L乙二胺四乙酸,0.2 mol/L三羟甲基氨基甲烷盐酸盐,pH 6.8),于4℃下12 000 r/min离心10 min,取1 mL上清液,加入0.1 mL Tris-HCl缓冲液4(0.1%二硝基苯甲酸,0.2 mol/L三羟甲基氨基甲烷盐酸盐,pH 8.0),混匀,40℃反应25 min,冷却至常温,测定412nm处吸光度。空白管采用0.5 mL Tris-HCl缓冲液2替代样液进行测定。计算活性巯基含量公式如下。

式中:A为吸光度;ε为吸光系数,13 600 mL/(mol·cm);Cpr为蛋白质样液浓度,mg/mL。
6)Ca2+-ATPase活力的测定:参照Ca2+-ATPase检测试剂盒指导方法测定。
1.3.5.2 脂质氧化指标的测定
硫代巴比妥酸值(thiobarbituric acid reactive substances,TBARS)的测定参照 GB 5009.181—2016《食品安全国家标准食品中丙二醛的测定》中第二法[20]。称取鱼肉样品5 g,准确加入50 mL三氯乙酸(trichloroacetic acid,TCA)混合液(7.5%三氯乙酸,0.1%乙二胺四乙酸二钠),加塞密封,50℃振摇30 min,10 000 r/min离心5 min。取2 mL上清液,向其中加入2 mL 0.02 mol/L硫代巴比妥酸(thiobarbituric acid,TBA)水溶液,加塞密封,混匀,90℃水浴30 min,冷却至常温,测定532 nm处吸光度。同时测定标准溶液与空白。丙二醛含量计算公式如下。
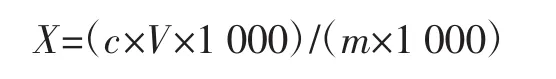
式中:X为试样中丙二醛含量,mg/kg;c为标准曲线测得的样液中丙二醛浓度,μg/mL;V为试样溶液定容体积,mL;m为最终试样溶液所代表的试样质量,g;1 000为换算系数。
1.3.6 感官评定
挑选12名经过专业训练的感官评定员组成评判小组,于感官评价室内对臭氧水浸泡0、5、10、15 min后的样品进行评分,评分标准参考文献[21-24]的方法并适当修改,其中滋味评定需提前将各组杀菌后的鱼肉进行3min的蒸制,评分标准见表1,4项指标各5分,总分为4项指标分数的平均值总和,满分20分。

表1 感官评定标准Table 1 Criteria of sensory evaluation table
1.4 数据处理
采用SPSS 21.0软件进行数据分析,试验计量数据采用平均值±标准差表示,使用Origin 2019软件进行数据处理,通过单因素和双因素方差分析进行比较,差异显著水平为0.05。
2 结果与分析
2.1 臭氧水浓度的测试结果
臭氧水浓度是影响臭氧杀菌效果、操作环境及成本的关键因素,不同的臭氧通入时间对臭氧水浓度的影响见图2。

图2 不同臭氧通入时间下的臭氧水浓度Fig.2 Ozone water concentrations at different ozone entry times
由图2可知,随着臭氧通入时间的延长,臭氧水浓度增大。根据相关研究[7,10,12],在通过臭氧水进行杀菌和脱腥的过程中,臭氧水浓度在0~6.000 mg/L,杀菌率提升较快,而当臭氧水浓度高于6.000 mg/L后,杀菌率随溶液浓度变化不显著,且操作过程中臭氧水浓度过高会导致操作环境气味刺鼻、成本高以及耗时长等缺点。因此,本文选择将臭氧水浓度控制在6.000 mg/L以内,结合实际操作选择采用臭氧通入时间为1、2、3 min的臭氧水,对应浓度分别为(2.568±0.142)、(4.032±0.268)、(5.160±0.086)mg/L。
2.2 杀菌率测定结果
相同浓度下,不同浸泡时间对杀菌率的影响见图3。
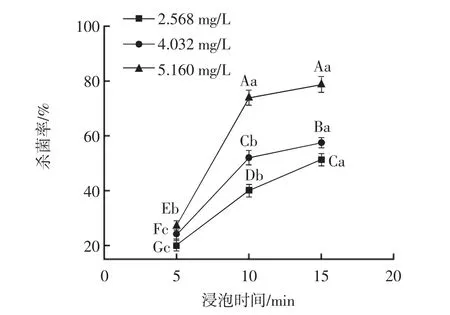
图3 不同浸泡时间下的杀菌率Fig.3 Sterilization rate at different soaking times
由图3可知,在同一臭氧水浓度下,杀菌率与浸泡时间呈正相关,并且浸泡时间5 min~10 min的增长速率明显高于10 min~15 min。出现增长速率减缓这一现象的原因可能是随着浸泡时间的延长,臭氧水浓度逐渐衰减,导致杀菌效果愈发微弱,从而杀菌率的增长速率愈发缓慢。而在同一浸泡时间下,杀菌率随着臭氧水浓度的增大而升高,且不同浓度对应的杀菌率具有显著性差异(P<0.05)。综上所述,浸泡时间越长,臭氧水浓度越高,杀菌率也就越高,这与文献[7,25]报道的结果相似。因此,为保证杀菌效果,后续指标的测定选择采用浓度为5.160 mg/L的臭氧水对罗非鱼片进行浸泡处理,此时鱼肉的杀菌率为(74.000±0.017)%。
2.3 电子鼻分析
臭氧水浸泡杀菌可能对生、熟鱼肉的气味造成影响,通过电子鼻对不同臭氧水浸泡时间下的生、熟鱼肉气味成分分析,结果见图4。

图4 电子鼻气味主成分分析图Fig.4 Principal component analysis diagram of electronic nose odor
由图4可知,主成分1和2的总和均大于85%,说明两者可代表主要的样品信息。图中不同浸泡时间下的代表各组分布区域均未分开。这说明在不同浸泡时间下的生鱼肉、熟鱼肉的气味成分总体情况均无显著性差异,即臭氧水处理对生罗非鱼肉及熟制后的罗非鱼肉气味成分均无显著性影响,这与文献[13]报道的结果相似。
2.4 蛋白质和脂质氧化程度
2.4.1 蛋白质氧化程度
在蛋白质氧化过程中,羰基化反应是该过程的重要标志,羰基含量是评判蛋白质氧化程度的重要指标[26-27]。含有半胱氨酸的蛋白质或肽,其活性巯基中的氢原子易被自由基等活性基团取代,因此巯基含量也可直接体现蛋白质氧化程度[28]。肌球蛋白是肌原纤维蛋白中的重要组成部分,其分子构象极易发生改变,这会导致Ca2+-ATPase活力降低。此外,蛋白质分子重排也会导致Ca2+-ATPase活力降低。因此在蛋白质氧化过程中,往往会伴随Ca2+-ATPase活力的降低,其变化可从侧面体现蛋白质氧化程度[29]。蛋白质氧化程度结果见图5。
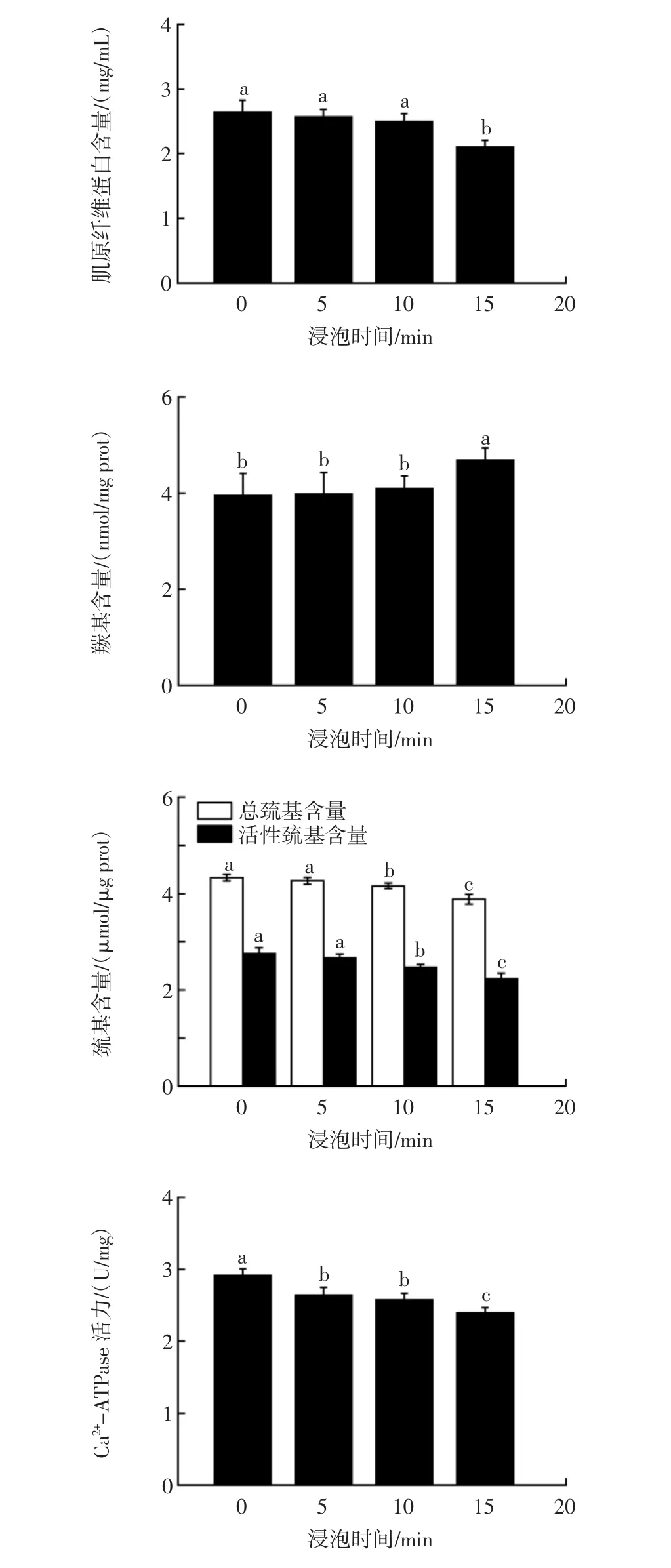
图5 不同浸泡时间对蛋白质氧化指标的影响Fig.5 Effect of different soaking time on protein oxidation index
由图5可知,随着浸泡时间的延长,肌原纤维蛋白含量、巯基含量以及Ca2+-ATPase活力呈减小趋势,羰基含量呈增大趋势。其中15 min组的各项指标均与对照组具有显著差异,而10 min组仅在巯基含量与Ca2+-ATPase活力方面与对照组具有显著差异,5 min组仅在Ca2+-ATPase活力方面与对照组具有显著差异。综上所述,15min组的蛋白质氧化损伤情况最为严重,这与文献[14]报道的结果相似。结合2.2中不同浸泡时间下的杀菌率变化情况,推测臭氧水处理最优浸泡时间为10 min。
2.4.2 脂质氧化程度
在脂质氧化过程中,最具有代表性的产物是丙二醛。通过TBARS的测定,可得知丙二醛的含量,从而推测脂质氧化的程度[30-31]。脂质氧化程度结果见图6。

图6 不同浸泡时间对TBARS的影响Fig.6 Effect of different soaking time on TBARS
由图6可知,随着浸泡时间的延长,TBARS含量呈现出增大的趋势。浸泡时间为10 min及以上时,脂质氧化指标与对照组的差异显著,脂质氧化的程度也逐渐强烈。其中15 min组的脂质氧化损伤情况最为严重,这与文献[14,25]报道的结果相似。结合2.2和2.4.1中不同浸泡时间下的杀菌率变化以及蛋白质氧化程度,推测臭氧水处理最优浸泡时间为10 min。
2.5 感官分析
臭氧水处理对罗非鱼肉感官品质的影响见图7。

图7 不同浸泡时间对罗非鱼肉感官品质的影响Fig.7 Effects of different soaking time on sensory quality of tilapia fish
由图7可知,随着浸泡时间的延长,鱼肉的感官品质逐渐下降,其中浸泡0~10 min的鱼肉感官评分下降不显著(P>0.05);而当浸泡时间大于10 min时,鱼肉的感官品质显著降低(P<0.05),综合上述杀菌率、蛋白质以及脂质氧化程度结果,这可能是由于蛋白质、脂质等物质氧化程度加剧,影响了鱼肉的滋味、外观及质地等品质,这与文献[2,7]报道结果相似。综上所述,确定臭氧水处理最优浸泡时间为10 min。
3 结论
本文通过臭氧水清洗杀菌装置对罗非鱼肉进行了处理。通过对鱼肉杀菌率、气味成分差异、蛋白质和脂质氧化程度以及感官品质的考察,确定臭氧水处理罗非鱼肉的最佳工艺条件并探究了其对罗非鱼肉品质的影响。结果表明,当臭氧水浓度为5.160 mg/L、浸泡时间为10 min时,清洗杀菌效果最佳,杀菌率可达(74.00±0.017)%。此时,罗非鱼生肉、熟肉的电子鼻气味成分分布域重叠率高,肌原纤维蛋白、羰基、总巯基、丙二醛含量和Ca2+-ATPase活力分别为2.5mg/mL、4.1nmol/mg、0.08 μmol/mg、0.36 mg/kg、2.6 U/mg,说明鱼肉的气味成分变化较小,且蛋白质和脂质氧化程度均不强烈。同时,鱼肉的感官评分保持为17.99分,感官品质完好。本文采用的装置还有改进与优化的空间,具体改进思路可参考固态聚合物电解质(solid polymer electrolyte,SPE)电解法,同时还可结合超声处理等技术,从而进一步优化清洗杀菌工艺。此外,对于该技术对鱼肉风味(气味与滋味)影响的研究,还可利用高效液相色谱、气相色谱-质谱联用仪、气相色谱-嗅味计等仪器进行分析,深入考察风味组分在该过程中受到的影响。
