口腔鳞癌组织和口腔拭子中Dickkopf-1基因甲基化状态与疾病进展的相关性研究
2022-05-17申庸凡李志军达云萌任贵云
申庸凡, 李志军, 达云萌, 尹 克, 任贵云
(1. 河北省眼科医院 口腔科, 河北 邢台, 054000; 2. 河北医科大学附属医院 口腔科, 河北 邢台, 054000;3. 河北省口腔医院 口腔科, 河北 石家庄, 050000)
口腔鳞状细胞癌(OSCC)是头颈部最常见的恶性肿瘤之一,具有较高的病死率[1]。虽然OSCC在中国的发病率低于印度、日本等国家,但仍不可忽视[2]。OSCC患者5年生存率在50% 左右,且多数患者确诊时已至中晚期[3]。目前,组织病理学是诊断OSCC的黄金标准,但仍存在一些限制,如易受取样部位、活检方法等因素影响。DNA启动子甲基化是一种被广泛研究的表观遗传现象,其通过改变基因表达而不影响DNA序列参与癌变进程。异常的启动子甲基化也是OSCC早期分子事件之一[4]。Dickkopf-1(DKK-1)蛋白是Wnt/β-catenin肿瘤信号转导通路的抑制蛋白之一,在各种纤维性疾病和肿瘤组织中表达异常[5], 但DKK-1在OSCC发病和进展中的作用尚不清楚。本研究旨在检测口腔组织活检标本、口腔上皮细胞标本中DKK-1蛋白表达和基因启动子甲基化水平,以确定其鉴别病变的能力,并为OSCC的早期诊断提供依据。
1 资料与方法
1.1 一般资料
本研究在开展前已得到评审委员会批准。选取2018年4月—2021年3月诊断为OSCC(国际疾病分类ICD-10-CM)的患者作为OSCC组研究对象(n=67)。纳入标准: 患者根据既往疾病史、临床表现和病理检查诊断为来源于口腔颊部OSCC, 无局部封闭、手术切除、放疗和化疗等没有肿瘤特异性治疗史; 年龄>18岁并签署书面知情同意书者。排除标准: 合并其他口腔疾病的患者,如口腔扁平苔藓、口腔白斑,以及严重全身性疾病者。取30例阻生智齿患者的健康口腔黏膜组织作为健康对照组。另外取30例口腔黏膜下纤维病变(OSF)者行颊黏膜活检时的组织标本作为癌前病变组。记录病史和生活习惯,包括咀嚼槟榔习惯、高血压、糖尿病及其他全身性疾病。健康对照组入选标准: 没有口腔黏膜疾病或其他严重的全身性疾病者。癌前病变组纳入标准: 口腔黏膜下纤维索触诊和(或)黏膜苍白变化,但这些变化并不满足其他疾病诊断标准(包括癌变),也没有口腔疾病治疗史或任何全身性疾病者。
1.2 样本采集
用口腔拭子(OS)收集所有患者的口腔上皮细胞: 一个拭子用于收集病变部位的细胞,另一个用于收集对侧黏膜的细胞。口腔上皮细胞收集于磷酸盐缓冲生理盐水中。所有样本于24 h内送往化验室进行甲基化检测。此外,所有OSCC患者的组织标本均来自于外科手术切除。
1.3 组织DKK-1蛋白表达检测
对石蜡包埋组织进行 4 μm连续切片,柠檬酸盐缓冲液加热至95 ℃, 20 min抗原修复,双氧水阻断内源性过氧化物酶20 min, 羊血清封闭30 min, 滴加DKK-1一抗工作液(1∶200, 北京中杉金桥生物技术有限公司), 4 ℃孵育过夜,羊抗兔二抗37 ℃孵育1 h, DAB 显色(北京中杉金桥生物技术有限公司) 1 min, 风干后封片,光学显微镜下(放大400倍)观察免疫组化检测结果。用染色强度和阳性细胞百分比2项指标综合评价结果。染色强度评分: 阴性=0分,弱=1分,中度=2分,强=3分; 阳性细胞百分比评分: ≤10%阳性细胞=0分, >10%~25%阳性细胞=1分, >25%~50%阳性细胞=2分, >50%阳性细胞=3分。染色强度和阳性细胞百分比总评分为0~1分为阴性, >1分为阳性。
1.4 组织和OS标本中DKK-1基因甲基化状态检测
首先利用QIAamp DNA Mini Kit(德国Qiagen公司)从样本中提取基因组DNA(gDNA), 并用NanoDrop 2000c紫外-可见光分光光度计测定浓度。基于重亚硫酸盐转化的方法检测基因甲基化状态,利用EpiTect重亚硫酸盐转化试剂盒(德国Qiagen公司)将500 ng gDNA进行重亚硫酸盐修饰,并进行定量甲基化特异性聚合酶链反应(qMSP)。利用TaqMan探针和LightCycler 480高通量实时荧光定量PCR仪(德国Roche applied science公司)对DKK-1进行检测: 95 ℃预变性10 min, 随后50个循环(95 ℃变性10 s, 60 ℃退火40 s, 40 ℃延伸40 s)。COL2A1作为内参基因进行定量,当内参基因Cp>35时,反应无效。最后利用ΔCp(Cp靶基因-CpCOL2A1)预估DKK-1基因的甲基化水平。甲基化指数(MI)=2-ΔCp×10 000。
1.5 统计学分析
将SPSS 20.0统计学软件用于分析数据,DKK-1基因MI不符合正态性检验,表示为中位值(四分位值),进行Mann-WhitneyU检验和Kruskal-Wallis检验。以P<0.05为差异有统计学意义。组织标本与OS标本中DKK-1基因甲基化水平进行Spearman相关系数分析。绘制受试者工作特征(ROC)曲线,并分析曲线下面积(AUC)、灵敏度及特异度。
2 结 果
2.1 各组组织中DKK-1蛋白表达情况
DKK-1蛋白主要定位于基底层上皮细胞胞浆内(图1A)。与健康对照组(93.33%, 28/30)相比,癌前病变组(66.67%, 20/30)和OSCC组(20.90%, 14/67)DKK-1蛋白阳性表达率降低,差异有统计学意义(χ2=48.521,P<0.001); 此外, OSCC组肿瘤组织中DKK-1蛋白阳性表达率低于癌前病变组,差异有统计学意义(χ2=19.068,P<0.001), 见图1。
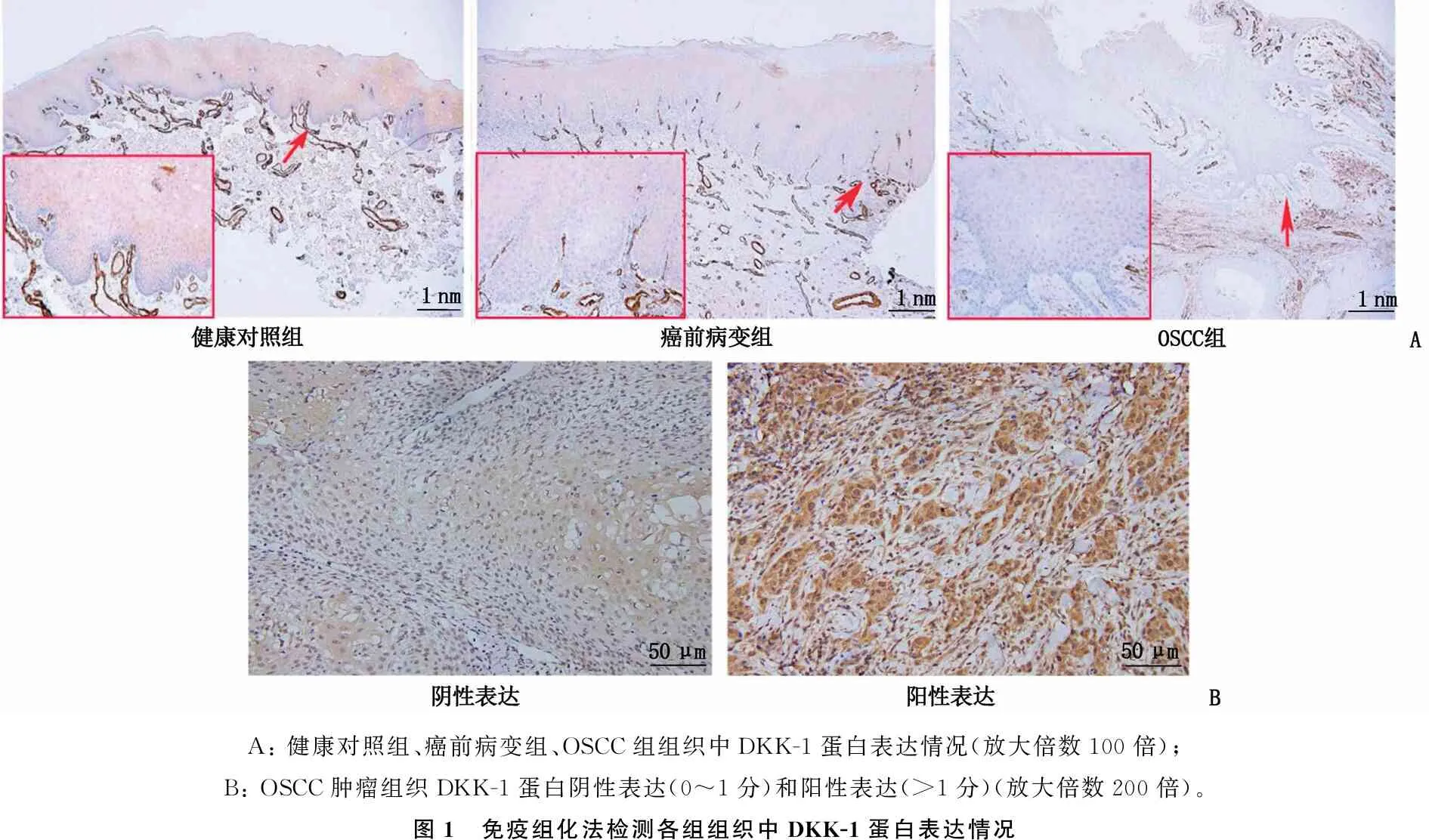
A: 健康对照组、癌前病变组、OSCC组组织中DKK-1蛋白表达情况(放大倍数100倍); B: OSCC肿瘤组织DKK-1蛋白阴性表达(0~1分)和阳性表达(>1分)(放大倍数200倍)。图1 免疫组化法检测各组组织中DKK-1蛋白表达情况
2.2 各组组织和OS标本中DKK-1基因启动子甲基化水平
无论是组织标本还是OS标本,癌前病变组和OSCC组DKK-1基因甲基化水平均高于健康对照组,且OSCC组DKK-1基因甲基化水平高于癌前病变组,差异有统计学意义(P<0.001), 见表1。此外,癌前病变组和OSCC组患者病变同侧OS标本中DKK-1基因甲基化水平高于病变对侧标本,差异有统计学意义(P<0.001)。经Spearman相关系数分析,组织标本与OS病变同侧标本中DKK-1基因甲基化水平呈正相关性(rs=0.672,P<0.001), 见图2。
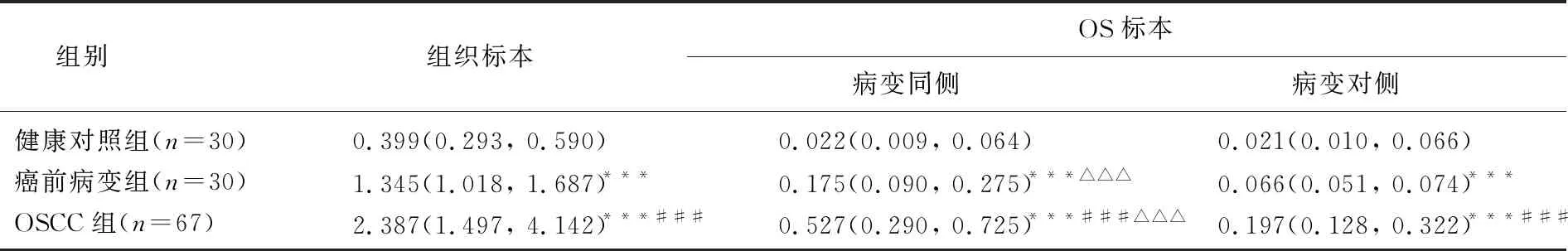
表1 健康对照组、癌前病变组、OSCC组组织和OS标本中DKK-1基因启动子甲基化水平[M(P25, P75)]
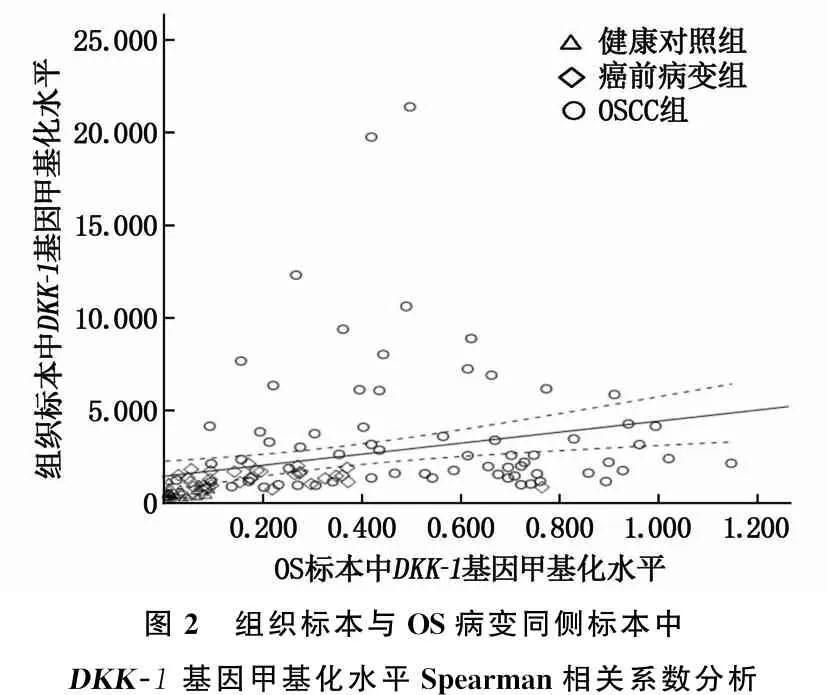
图2 组织标本与OS病变同侧标本中DKK-1基因甲基化水平Spearman相关系数分析
2.3 OSCC组织中DKK-1蛋白表达和基因甲基化水平的关系
DKK-1蛋白阴性表达组织中基因甲基化水平[3.150(1.987, 6.070)]高于阳性表达组织的[1.073(0.950, 1.160)], 差异有统计学意义(Z=-5.653,P<0.001)。
2.4 ROC曲线分析
组织和OS病变同侧标本中DKK-1基因甲基化水平用于鉴别诊断OSCC和癌前病变的AUC分别为0.799(95%CI: 0.713~0.884,P<0.001)、0.843(95%CI: 0.762~0.924,P<0.001), 经Z检验, 2种标本AUC比较,差异无统计学意义(P>0.05)。见图3。
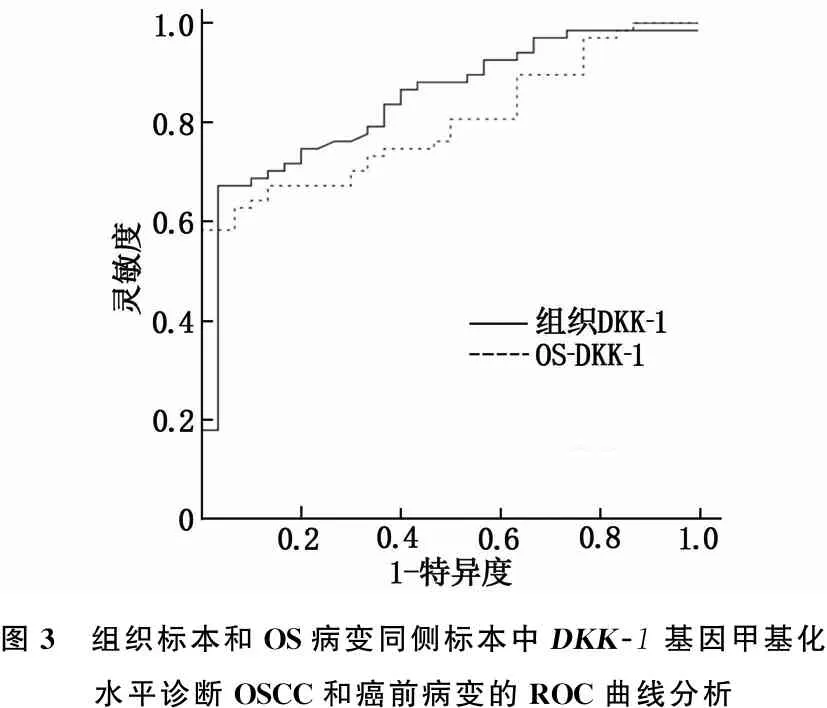
图3 组织标本和OS病变同侧标本中DKK-1基因甲基化水平诊断OSCC和癌前病变的ROC曲线分析
2.5 分层分析
利用病变同侧和对侧OS标本DKK-1基因甲基化数据对OSCC病变病理特征进行诊断。当进行年龄、性别、吸烟史、饮酒史、T分期、N分期、骨质侵犯的分层分析时,AUC差异无统计学意义(P>0.05), 表明DKK-1基因甲基化可能不受上述因素影响。而基于肿瘤分期和肿瘤分化程度进行分层分析时,AUC差异有统计学意义(P<0.05)。见表2。
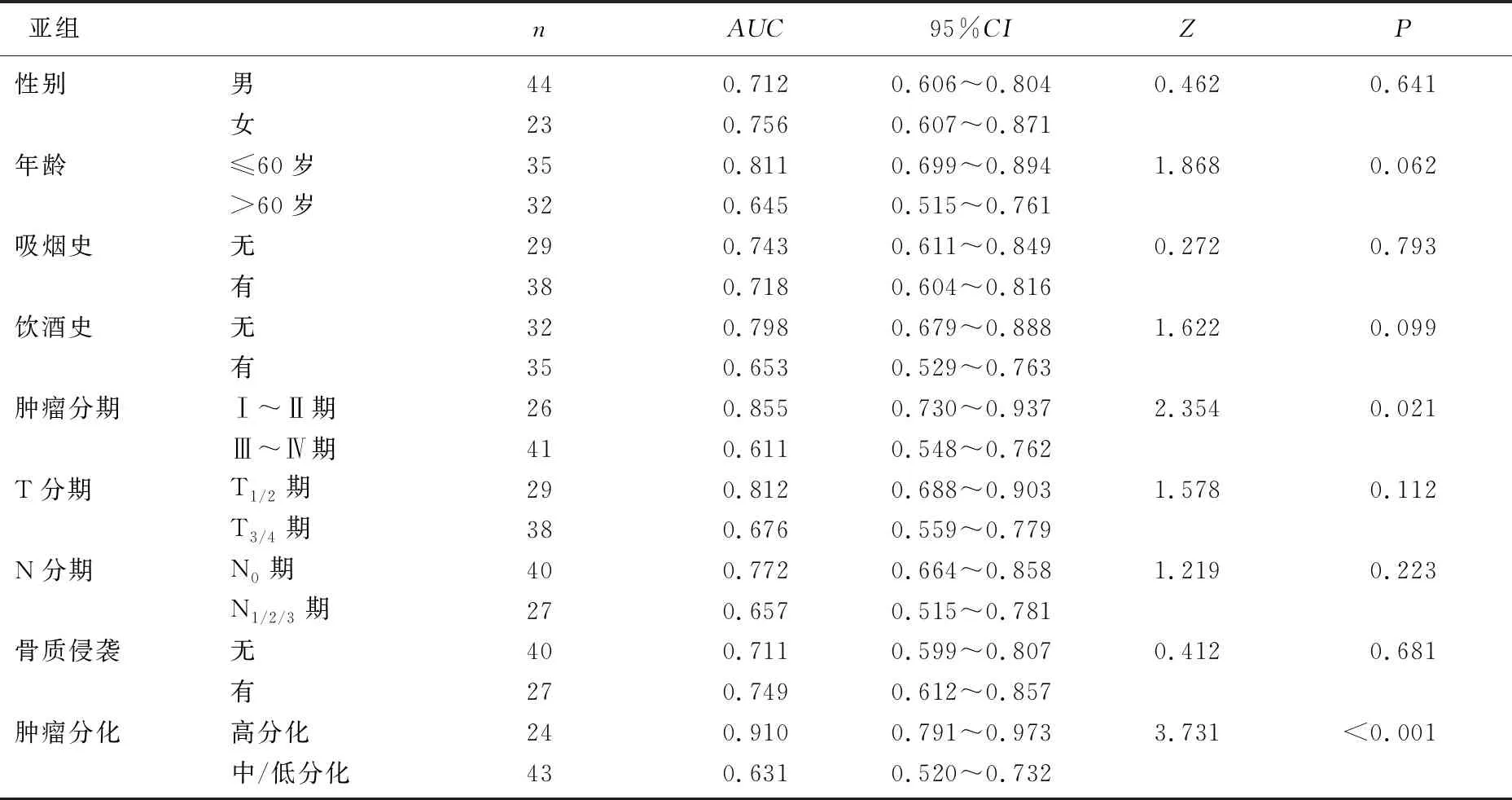
表2 DKK-1基因甲基化水平在OS标本中不同亚组间比较
3 讨 论
OSCC可起源于口腔中的任何组织,其恶性程度较高,预后较差, 5年生存率只有41.0%~79.5%[6-7]。近年来,流行病学研究[8]显示,中国OSCC发病呈增加和年轻化趋势,并引起广泛关注。本研究发现,DKK-1基因高甲基化检测有望成为OSCC早期诊断的潜在生物标志物。由于ROC曲线分析已被广泛应用于诊断方法学的行为分析,因此利用ROC曲线分析,证实在组织或OS标本中,DKK-1基因甲基化水平可用于OSCC和OSF患者的鉴别诊断。此外,这些差异不受年龄、性别、吸烟史、饮酒史以及肿瘤N分期、T分期、骨质侵袭等因素的影响。而中晚期OSCC患者OS标本中DKK-1基因高甲基化更普遍,证明OS标本中病变部位DKK-1基因甲基化水平足以反映OSCC患者肿瘤组织标本中DKK-1基因甲基化状态和DKK-1蛋白表达水平,且可用于OSCC的早期诊断。
DKK-1属于DKK家族,作为低密度脂蛋白受体相关蛋白5/6共受体的抑制配体, DDK-1阻断其与Wnt的相互作用,从而导致β-catenin降解, DDK-1已被鉴定为抑制Wnt信号转导途径的分泌蛋白[9]。研究[10]证实,与正常对照细胞相比,口腔鳞状细胞中DKK-1表达频繁上调,然而作者并未进一步利用临床标本证实DKK-1与疾病进展的关系。DDK1表达降低被认为是Wnt/β-catenin 通路异常激活的机制之一。众所周知, Wnt信号通路在胚胎发生、器官发生和体内平衡中发挥着重要作用。这一信号级联是许多正常生理过程所必需的,如细胞增殖、组织再生、胚胎发育和许多其他系统和局部效应,其可以在不同的水平上被调节[11]。因此,通路的缺陷可能会导致一些复杂的效应。研究[12-15]发现DKK-1异位表达可抑制细胞增殖,或通过凋亡促进因子诱导细胞凋亡。DKK-1在许多肿瘤中(肝癌等)低表达,但在其他肿瘤中(非小细胞肺癌、食管鳞癌等)过表达,说明DKK-1在不同肿瘤的发生、进展和转移中发挥着复杂而不同的作用。因此,在人类多种癌症的研究中, DKK-1被认为是诊断和预后的一种很有前途的生物标志物。本研究首先证实DKK-1蛋白在健康对照组织上皮细胞细胞中表达强烈,而在OSF和OSCC组织中表达显著减弱。这说明DKK-1在口腔黏膜组织中表达下调,可能是影响OSF发病和恶性转化的重要分子机制。
异常的启动子甲基化被认为是肿瘤发生的关键事件。不同的Wnt信号在OSCC和OSF组织中发生高甲基化,如Wnt-抑制因子-1[16]。在本研究中,DKK-1基因甲基化水平在健康的口腔黏膜中较低,但在 OSF和OSCC癌组织中较高,这提示DKK-1基因甲基化异常可能是与抑制DKK-1基因表达或下调DKK-1蛋白表达有关,进而阻断了DKK-1对Wnt/β-catenin通路的抑制,导致Wnt/β-catenin通路的异常激活,这在OSF恶性转化中发挥了重要作用。DNA异常甲基化已被报道是OSCC的重要致癌机制。由于甲基化所致的表达异常是可逆的,可以使用去甲基化药物使甲基化沉默基因重新表达,因此深入研究口腔癌抑制基因甲基化也将会为口腔癌的预防和治疗提供新思路。
组织病理学是目前世界范围内诊断OSCC的黄金标准[17], 然而一般来说,常规活组织检查至少需要4~5 d, 且属于侵入性手段。此外其他诊断手段,如DNA倍体分析和亚甲蓝染色等也有一定的临床应用局限性[18]。相比之下,通过实时PCR结合口腔采样拭子技术检测DNA甲基化是一种相对简单、客观、耗时短、应用广泛、非侵入性的分子生物学技术。与活检检查相比, OS标本甲基化检测可能成本较高,因其需要特定的试剂和仪器来完成工作,但是随着该技术的普及,成本将会迅速降低。因此,考虑到该技术的有效性和可行性,检测OS标本DNA甲基化显示出作为OSCC早期辅助诊断手段的巨大潜力,特别是对于不适合进行手术或活检的特定人群。在亚组分析中,年龄、性别、吸烟史、饮酒史等环境因素的暴露基本不会影响DNA甲基化的检测。由于环境暴露(包括生活方式和饮食习惯)可能在中国不同地理区域内有很大的差异性,未来鼓励进行更多有针对性的研究。
综上所述,从病变部位采集的OS标本中检测到DKK-1基因甲基化状态可充分反映肿瘤组织样本中DKK-1基因的甲基化水平和DKK-1蛋白表达情况,并且OS标本中DKK-1基因高甲基化可用于OSF癌变监测以及OSCC的早期诊断,其有望成为临床上一种非侵入性和替代或辅助性的诊断工具。
