黏膜重塑相关因子W nt1、糖原合成酶激酶-3β、β-连环蛋白在不同类型慢性鼻窦炎中的表达
2022-05-16乔新杰赵玉林董栋
乔新杰,赵玉林,董栋
(郑州大学第一附属医院 鼻科,河南 郑州 450052)
慢性鼻窦炎(chronic rhinosinusitis,CRS)是环境因素、微生物感染、变态反应、鼻腔鼻窦局部解剖变异等多种因素导致的累及鼻腔鼻窦黏膜甚至黏膜下骨质的慢性炎症性疾病,是耳鼻咽喉科常见病及多发病[1]。临床表现主要为鼻塞、浓涕、头面部胀痛、嗅觉障碍。流行病学调查结果表明,我国CRS的患病人数超过9 000万,给社会带来沉重负担[2]。临床上根据是否伴发息肉将CRS分为慢性鼻窦炎伴鼻息肉(chronic rhinosinusitiswith nasal polyps,CRSwNP)和慢性鼻窦炎不伴鼻息肉(chronic rhinosinusitis without nasal polyps,CRSsNP)[3-4]。目前关于CRS的发病机制尚不明确,近年来提出生物膜、金黄色葡萄球菌超抗原、免疫屏障、群体感应系统等相关学说[5-7]。随着研究深入,发现鼻黏膜组织重塑在CRS的发病过程中起着越来越重要的作用[8-9]。黏膜重塑与黏膜炎症这两个过程互相促进[10],上皮间质转化(epithelial-to-mesenchymal transition,EMT)是黏膜重塑的重要环节[11],但其机制尚不明了。研究表明,EMT是在多种细胞信号通路的介导下完成的,其中,经典的Wnt通路在CRS黏膜组织重塑中发挥着重要作用[12-14]。本研究探讨经典Wnt通路中Wnt1、糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)、β连环蛋白(βcatenin)在CRS鼻黏膜上皮重塑中的表达情况。
1 材料与方法
1.1 临床资料本研究选取2020年12月至2021年3月在郑州大学第一附属医院鼻科接受鼻内镜手术的117例患者,其中男87例,女30例。研究对象分为3组,分别为对照组、CRSwNP组和CRSsNP组,对照组取鼻中隔偏曲伴下鼻甲肥大患者的下鼻甲黏膜,CRSwNP组取CRSwNP患者鼻息肉组织,CRSsNP组取CRSsNP患者钩突黏膜。对照组39例,男27例,女12例,年龄14~56(34.00±15.88)岁;CRSwNP组39例,男33例,女6例,年龄17~46(37.38±11.64)岁;CRSsNP组39例,男27例,女12例,年龄16~55(33.41±14.16)岁。CRSsNP组和CRSwNP组患者的诊断均符合中国慢性鼻窦炎诊断和治疗指南[15]。排除标准:(1)阿司匹林不耐受三联征、原发性纤毛运动功能障碍、囊性纤维化、自身免疫性疾病;(2)1个月内使用抗生素、糖皮质激素等药物治疗;(3)真菌性鼻窦炎、变应性鼻炎、上颌窦后鼻孔息肉等;(4)鼻腔鼻窦恶性肿瘤、血液系统疾病。本研究已获得郑州大学第一附属医院医学伦理委员会批准。所有患者均签署知情同意书。
1.2 标本的采集所有标本均由同一位有经验的鼻科医生钳取,标本采集过程中避免牵拉、撕扯。所取标本分为两份,一份冻于-80℃冰箱,用于实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qPCR)检测Wnt1、GSK-3β、β-catenin 3个因子在转录水平的表达,一份置于甲醛溶液中,用于组织病理的检测。
1.3 实验方法
1.3.1组织染色 甲醛溶液固定标本后,冲洗标本,梯度酒精脱水,二甲苯透明,浸蜡,包埋制成蜡块。切片厚度为0.5μm,裱片,烘干。脱蜡、水化后进行组织染色。常规HE染色(HE染色液试剂盒,北京索莱宝科技有限公司,G1120),苏木精染液染色10 min,分化30 s,冲洗,伊红染液2 min,冲洗,常规梯度酒精脱水,二甲苯透明,封片,高倍镜(400×)下观察炎症细胞浸润、纤毛上皮细胞损伤的情况及基膜是否暴露及其厚度变化。采用过碘酸希夫试剂(糖原染色试剂盒,北京索莱宝科技有限公司,G1281)进行糖原染色,高碘酸5 min,冲洗,Schiff试剂10 min,冲洗,苏木精复染,分化,脱水,透明,封片,观察红色颗粒的分布及量的变化。采用马松染色进行胶原纤维染色(改良Masson三色染色试剂盒,北京索莱宝科技有限公司,G1346),苏木精染液染色10 min,分化30 s,冲洗,Masson复合染色液5 min,冲洗后10 g·L-1磷钨酸处理5 min,苯胺蓝复染5 min,1%体积分数醋酸处理1 min,梯度酒精脱水,二甲苯透明,封片,胶原纤维呈现蓝色,观察胶原沉积的部位。切片常规脱蜡水化、抗原封闭、抗原修复后SP法行免疫组织化学检测Wnt1、GSK-3β、βcatenin在组织中表达的量及分布。所有标本照片采集均采用Neccope生物显微镜NE910采集,并运用Image ProPlus 6.0软件对免疫组化图片进行定量分析。
1.3.2qPCR 采用Trizol试剂提取鼻黏膜组织的总RNA,使用UEIris RTmix with DNase试剂盒(USEverbright®Inc.,R2020)将RNA逆转录为cDNA,进一步采用SYBR染料法进行qPCR,检测Wnt1、GSK-3β、β-catenin在转录水平上的表达。表1为各基因的引物序列,均来自于PumMed。

表1 实时荧光定量聚合酶链反应引物序列
1.4 统计学方法运用GraphPad Prism 9.0对实验结果进行统计分析。符合正态分布的计量资料采用均数±标准差(ˉx±s)表示,不符合正态分布的数据以中位数及四分位数[M(P25,P75)]表示;3组间的比较,符合正态分布且方差齐者采用方差分析,不符合方差分析条件者采用Kruskal-Wallis检验,并进一步采用Mann-Whitney U检验进行3组间数据的两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 HE染色结果400倍光学显微镜下,与对照组(图1A)相比,CRSsNP组(图1B)的鼻黏膜上皮完整性遭到破坏甚至消失,上皮纤毛的结构紊乱,鼻黏膜上皮细胞的极性消失,上皮杯状细胞增多,基膜增厚,上皮下间质中有较多炎症细胞聚集及黏液腺体表达的增多;与对照组相比,CRSwNP(图1C)组鼻黏膜上皮细胞极性消失,杯状细胞增多,组织细胞间,疏松水肿,基膜增厚,上皮下间质可见炎症细胞聚集。

图1 各组鼻黏膜HE染色结果(400×)
2.2 糖原染色结果400倍光学显微镜下,与对照组(图2A)相比,CRSsNP组(图2B)中,鼻黏膜上皮杯状细胞中糖原表达增多,间质中腺体增多,且腺体中糖原表达增多;CRSwNP组(图2C)中,上皮杯状细胞中糖原表达增多,但表达较CRSsNP组少。

图2 各组鼻黏膜糖原染色结果(400×)
2.3 马松染色结果400倍光学显微镜下,胶原纤维主要表达在上皮下的间质中,与对照组(图3A)相比,CRSsNP组(图3B)及CRSwNP(图3C)胶原纤维明显增加,其中CRSsNP组鼻黏膜间质中表达最多。

图3 各组鼻黏膜胶原纤维染色结果(400×)
2.4 免疫组织化学结果各组织标本平均光密度值(OD值)见表2。400倍光学显微镜下,Wnt1主要表达在鼻黏膜上皮细胞胞质中,CRSsNP组(图4B)和CRSwNP组(图4C)Wnt1的表达量较对照组(图4A)增多,且在CRSsNP组中表达量更高,对照组与CRSsNP组、CRSwNP组与CRSsNP组差异具有统计学意义(P<0.05)。GSK-3β主要表达在鼻黏膜上皮细胞胞质中,与对照组(图4D)相比,CRSsNP组(图4E)及CRSwNP组(图4F)GSK-3β表达量下降,且在CRSsNP组中下降更明显,对照组与CRSsNP组相比,差异具有统计学意义(P<0.05)。β-catenin在对照组鼻黏膜(图4G)中主要表达在细胞膜上,在CRSwNP组(图4I)及CRSsNP组(图4H)组织标本中主要表达在细胞质及细胞核中,且表达量均增加,对照组和CRSwNP组、对照组和CRSsNP组差异具有统计学意义(P<0.05)。

图4 免疫组织化学检测Wnt1、GSK-3β、β-catenin在对照组、CRSsNP组、CRSwNP组中的表达(400×)
2.5 qPCR结果Wnt1、GSK-3β、β-catenin因子在对照组、CRSwNP组、CRSsNP组的相对表达量见表3、图5。Wnt1在CRSwNP组和CRSsNP组鼻黏膜中的表达量较对照组中增加,其中CRSsNP组表达量增多(P<0.05),对照组和CRSwNP组、对照组和CRSsNP组差异有统计学意义(P<0.05)。CRSwNP组和CRSsNP组鼻黏膜中GSK-3β的表达量均较对照组较少,其中CRSsNP组表达量减少(P<0.05),对照组和CRSwNP组、对照组和CRSsNP组差异有统计学意义(P<0.05)。β-catenin在CRSwNP组和CRSsNP组鼻黏膜中的表达量较对照组减少,其中CRSsNP组表达量减少,对照组和CRSwNP组、对照组和CRSsNP组差异有统计学意义(P<0.05)。

表3 Wnt1、GSK-3β、β-catenin因子在各组中的相对表达量[M(P25,P75)]
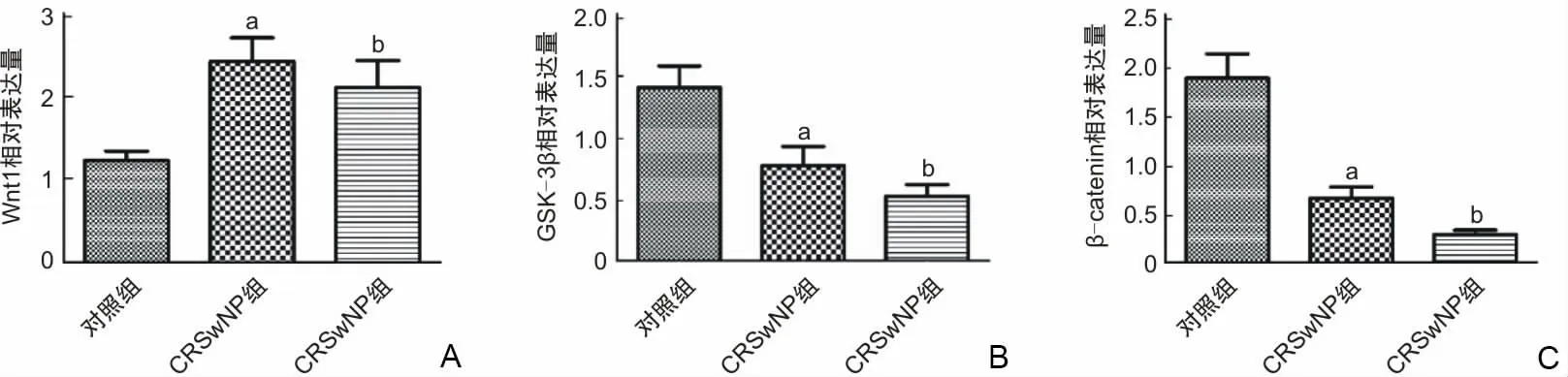
图5 Wnt1、GSK-3β、β-catenin在各组中的表达
3 讨论
鼻腔鼻窦黏膜是抵抗外来吸入物质如病原微生物、过敏原等的第一道屏障。慢性炎症会对鼻黏膜上皮产生不良影响,如纤毛缺失、纤毛功能紊乱、上皮化生、黏液纤毛清除系统功能受损、上皮紧密连接受损、黏膜上皮重塑等[16]。CRS主要的病理特征即鼻黏膜上皮屏障遭到破坏及组织重塑。目前虽然对鼻黏膜组织重塑的机制尚不明确,但现有的研究表明,EMT在鼻黏膜组织重塑中发挥着重要作用[11]。Wnt/β-catenin信号通路在呼吸道黏膜上皮组织重塑中发挥着重要作用[14,17]。
在Wnt/β-catenin信号通路中,当Wnt与细胞膜上Frizzled受体结合后,会与LRP5/6一起在细胞膜表面形成一个功能性的复合体,通过触发多功能激酶GSK-3β,使其从APC/Axin/GSK-3β复合体上解离下来,稳定的β-catenin通过Rac1和其他因子转运入核并在胞核取代Groucho/HDAC抑制复合体来激活TCF/LEF介导的EMT效应子的转录。当Wnt信号缺失时(断开状态),胞浆中β-catenin迅速被β-连环蛋白破坏复合体磷酸化和泛素化,从而导致β-catenin的降解[18],该途径主要是通过β-catenin在细胞核中的积累,激活Wnt靶基因,从而调控细胞的增殖和分化,其中β-catenin及GSK-3β是本通路中重要的可溶性细胞因子[19]。
现有的动物实验研究显示,通过金黄色葡萄球菌诱导并建立小鼠鼻窦炎模型,观察Wnt/β-catenin信号通路中GSK-3β、β-catenin的表达,结果显示,与正常小鼠相比,鼻窦炎小鼠鼻窦黏膜中GSK-3β表达下降、β-catenin表达增加[20]。但鼻腔鼻窦中的菌群具有多样性[21],且各菌群在不同状态下会出现协同及抑制现象,菌群之间的相互作用可能会影响本研究通路中相关因子的表达,同时实验动物与人存在部分差异,因此,本研究通过收集CRS患者及对照组鼻腔鼻窦黏膜来探讨Wnt/β-catenin信号通路中GSK-3β、β-catenin在CRS组织重塑中的表达。
本研究表明,组织病理学上,CRSsNP和CRSwNP鼻黏膜与正常鼻黏膜组织相比,CRSsNP和CRSwNP鼻黏膜上皮完整性遭到破坏,基膜的改变,上皮细胞极性消失,炎症细胞增多,杯状细胞增多,胶原纤维及糖原表达增加,但CRSsNP和CRSwNP二者之间也存在差异,CRSwNP在黏膜组织病理上主要表现为上皮细胞改变、炎症细胞浸润、杯状细胞增生、细胞外基质降解、纤维蛋白沉积和组织高度水肿形成假性囊肿为特征的鼻黏膜的改变,CRSsNP组织病理学上主要表现为鼻腔黏膜胶原蛋白过多沉积,上皮细胞损伤,细胞外基质胶原沉积,基膜增厚,杯状细胞及黏液腺体增生,这与现有的研究结果[3,19-20]一致,出现鼻黏膜上皮炎症及上皮向间质转化的病理学表现。
本研究提示,在免疫组化中,Wnt1、β-catenin在CRSsNP和CRSwNP鼻黏膜组织中表达增加,且βcatenin在CRSsNP和CRSwNP鼻黏膜组织中的表达出现了胞质向胞核转位的现象,GSK-3β在CRSsNP和CRSwNP鼻黏膜组织中表达减少,这与现有的研究结果[18-20,22]一致。本研究提示,在转录水平上,Wnt1在CRSsNP和CRSwNP鼻黏膜组织中表达较多,GSK-3β、β-catenin在CRSsNP和CRSwNP鼻黏膜组织中表达较少。
β-catenin在转录水平及蛋白表达的不一致可能与蛋白的修饰有关,同时β-catenin作为多个通路的关键因子,也接受其他通路对其的调控,因此仍需进一步通过体外实验及动物实验探讨Wnt/β-catenin信号通路中关键因子对CRS黏膜组织重塑的影响。
