蓝莓花青素脂质体的制备及其稳定性研究
2022-05-16杨雅其鲁宝君
王 蕾,陈 依,杨雅其,鲁宝君,张 晶
(1吉林农业大学 中药材学院,吉林 长春130118;2杭州睦山农实业投资公司,浙江 杭州310000)
蓝莓(VacciniumcorymbosumL.)被誉为“浆果之王”,是联合国粮农组织(FAO)推荐的世界五大健康水果之一[1],富含黄酮、多酚、有机酸和花青素(anthocyanin,An)等多种植物活性成分。花青素是蓝莓发挥天然功能的主要成分。蓝莓花青素是一种黄酮类多酚化合物,由花青素和糖分子通过糖苷键结合而成[2],作为一种水溶性色素,具有广泛的药理活性,包括抗氧化、抗炎、抗癌、抗肥胖和抗糖尿病等[3-6],但由于其对温度、光和pH非常敏感,导致应用受到限制[7]。封装是保护环境敏感生物活性成分的重要方法[8]。到目前为止,已经开发了许多载体系统用于花青素封装,以增强其在贮存期间和胃肠道中的稳定性,并提高其在靶点的生物利用度。
脂质体是一种以脂质为基础的胶体给药系统,由1个或多个磷脂双层膜围绕在1个水核周围组成,可用于疏水性和亲水性化合物的递送,甚至用于双重药物递送[9],但在贮存过程中易发生聚集。聚乙二醇(PEG)是一种柔软、水溶性、无毒、无生物活性的线性高分子[10]。经PEG修饰的脂质体可以延长药物在血液中的循环半衰期,增强其理化稳定性,增加在肿瘤、炎症和病变部位的视向以及药物疗效[11],在很大程度上拓宽了脂质体药物的适用范围。
近年来,提高花青素的稳定性和生物利用度成为一个研究热点。目前,对蓝莓花青素脂质体(Anthocyanin liposome,An-Lip)的研究较少。本试验采用逆向蒸发法制备An-Lip,采用单因素试验结合响应面法确定其最佳工艺条件,同时制备PEG修饰的An-Lip(PEG-An-Lip),并探究其体外释放、红外光谱特性及稳定性,旨在为花青素脂质体的开发及应用奠定基础。
1 材料与方法
1.1 材 料
蓝莓,由吉林农业大学果园提供。大豆卵磷脂(SY-SI-180801),上海艾伟拓医药科技公司;胆固醇(160612),北京生物科技有限公司;透析袋(8 000~14 000 ku),鼎国昌盛生物技术公司;磷酸盐缓冲液(PBS),西格玛奥尔德里奇化学公司;大孔吸附树脂D3520,沧州宝恩吸附材料科技有限公司;滤膜,天津市津腾实验设备有限公司。其他试剂均为分析纯级试剂。
PL303电子分析天平,上海梅特勒-托利多仪器有限公司;T6新世纪紫外可见分光光度计,北京普析通用仪器公司;PB-10酸度计,德国赛多利斯公司;Thermo Fisher ST 16R高速冷冻离心机,北京昊诺斯科技公司;HH-4数显恒温水浴锅,江苏省金坛市荣华仪器制造有限公司;冷冻干燥机,Telstar LyoQuest公司;EYELA DPE-1250旋转蒸发仪,上海爱朗仪器有限公司;KQ5200DB超声波清洗器,昆山市超声仪器有限公司;THZ-92B气浴恒温震荡器,上海博讯医疗生物仪器股份有限公司;激光粒度仪(DLS),NanoBrook 90Plus Zeta,Malvem,UK;傅里叶变换红外光谱仪,上海铂金埃尔默有限公司;H-7650扫描电子显微镜,日本日立公司。
1.2 蓝莓花青素的提取纯化
采用吉林农业大学中药材实验室建立的方法[12]提取并纯化蓝莓花青素。取蓝莓鲜果50.0 g,匀浆后加500 mL pH 3.0的酸化乙醇提取剂(乙醇最终体积分数为70%),超声提取3次,30 min/次,合并提取液,离心,收集上清液,40 ℃下浓缩至无醇味,浓缩液过D3520大孔树脂,依次用pH为2的酸水及体积分数30%,50%,70%的乙醇洗脱,收集洗脱液,低温浓缩,冷冻干燥即得花青素冻干粉。该花青素冻干粉纯度为90%。
1.3 An-Lip的最佳制备工艺
1.3.1 单因素试验 采用逆向蒸发法制备An-Lip,考察大豆卵磷脂与胆固醇质量比、有机相(乙醚)与水相(花青素)体积比和温度对An-Lip包封率的影响。
1)大豆卵磷脂与胆固醇质量比。分别按1∶1,2∶1,3∶1,4∶1,5∶1的比例准确称取大豆卵磷脂和胆固醇共0.168 g,加入20 mL乙醚,待胆固醇和大豆卵磷脂完全溶解后,加5 mL质量浓度为0.253 mg/mL的蓝莓花青素溶液,超声30 min,得到水包油(W/O)型乳剂,将其在40 ℃减压除去乙醚,达到胶态后,滴加30 mL pH为7的PBS缓冲液,减压蒸发得到水性混悬液,用0.45 μm微孔滤膜过滤,即得淡粉色澄清透明的An-Lip混悬液,检测其包封率,确定最佳大豆卵磷脂与胆固醇质量比。
2)有机相与水相体积比。按最佳比例准确称取大豆卵磷脂和胆固醇0.168 g,分别按2∶1,3∶1,4∶1,5∶1,6∶1加乙醚和0.253 mg/mL的蓝莓花青素溶液共40 mL,按上述方法制备An-Lip,检测其包封率,确定最佳有机相与水相体积比。
3)温度。在最佳大豆卵磷脂与胆固醇质量比及有机相与水相体积比条件下制备W/O型乳剂,分别在30,35,40,45,50 ℃下减压除去乙醚后,按上述方法制备An-Lip,检测其包封率,确定最佳温度。
1.3.2 Box-Behnken响应曲面试验 以包封率为响应值,基于 Box-Behnken响应曲面设计试验方案(表1),对影响An-Lip包封率的3个因素在3个水平上进行优化,确定最佳工艺条件。基于最佳工艺条件制备An-Lip,重复3次,测算包封率的平均值。
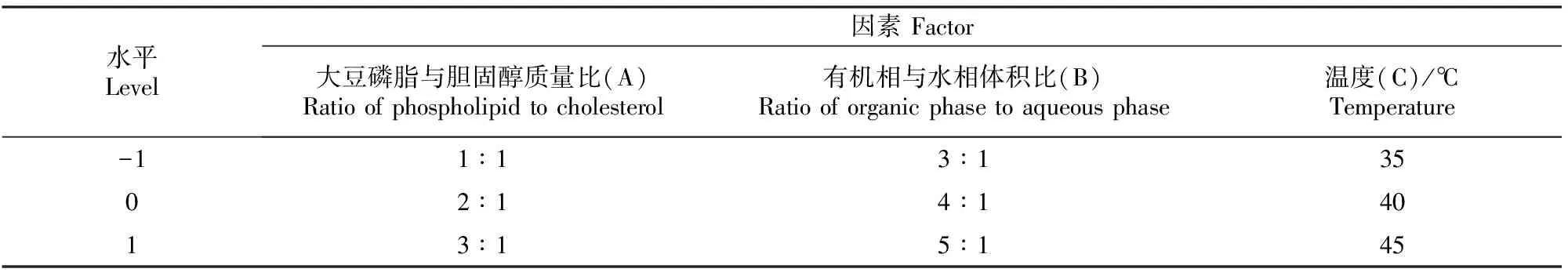
表1 An-Lip的响应面试验设计因素与水平Table 1 Design factors and levels for An-Lip response surface test
1.3.3 An-Lip包封率的测定 将花青素冻干粉用1 mol/L盐酸和甲醇配制成0.05 mg/mL的储备液,然后将其稀释成系列浓度的标准溶液,于530 nm波长下检测吸光度(OD530),对花青素质量浓度(x)与OD530(y)进行线性回归分析,得方程为:y=28.405x+0.005(R2=0.999 6)。该方程在花青素质量浓度为0.001~0.05 mg/mL时线性关系良好。
采用超滤离心法[13]测定An-Lip的包封率。准确量取An-Lip 0.5 mL至超滤离心管中,于4 ℃下10 000 r/min离心30 min,取30 μL上清液,加3 mL甲醇,用分光光度计测OD530,根据标准曲线计算花青素质量浓度,即An-Lip中游离花青素质量浓度。取等体积(30 μL)An-Lip,加3 mL甲醇破乳后测定药物质量浓度,即An-Lip中花青素的总质量浓度。计算包封率:包封率=An-Lip中游离花青素质量浓度/An-Lip中花青素的总质量浓度×100%。
1.3.4 An-Lip的表征 取An-Lip 1 mL,稀释至3 mL,于倒置显微镜下观察An-Lip的形态,并在激光粒度仪中测定其粒径、电位、多分散系数(PDI)。
1.4 PEG修饰的An-Lip的制备
用PEG对An-Lip进行修饰,制备PEG-An-Lip。将含质量分数3% PEG 2000的PBS溶液与等体积的An-Lip涡旋混合后,于4 ℃下静置60 min,即得PEG-An-Lip。
1.5 花青素脂质体的体外释放及红外光谱扫描
1.5.1 体外释放 采用透析法对花青素脂质体的体外释放进行考察[14]。吸取An、An-Lip和PEG-An-Lip各2 mL置于透析袋中,将透析袋置于200 mL pH 7.0 PBS释放介质中,37 ℃恒温气浴振荡(100 r/min),分别于0.5,1,2,4,6,8,10,12,24,48 h取2 mL释放介质备测,并补足同温2 mL PBS。测定释放介质样品的OD530,通过标准曲线确定其游离花青素质量浓度,计算累积释放率(Q)。
式中:C0为初始花青素质量浓度(mg/mL),V0为释放介质总体积(mL),Ci为第i次取样样品中的花青素质量浓度(mg/mL),Vi为第i次取样样品体积(mL),m表示样品中花青素的总质量(mg),n为取样次数。
1.5.2 红外光谱(FT-IR)扫描 分别取5 mg空白脂质体(B-Lip)、An、An-Lip、PEG-An-Lip冻干品,在4 000~450 cm-1进行FT-IR扫描。
1.6 花青素脂质体的稳定性
pH稳定性:分别配制不同pH (1.0,2.0,5.0,7.0,9.0)的HCl溶液,将其与B-Lip、An-Lip和PEG-An-Lip按体积比1∶1混合,室温下培养30 min后,在激光粒度仪中表征。所有数据均为3次测量的平均值。
热稳定性:将An、An-Lip和PEG-An-Lip在80 ℃水浴1 h,在0(水浴前),15,30,45,60 min时取样,将样品在4 ℃下15 000 r/min离心20 min,收集上清液,立即放入冰浴中,测量OD530,计算花青素保留率[15]。
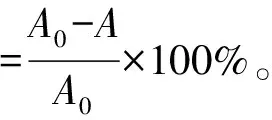
式中:A0为水浴前花青素的OD530;A为水浴不同时间花青素的OD530。
UV稳定性:将An、An-Lip和PEG-An-Lip置于6孔细胞培养板中,室温下用紫外线照射3 h,在0,15,30,45,60,90,120和180 min取样,样品于4 ℃下15 000 r/min离心20 min,测量各时间点的OD530,计算花青素保留率。
1.7 数据处理
所有试验均重复3次,结果用“平均值±标准差”表示,采用Graphpad prism 6对单因素及稳定性试验结果进行分析,采用Design expert软件对响应面试验进行设计与分析。
2 结果与分析
2.1 An-Lip制备的单因素试验结果
2.1.1 大豆卵磷脂与胆固醇的质量比 如图1所示,当大豆卵磷脂与胆固醇质量比为2∶1时,An-Lip包封率最高,为79.98%。胆固醇比例提高时,由于大豆卵磷脂量太少,脂质体膜形成困难且不牢固,包封率降低。而当大豆卵磷脂比例逐渐增大时,水化比较困难,脂质体重新聚集,导致包封率下降。
2.1.2 有机相与水相的体积比 如图1所示,当有机相与水相体积比为4∶1时,An-Lip包封率最高,达82.12%。水相比例提高,有机相与水相不能很好地形成稳定的W/O型乳液;有机相比例提高,脂质体中包入药量太少,致使包封率降低。
2.1.3 温 度 脂质体制备过程中,水浴温度是大豆卵磷脂溶解、成膜的关键因素,影响脂质体的稳定性。如图1所示,当温度为40 ℃时,An-Lip包封率最高,为82.88%。温度过低,脂质体成凝胶时间长且不均匀;温度过高,会使花青素降解,影响包封率。
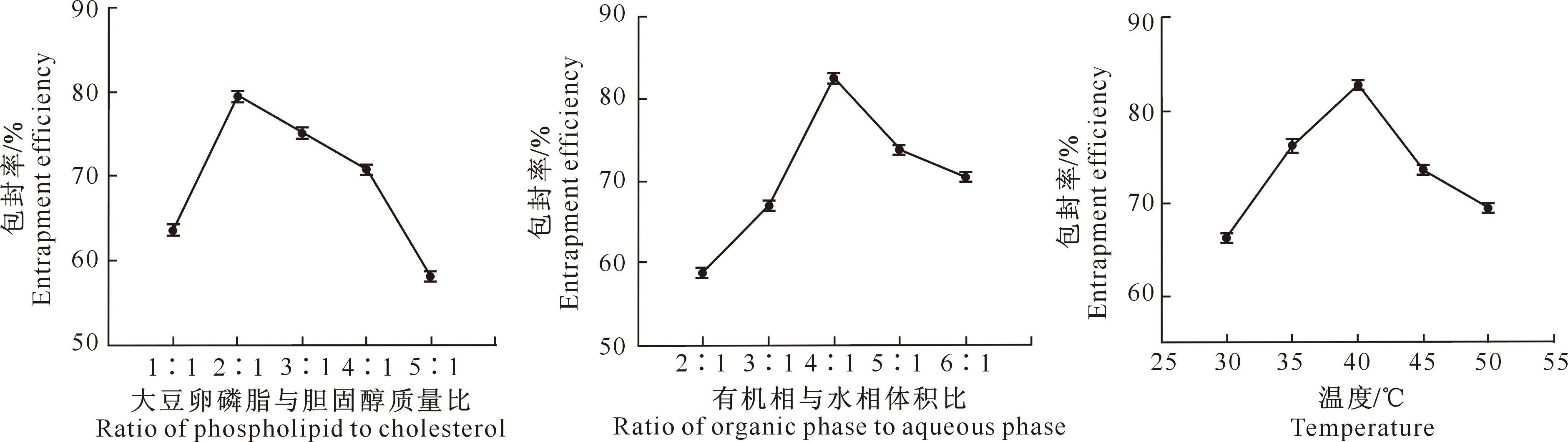
图1 花青素脂质体制备的单因素试验结果Fig.1 Single factor test of anthocyanin liposomes
2.2 An-Lip最佳制备工艺
2.2.1 Box-Behnken响应面试验设计优化结果 基于单因素试验结果,设计Box-Behnken试验,结果见表2。
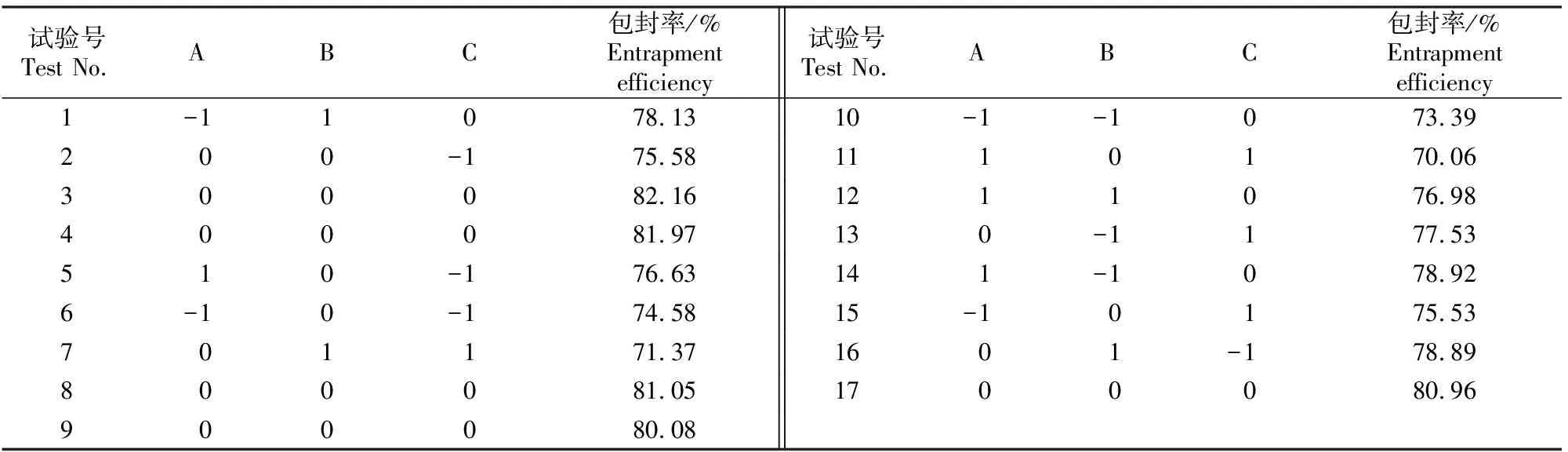
表2 花青素脂质体制备的响应面试验结果Table 2 Results for anthocyanin liposomes response surface test
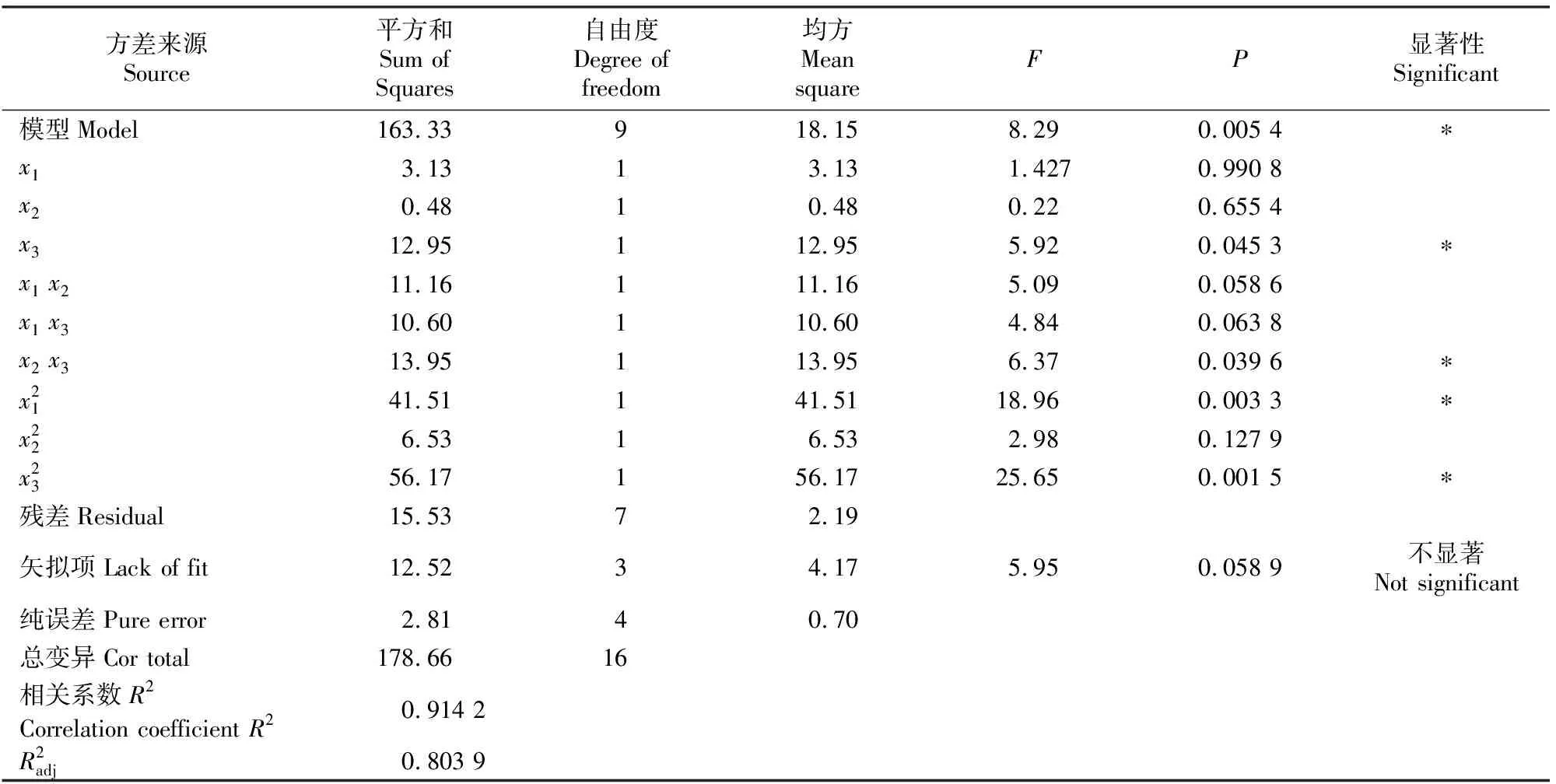
表3 花青素脂质体包封的响应面设计方差分析Table 3 Analysis of variance for response surface test of anthocyanin liposomes
2.2.2 交互作用分析 一般来说,交互作用的强弱用等高线的形状来反映,圆形说明两因素交互不显著,椭圆形则表示两因素交互作用显著[16]。图2中,因素A(大豆卵磷脂与胆固醇质量比)与因素C(温度)的等高线最圆,可知A与C之间的交互作用对包封率影响最小;A与B(有机相与水相比例)、B与C的等高线扁平,表明A与B、B与C的交互作用对包封率的影响较大。
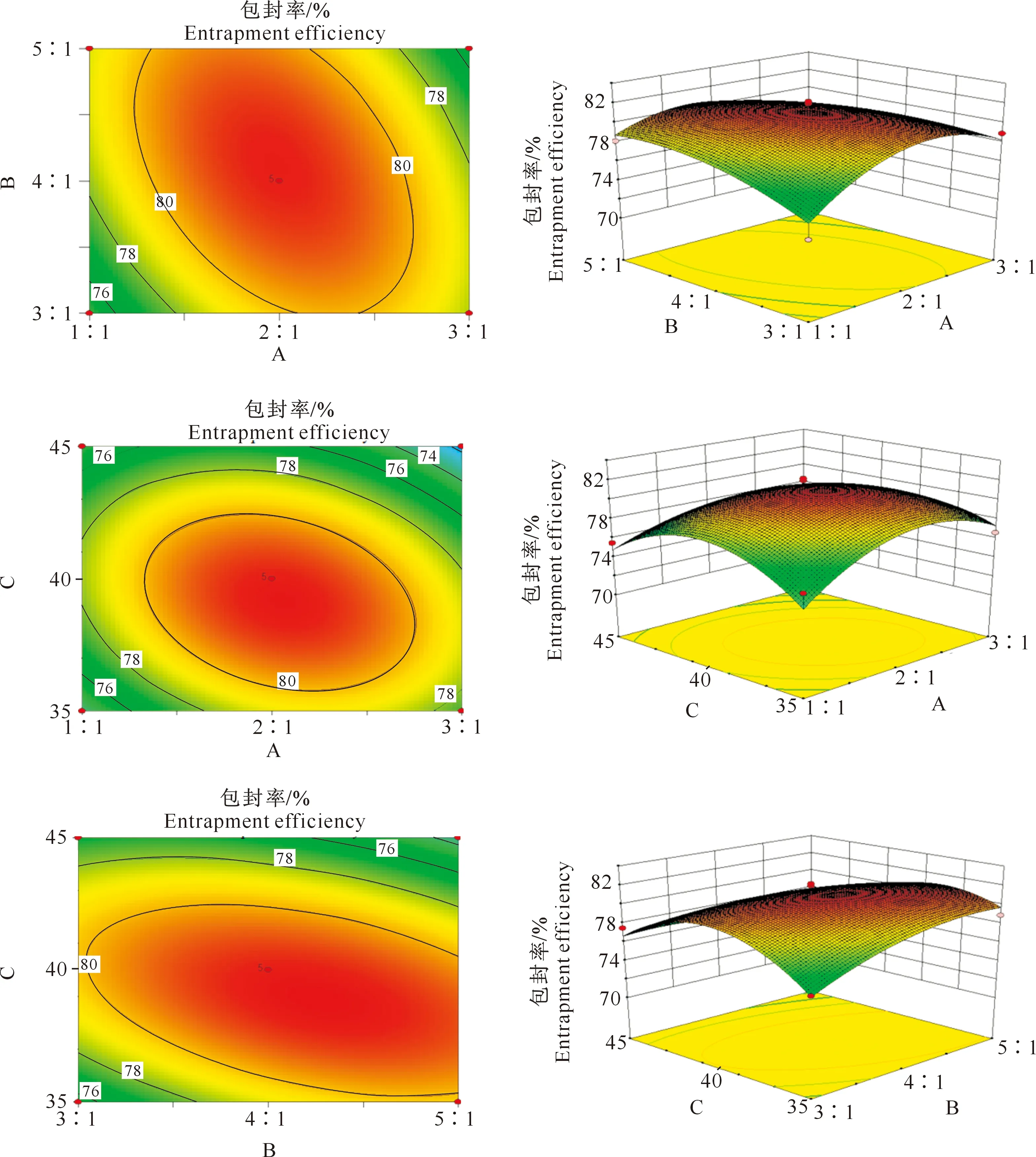
A、B、C分别代表大豆卵磷脂与胆固醇质量比、有机相与水相体积比和温度A,B and C represent mass ratio of phospholipid to cholesterol,volume ratio of organic phase to aqueous phase,and temperature,respectively图2 因素交互作用对花青素脂质体包封率的影响Fig.2 Effect of factor interaction on encapsulation efficiency of anthocyanin liposomes
2.2.3 验证试验 通过Design expert软件,得到响应面法优化An-Lip制备的工艺条件为:大豆卵磷脂与胆固醇质量比1.98∶1,有机相与水相体积比4.29∶1,温度为38.77 ℃。但考虑到实际操作的方便性,将试验条件调整为:大豆卵磷脂与胆固醇质量比2∶1,有机相与水相体积比4∶1,温度40 ℃。按照上述最佳工艺条件制备An-Lip,重复3次,平均包封率为82.16%,说明该方法具有良好的可靠性。
2.2.4 An-Lip的表征 实验结果显示,An-Lip粒径呈正态分布,平均粒径为(221.52±10.3) nm(图3-A);体系分散均匀,PDI为(0.230±0.21);Zeta电位为(-31.05±2.23) mV(图3-B),说明脂质体表面带负电荷,且体系稳定。镜下观察发现,脂质体为球形或椭球形。
2.3 花青素脂质体的体外释放
体外释放试验结果(图4)表明,An 8 h的累积释放率可达95%以上,之后基本保持不变,说明通过透析袋的药物释放不是一个限制性释放过程[17]。药物制成脂质体后,可分为快速释放和缓慢释放2个阶段。8 h时,An-Lip和PEG-An-Lip的累积释放率分别为50.05%和36.98%,可知PEG-An-Lip的释放较An和An-Lip明显变缓。8 h后An-Lip和PEG-An-Lip继续释放,在12 h时其累积释放率分别为63.33%和47.78%,24 h时分别为67.99%和50.62%,48 h时分别为73.77%和53.33%。结果表明,12 h后An-Lip和PEG-An-Lip的释放速度变缓,其中PEG-An-Lip的缓释效果更优。
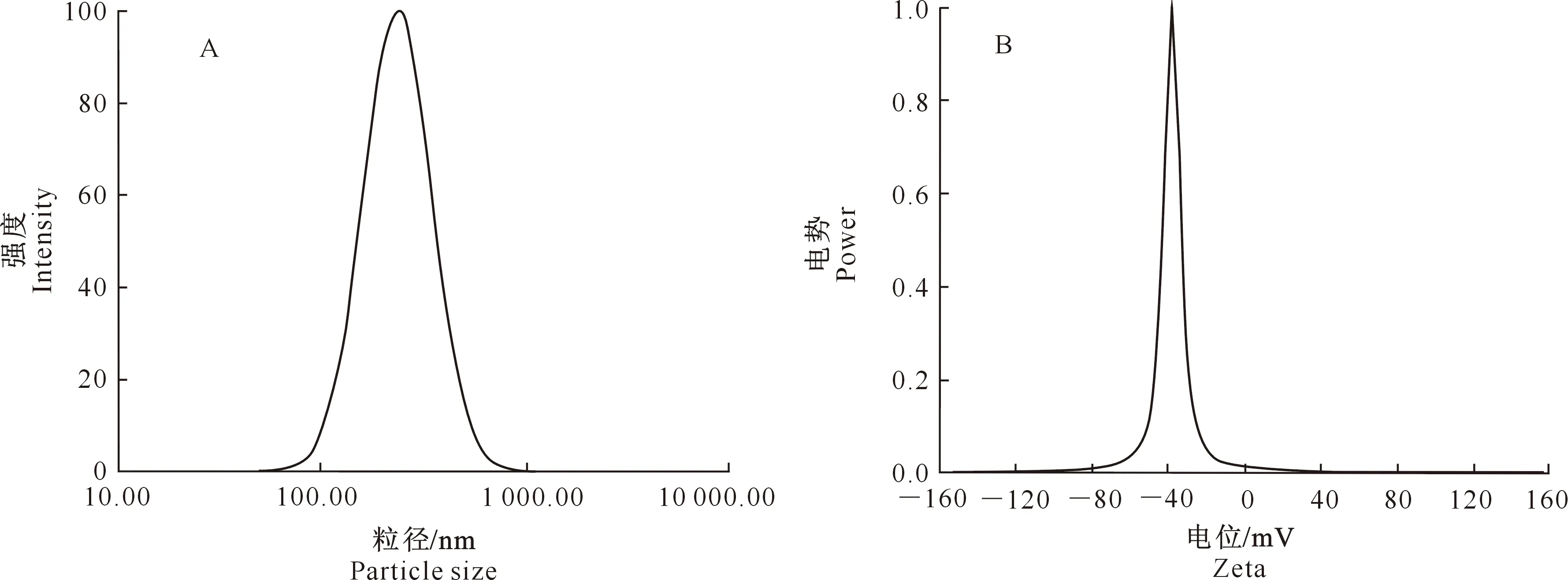
图3 花青素脂质体的粒径(A)和电位(B)Fig.3 Particle size (A) and Zeta (B) of anthocyanin liposomes
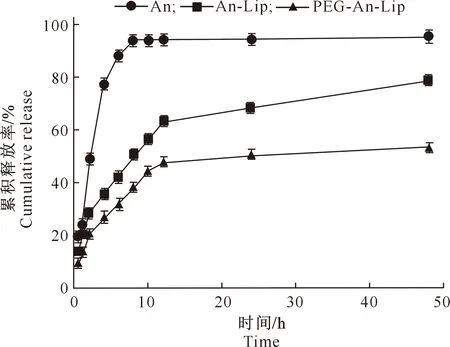
图4 花青素脂质体的体外释放曲线Fig.4 In vitro release curve of anthocyanin liposomes
2.4 花青素脂质体的FT-IR光谱
FT-IR扫描结果(图5)表明,样品的特征吸收覆盖了4 000~450 cm-1整个区域。FT-IR光谱中,An谱线在3 650~3 200 cm-1处是氢键缔合的-OH伸缩振动吸收峰与C-H的伸缩振动吸收峰,在1 596.60 cm-1处是苯环的伸缩振动吸收峰。B-Lip谱线在3 447 cm-1处为-OH的伸缩振动峰,在1 735.95 cm-1处为C=O的吸收振动峰,在1 176.95 cm-1和969.61 cm-1处是大豆卵磷脂的对称和非对称拉伸振动峰。An-Lip的光谱与B-Lip相似,这可能是由于An能很好地包裹在脂质体的水核中,故不存在An的特征吸收峰,表明脂质体的包覆方式为物理包覆。PEG-An-Lip谱线在2 853.11 cm-1处的吸收峰为PEG的C-H伸缩振动引起的;在1 735.95 cm-1和1 176.95 cm-1处的吸收峰分别由C=O和C-O-C的拉伸振动形成。FT-IR的分析结果进一步证实花青素包覆成功。
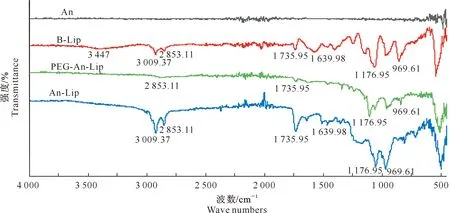
图5 花青素脂质体的红外光谱图Fig.5 Infrared spectra of anthocyanin liposomes
2.5 花青素脂质体的稳定性
2.5.1 pH稳定性 由图6可知,在酸性(pH为1~5)条件下,B-Lip、An-Lip和PEG-An-Lip的Zeta电位大幅度下降,极不稳定;在pH为7时,其Zeta电位绝对值增大,分别为32.13,30.56和34.34 mV;PEG-An-Lip的Zeta电位较An-Lip大。An-Lip的粒径在pH为5.0~7.0时比较稳定,在pH为1.0时增大为500.33 nm,这种现象归因于脂质体在酸性介质中溶胀能力较强,导致囊泡增大[18];PEG-An-Lip粒径在pH≤5.0时明显增大;PEG-An-Lip的粒径较An-Lip大,这是由于PEG静电吸引导致脂质体形成更松散的层状结构,导致颗粒尺寸增大[19]。一般而言,PDI<0.3说明体系分散均匀。由图6可知,在pH 1.0~9.0条件下,B-Lip、An-Lip、PEG-An-Lip的PDI均小于0.3,说明pH对PDI影响较小。可知B-Lip、An-Lip和PEG-An-Lip在低pH下稳定性相对较差,在pH 7的条件下较稳定。
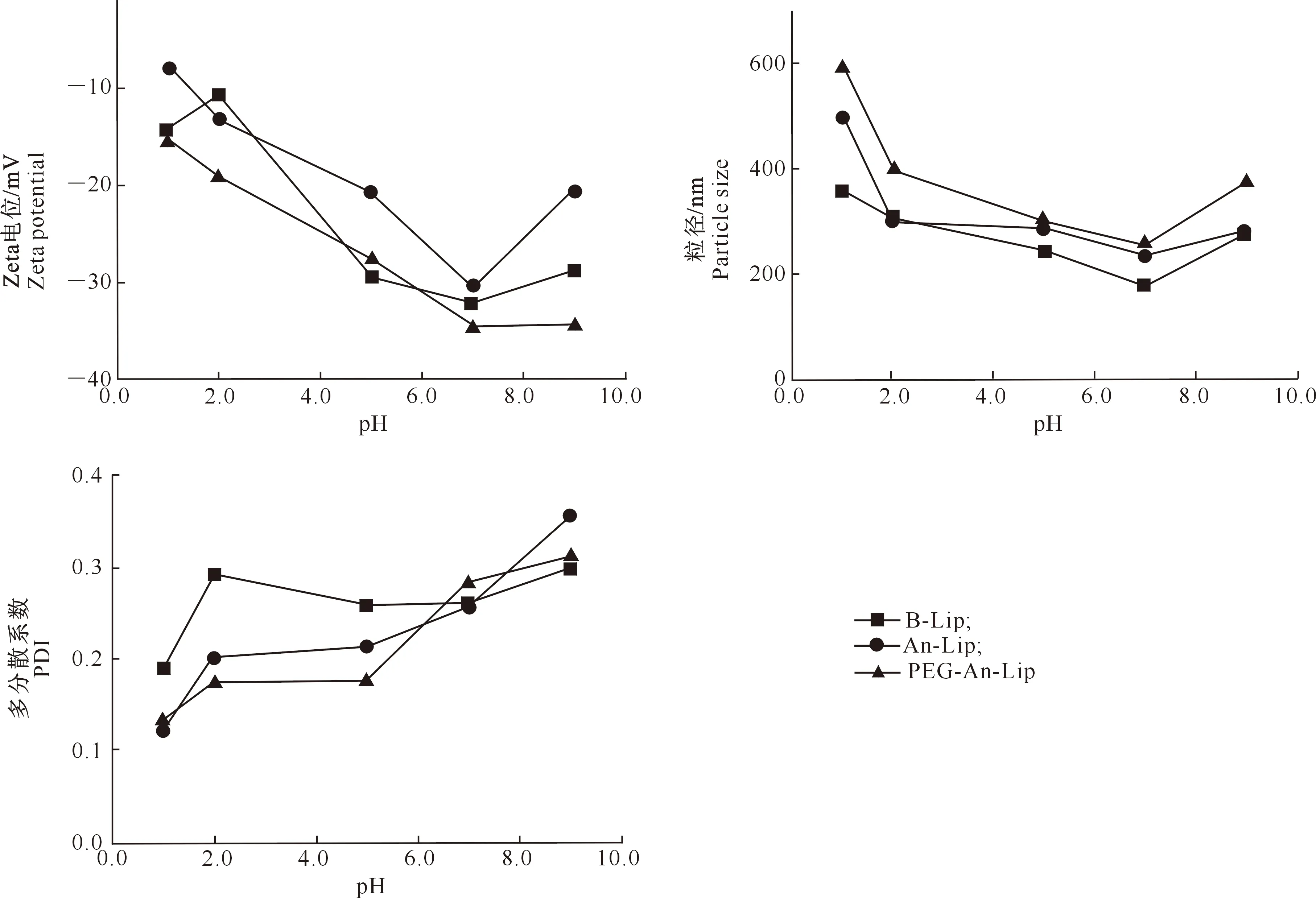
图6 花青素脂质体的pH稳定性Fig.6 PH stability of anthocyanin liposomes
2.5.2 热稳定性 由图7可知,随着水浴时间的延长,An、An-Lip、PEG-An-Lip的花青素保留率均逐渐降低,至水浴60 min时其花青素的保留率分别为79.01%,85.33%和93.79%,表明PEG修饰明显提高了An的保留率,改善了其热稳定性。
2.5.3 UV稳定性 由图8可知,随着UV照射时间的延长,An、An-Lip、PEG-An-Lip的花青素保留率均逐渐降低,至180 min时其花青素的保留率分别为79.01%,88.01%和93.79%,表明PEG修饰改善了An的UV稳定性。
3 讨 论
近年来,利用脂质体包封技术提高黄酮类化合物的稳定性及活性成为科研人员研究的热点[20],很多研究采用普通的薄膜分散法制备花青素脂质体[21-22],这种方法需先将花青素溶解在pH为7.4的PBS缓冲溶液中,而在此条件下花青素的稳定性很差,包封率也不理想。由于花青素极易溶于水,因此本试验用逆向蒸发法制备花青素脂质体,将花青素溶于pH为2的酸水中,使有机相与水相结合,形成稳定的乳剂。采用响应面法优化An-Lip的制备工艺,测得An-Lip的平均包封率为82.16%,符合预期效果。本研究发现,乳剂的形成是逆向蒸发法制备脂质体的关键步骤之一,若有机相比例过低,则很难形成稳定的W/O体系,包封率较低;若有机相比例过高,则需要较长时间超声才可形成W/O体系,而超声时间过长势必会破坏脂质体,影响脂质体的包封率和粒径。本试验中,当有机相与水相的体积比为4∶1时,An-Lip的包封率较高,但所制备的脂质体粒径较大,因此用逆向蒸发法制备An-Lip混悬液后,再用超声细胞粉碎仪超声30 min,可使粒径减小,颗粒分散均匀,能一定程度提高包封率。一般来说,脂质体的粒径<500 nm,可用于细胞输送,具有较高的透膜性[23];PDI在0~0.3,表明粒子分散均匀[24];Zeta电位绝对值大于30 mV,表明脂质体具有较好的稳定性[25]。本试验测得的An-Lip粒径为221.52 nm,PDI为0.230,Zeta电位为-31.05 mV,可见试验所制备的脂质体符合预期要求。
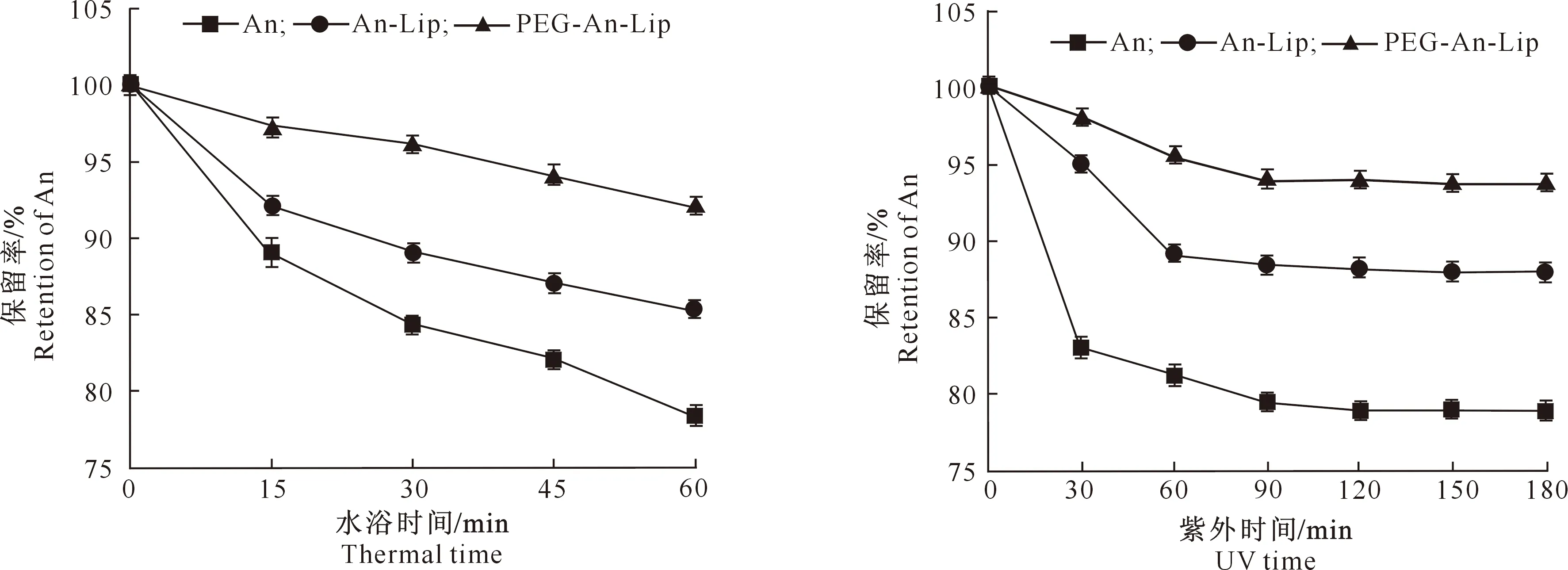
图7 花青素脂质体的热稳定性Fig.7 Heating stability of anthocyanin liposomes
脂质体容易发生融合、聚集和氧化,使药物泄露,进而使稳定性降低。用聚乙二醇修饰不仅可以提高脂质体的稳定性,还可延长缓释时间,避免因药物过量释放所引起的剂量依赖细胞毒性[26]。Firozian等[27]研究表明,PEG修饰的N-乙酰半胱氨酸的稳定性较N-乙酰半胱氨酸增强。本试验发现,经PEG修饰后花青素脂质体的稳定性得以提高。
综上,本试验采用响应面法优化An-Lip的制备工艺,在此基础上加入PEG对花青素脂质体进行修饰,提高了其稳定性。经PEG修饰后的An-Lip能明显延缓花青素的释放,提高其pH、UV和热稳定性,能更好地保护花青素免受降解和损失。说明PEG修饰是一种较好的保护花青素免受理化损伤的方法,在花青素类功能性食品的开发和应用等方面具有应用潜力。
