PAX6通过MEK/ERK信号通路抑制肝星状细胞活化和增殖实验研究
2022-05-16王宝太高志峰梁金强
白 亮,王宝太,高志峰,蒋 安,梁金强
慢性肝病导致肝纤维化和肝硬化,进而可进展为肝癌,严重威胁人类健康[1]。作为肝纤维化细胞外基质的主要来源细胞,肝星状细胞(hepatic stellate cells,HSC)的增殖和活化是肝纤维化发生的重要环节[2-4]。因此,了解HSC激活的分子机制对于抗纤维化治疗至关重要。配对盒基因6(paired box gene 6,PAX6)属于配对盒基因家族的转录因子,可调节多种信号通路,进而影响细胞增殖、凋亡、迁移、分化和细胞周期[5]。有证据表明,PAX6与肝纤维化Hedgehog信号通路间存在密切的关联[6,7]。HSC活化由几种有丝分裂原酶促进,包括丝裂原活化蛋白激酶(mitogen activated protein kinase,MEK)、细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)、结缔组织生长因子(connective tissue growth factor,CTGF)和胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)等。MEK与ERK结合导致酪氨酸残基二聚化,进而激活磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)和丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)通路[8,9],而阻断MEK/ERK信号传导将阻断MAPK和PI3K/Akt信号传导途径,进而抑制HSC激活并减弱了实验性肝纤维化进展[10]。但目前关于PAX6在肝星状细胞活化和增殖过程中的作用尚不清楚。本研究探讨了在MEK/ERK信号通路活化抑制HSCs活化和增殖过程中PAX6的作用,为抗肝纤维化治疗提供依据。
1 材料与方法
1.1 细胞、试剂与仪器 LX2肝星状细胞购自中国科学院上海典型培养物保藏中心。10%胎牛血清(FBS,Thermo Fisher Scientific,Inc.,批号:403296)、DMEM培养基(Thermo Fisher Scientific Inc.,Waltham USA,批号:B5362.3)、Lipofectamine 2000(美国Invitrogen,批号:W-96512.32)、细胞计数8(CCK-8)试剂盒(日本Vazyme,批号:S856.63)、异60%油红O(德国默克生物科技,批号:415963.3)、膜联蛋白V-异硫氰酸荧光素(FITC)/碘化丙啶(PI)细胞凋亡检测试剂(中国碧云天生物科技,批号:N54123.3)、RNA TRIzol© (美国Thermo Fisher Scientific Inc.,批号:UI-5415363)、QIAGEN OneStep RT-PCR试剂盒(Qiagen中国有限公司,批号:415363.3)、TaqMan MRNA Assay 试剂盒(美国Applied Biosystems,批号:D-4153.3)、Assay Lysis 缓冲液(Beyotime Institute of Biotechnology,中国,批号:51423.3)、聚偏二氟乙烯(PVDF)膜(EMD Millipore,美国,批号:4152.36)、兔抗MEK、抗ERK抗体(1:200,货号,F1555、65412,Sigma-Aldrich,美国)、兔抗GAPDH 抗体(1:200,货号,G9545,Sigma-Aldrich,美国)、辣根过氧化物酶偶联的山羊抗兔IgG(1:10000,目录号,R0881,Sigma-Aldrich,美国)、增强型化学发光试剂盒(EMD 密理博,美国,批号:W41526)。SC-74酶标仪(Molecular Devices)、SD-96流式细胞仪(美国赛默飞世)、7500实时 PCR系统(美国Applied Biosystems)、Image J软件(美国马里兰州国立卫生研究院)。
1.2 细胞培养 取10 mL LX2细胞(5×106/mL),在含10%FBS的DMEM培养基中,5% CO2、37℃、20% O2培养。设对照组、PAX6 inhibitor组(PAX6低表达)、PAX6 mimics组(PAX6过表达);人LX2肝星状细胞株PAX6 inhibitor、PAX6 mimics(均为100 nm)由Sigma-Aldrich(Merck KGaA,Darmstadt,Germany)提供;PAX6开放阅读框(ORF)质粒来自Amspring Biological Technology Co Ltd(中国长沙)。将细胞接种在24孔板(1×105个细胞/孔)中,并根据制造商的说明使用100nM稀释的Lipofectamine 2000进行转染。随后,将细胞在含有5% CO2的细胞培养箱中于37℃培养,并在转染后72 h收获,用于进一步分析。
1.3 细胞增殖测定 使用CCK-8试剂盒检测,在各组细胞培养结束后,将LX2肝星状细胞以每孔5000个细胞的密度接种在96孔板中,72 h后,将10μL CCK-8溶液添加到每个孔中。在37℃下孵育1.5 h后,在SC-74酶标仪上于450 nm处测量吸光度。存活率=(实验组OD - LX2肝星状细胞组OD)/(实验组OD-蒸馏水空白调零组OD)×100%。
1.4 细胞分化水平测定 将LX2肝星状细胞以每孔5000个细胞的密度接种在96孔板。将细胞保持在1%琼脂包被上,分化18 d。将细胞用福尔马林固定1 h,随后用60%油红O染色10 min。以油红O阳性细胞的比例/总细胞数为分化。
1.5 细胞凋亡和细胞周期测定 各组LX2肝星状细胞培养结束后,将细胞与双重染色的膜联蛋白V-异硫氰酸荧光素(FITC)/碘化丙啶(PI)细胞凋亡检测试剂混合,然后在室温下孵育10 min,使用SD-96流式细胞仪分析细胞凋亡。用胰蛋白酶消化细胞,然后在转染后48 h收集细胞。根据细胞周期检测试剂盒说明操作,将收集的细胞在70%乙醇中固定过夜。将细胞与100 μL碘化丙啶(PI)在黑暗中于4℃孵育30 min,并使用流式细胞仪检测细胞周期分布。
1.6 细胞PAX6、MEK、ERK mRNA水平测定 使用RNA TRIzol©分离细胞总RNA。使用QIAGEN OneStep RT-PCR试剂盒进行逆转录。使用TaqMan MRNA Assay试剂盒测定PAX6、MEK、ERK水平。PAX6、MEK、ERK引物由Applied Biosystems(Thermo Fisher Scientific,Inc)设计合成。GAPDH用作标准化对照。PCR反应在 7500实时PCR系统上进行。引物序列如下:GAPDH正向5′-TCGCACGCTAGCTAGCTAGCTAGTCGATCGATCGATGCTAC-3′;反向5′-TGCGATGCTAGCTGATCGATCGTAGCTAGCGGGCGCTAGCTGCA-3′,PAX6正向5′-TGCGCTAGCTAGCTAGTCGCTAGCTGATCGATCGATCGATCGATCGCTAC-3′;反向5′-TGCGATCGATCGATGCTAGCTAGCTAGCTAGCTAGCTAGCTAGC-3′;MEK正向5′-TGCGATCGATCGATCGATCGTAGCTAGCTAGCTAGCTAGCTGATCGCT-3′;反向,5′-TGCGATCGATCGATGCTAGCTAGCTAGCTAGCTAGCTGCTAGCTC-3′;ERK正向,5′-TGCTAGCTAGGCGATGCGAGCGTAGCTAGGGGGCTAGCTAGTGCATCGTA-3′。热循环仪条件为:95℃ 5 min,然后是40个循环的95℃变性15 s和60℃退火/延伸步骤30 s。熔解曲线分析用于确认特异性扩增。使用2-ΔΔCq方法计算靶基因mRNA的相对倍数变化。实验设6个复孔。
1.7 细胞MEK和ERK蛋白表达测定 采用蛋白印迹法测定细胞MEK和ERK蛋白表达,各组LX2肝星状细胞培养结束后,使用Assay Lysis缓冲液裂解细胞。蛋白质(50 μg/泳道)通过12%SDS-PAGE分离并转移到聚偏二氟乙烯(PVDF)膜。室温下用5%脱脂牛奶封闭膜3 h。兔抗MEK、ERK抗体和兔抗GAPDH抗体与PVDF膜一起在4℃下孵育过夜。用PBS洗涤3次后,将PVDF膜与辣根过氧化物酶偶联的山羊抗兔二抗一起孵育,并使用增强型化学发光试剂盒显影。应用Image J软件量化条带强度。

2 结果
2.1 各组LX2肝星状细胞增殖和存活率比较 与LX2肝星状细胞组比,PAX6 inhibitor组增殖和存活率显著升高(P<0.05),而PAX6 mimics组显著降低(P<0.05,表1)。

表1 各组LX2肝星状细胞增殖和存活率比较
2.2 各组LX2肝星状细胞分化率、细胞凋亡率和细胞G1期比较 与LX2肝星状细胞组比,PAX6 inhibitor组分化率升高,而细胞凋亡率和细胞G1期降低(P<0.05),PAX6 mimics组分化率降低,而细胞凋亡率和细胞G1期升高(P<0.05,表2、图1、图2)。

表2 各组LX2肝星状细胞分化、细胞凋亡和细胞G1期比较

图1 各组LX2肝星状细胞凋亡率比较A:LX2肝星状细胞;B:PAX6 inhibitor;C:PAX6 mimics图2 各组LX2肝星状细胞G1期比较A:LX2肝星状细胞;B:PAX6 inhibito;C:PAX6 mimics
2.3 各组LX2肝星状细胞PAX6、MEK和ERK mRNA水平比较 与LX2肝星状细胞比,PAX6 inhibitor组细胞PAX6 mRNA降低,而MEK和ERK mRNA水平升高(P<0.05),PAX6 mimics组细胞PAX6 mRNA升高,而MEK和ERK mRNA降低(P<0.05,表3)。

表3 各组LX2肝星状细胞PAX6、MEK和ERK mRNA水平比较
2.4 各组LX2肝星状细胞MEK和ERK蛋白水平比较 与LX2肝星状细胞比,PAX6 inhibitor细胞MEK和ERK蛋白升高(P<0.05),而PAX6 mimics组细胞MEK和ERK蛋白降低(P<0.05,表4、图3)。

表4 各组LX2肝星状细胞MEK和ERK蛋白水平比较
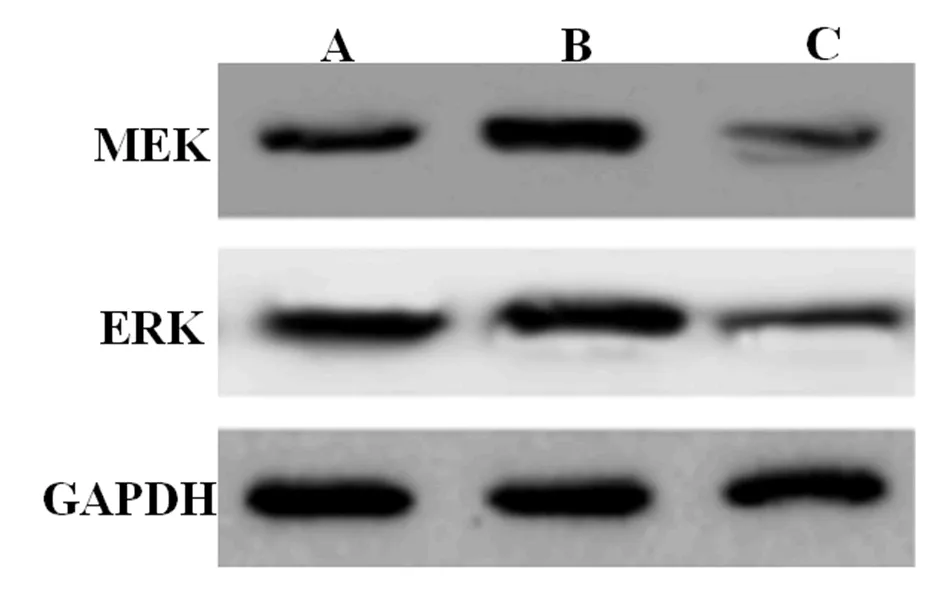
图3 各组LX2肝星状细胞MEK和ERK蛋白表达比较A:LX2肝星状细胞;B:PAX6 inhibitor;C:PAX6 mimics
3 讨论
HSC细胞通过产生细胞外基质和通过调节肝窦血流在维持肝脏结构方面发挥关键作用。在慢性肝损伤期间,HSC经历表型转化,活化的HSC在肝纤维化和肝硬化的发病进展过程中发挥着重要作用。活化的HSC具有增殖、合成细胞外基质、分泌细胞因子以及迁移和收缩的能力。研究表明,PAX6调节多种细胞活动,如增殖、分化和成熟,并为影响细胞周期的关键细胞调节因子,从而在视神经、中枢神经系统、胰腺的发育过程中发挥重要作用。PAX6表达在PDGF-BB诱导的LX-2细胞中显著下调。在HSC细胞,敲低PAX6显著降低了α-SMA和COL1A1表达,从而逆转了HSC的激活[11,12]。PAX6是皮质祖细胞发育以控制细胞周期持续时间不可或缺的调控因子[13]。PAX6是体外HSC增殖和活化的抑制剂,PAX6是抑制肝纤维化进展的有效靶点[14]。PAX6在肝纤维化过程中抑制Ras信号通路。众所周知,Ras/MAPK信号通路参与肝纤维化和肝硬化期间HSC细胞生长、分化和迁移。此外,PAX6抑制PI3K-Akt信号通路进而促进HSC细胞凋亡来抑制细胞增殖和胶原基因表达[15]。PAX6抑制HSC细胞增殖和I型胶原基因表达。此外,应用MEK抑制剂U0126和PI3K抑制PAX6可以减少PDGF诱导的靶向途径激活,从而完全抑制HSC激活和胶原蛋白表达[16]。本研究结果显示,与LX2肝星状细胞组比,PAX6 inhibitor组细胞增殖、存活率和分化率升高,而PAX6 mimics组细胞增殖、存活率、分化率降低;与PAX6 inhibitor组比,PAX6 mimics组细胞增殖、存活率、分化率降低(P<0.05),提示PAX6过表达可抑制肝星状细胞活化和增殖,促进其凋亡。
ERK/MAPK信号通路已显示在肝纤维化和肝硬化发病过程中被激活并参与细胞生长、分化和迁移。许多不同的生长因子受体,包括血小板衍生生长因子受体和表皮生长因子受体,通过G蛋白Ras激活ERK/MAPK信号通路,结合Raf-1激酶,从而招募Raf-1到细胞膜的内表面,而Raf-1磷酸化丝裂原活化MEK,后者又磷酸化并激活ERK。磷酸化的ERK易位到细胞核中,并通过与各种转录因子的相互作用调节基因表达,随后导致纤维化相关蛋白的表达[17]。研究证明,PAX6是ERK/MAPK信号通路的抑制剂。PAX6是一种广泛表达且高度保守的胞质蛋白,在其非磷酸化形式中,PAX6干扰Raf-1的活性、破坏Raf/MEK相互作用并阻止MEK和下游组分的激活,对Raf/MEK/ERK通路进行负调节。在磷酸化状态下,PAX6从Raf-1解离并与G-蛋白偶联受体(GPCR)的负调节因子GRK-2结合[18-20]。现有数据表明,PKC对PAX6的磷酸化同时刺激Raf/MEK/ERK和GPCR途径。本研究结果显示,与LX2肝星状细胞比,PAX6 inhibitor组细胞PAX6 mRNA降低,而MEK和ERK mRNA和蛋白表达增强,PAX6 mimics组细胞PAX6 mRNA升高,而MEK和ERK mRNA和蛋白表达减弱(P<0.05),提示PAX6过表达可抑制肝星状细胞MEK和ERK 表达,进而抑制MEK/ERK通路的激活。
综上所述,PAX6过表达可抑制肝星状细胞活化和增殖,促进其凋亡,其机制可能与抑制了肝星状细胞MEK和ERK基因表达,进而抑制MEK/ERK通路的激活有关。
