用二次PCR方法检测鸟类禽流感的初探
2022-05-16朱功良婧彭金山郑和松杨国祥
陈 光 李 勇 朱功良 张 俊 冯 伟 陈 婧彭金山 郑和松 杨国祥*
(1.湖北省野生动物救护研究开发中心,武汉,430075;2.湖北龙感湖国家级自然保护区管理局,黄冈,435500;3.黄石市网湖湿地自然保护区管理局,黄石,435200)
疫病不仅影响野生动物的个体健康,严重时还可威胁野生动物种群安全。野生动物疫病的应急检测和日常监测是野生动物疫源疫病应急防控和预警预报的重要和基础性工作,也是生物安全防御关口前移的关键。
疫病检测结果直接影响野生动物异常事件的应急处置,而在野生动物异常情况出现的早期能够进行快速鉴定诊断则是预防疫病传播及防止疫情扩散的关键。由于受到实验室条件、人员技术能力等的限制,国内野生动物样品检测几乎全部依托科研院校,导致检测结果获取和运用的时效性、即时性受到一定影响。
自1955年以来,禽流感(avian influenza,AI)在禽类中呈不同规模的流行[1],已导致不计其数的家禽、野禽死亡[2-13],造成了重大的经济损失。禽流感病毒(Avian influenza virus,AIV)宿主广泛,可感染家禽、野禽及多种哺乳动物[1],给野生动物,尤其是鸟类的种群和生态安全带来了巨大威胁。同时,禽流感病毒跨宿主传播事件频发,如2009年甲型H1N1流感[14]、2013年人感染H7N9禽流感[15],给公共卫生安全带来了严峻挑战。
多年来,鸟类禽流感一直是野生动物疫源疫病监测的主要对象之一。实验室一般将采集的野生动物粪便、拭子等样品通过SPF鸡胚扩增病毒、逆转录PCR(reverse transcription PCR,RT-PCR),或直接使用实时荧光定量PCR(real-time quantitative PCR,qPCR)来检测禽流感病毒。我国现有监测站大都依托当地自然保护区、鸟类环志或森林有害生物防治部门,未建立专门的监测预警机构,也缺乏专业技术人员[16],同时,普遍缺少相应级别的生物安全实验室、qPCR仪等病原分离鉴定的条件和技术。与病毒分离及qPCR相比,二次PCR方法无须高级别生物安全实验室或实验设备,另外,由于鸟类样品获取困难、病毒含量低微,对检测方法的敏感性要求较高。与一次PCR相比,二次PCR阳性检出率明显高于一次PCR[17-19],因此,二次PCR方法符合我国野生动物疫源疫病监测实际。本研究针对采集的鸟类拭子样品,不经过病毒扩增,使用二次PCR检测,建立禽流感病毒直接鉴定方法,为野生动物异常情况处置提供快速、即时和敏感的技术支持。
1 样品简介
2020年11—12月,在湖北省长江沿线2个湖区进行野生动物异常情况调查时,采集鸟类及周边散居禽类咽拭样品21份。经中科院武汉病毒所流感病毒学科组和东北林业大学野生动物与自然保护地学院的qPCR鉴定,有12份样品的流感病毒核酸呈阳性,9份呈阴性(使用引物或探针不做区分),咽拭未经过SPF鸡胚扩增病毒。采用的样品为21份咽拭样品的备份样,为便于描述,将21份咽拭样品分别编号为1~21,其中,样品1~4、6~10、16~18的流感病毒核酸呈阳性(18为弱阳性),5、11~15、19~21呈阴性。
2 研究方法
2.1 cDNA制备
根据柱式病毒RNA抽提纯化试剂盒(购自上海生工,以下简称生工试剂盒)说明书将拭子进行前处理及RNA提取,最后加入40 μL DEPC-treated ddH2O,得到RNA产物溶液。取10 μL RNA产物溶液,加入反转录引物U12(5′-AGCAAAAGCAGG-3′)2 μL,将混合液70 ℃水浴5 min后,冰浴5 min以上。
配制反转录体系,将13 μL体系加入混合液后,42 ℃水浴1 h,之后95 ℃水浴5 min。反转录总体系为13.0 μL,其中DEPC水2.0 μL,5×Buffer 5.0 μL,dNTPs(2 mmol/L)5.0 μL,M-MLV 0.5 μL,RNA酶抑制剂0.5 μL。
2.2 一次RT-PCR
以制备的cDNA为模板,使用名称为NP、M、HA的3对引物(由东北林业大学野生动物与自然保护地学院提供),分别扩增病毒NP、M、HA基因部分片段,根据PremixTaqTM(plus dye)(购自北京TakaRa)说明书的PCR反应体系及条件,配制25 μL体系进行PCR。
取5 μL PCR产物进行1%琼脂糖凝胶电泳,紫外光下观察结果,若出现目的条带,判定为阳性,反之为阴性。
2.3 二次PCR
以一次RT-PCR扩增产物为模板,使用对应引物及利用相关扩增条件,再次进行PCR及琼脂糖凝胶电泳,若出现目的条带,判定阳性,反之阴性。
2.4 测序
选取一次RT-PCR、二次PCR均出现目的条带的样品,送至华大科技(武汉)单向测序,对获得的序列进行BLAST比对,使用Megalign分析序列间核苷酸同源性。
为测试二次PCR方法的稳定性,了解不同核酸提取试剂盒的效率,将生工试剂盒更换为病毒RNA提取试剂盒(离心柱型)(购自北京天根,以下简称天根试剂盒),在RNA溶解时根据说明书加入60 μL RNase-Free ddH2O,得到的cDNA溶液重复后续步骤,对所有拭子重复鉴定,观察结果。
3 结果与分析
3.1 一次RT-PCR鉴定结果
NP、M、HA扩增的目的片段长度分别为329、1 080、640 bp。鉴定发现,12份预期阳性样品仅有个别样品(1、2、16)出现明显目的条带,部分样品(6~9、17)偶尔出现极弱目的条带(图1)。

图1 一次RT-PCR扩增结果Fig.1 Amplification results of the primary RT-PCR 注:M.DL2000 DNA Marker.1~21分别为样品1~21的一次RT-PCR扩增结果,其中,1~4、6~10、16~18为预期阳性样品;5、11~15、19~21为预期阴性样品;22~24分别为核酸提取阴性对照、RT-PCR阳性对照和RT-PCR阴性对照 Note:M,DL2000 DNA Marker.1-21 are the primary RT-PCR amplification results of sample 1-21.1-4,6-10 and 16-18 are expected positive samples,while 5,11-15 and 19-21 are expected negative.22-24 are negative control of nucleic acid extraction,positive control of RT-PCR,and negative control of RT-PCR,respectively
3.2 二次PCR鉴定结果
为便于观察,将图2二次PCR鉴定结果转换为表1色块模式。由图2和表1可知:14份样品(1、2、5、7、9、11~17、20、21)的6次结果均一致,与qPCR结果相符;4份样品(3、4、6、8)至少2对引物、不少于4次结果重复为阳性,可判定为阳性,与qPCR结果相符;1份样品(18)使用1对引物(NP),经2次试验(核酸提取试剂盒不同)结果均为阳性,与qPCR结果相符,可能由引物特异性差异引起;2份样品(10、19)使用生工试剂盒,结果与qPCR结果不符;但使用天根试剂盒,1对引物(10NP-2、19NP-2)鉴定结果与qPCR结果相符。
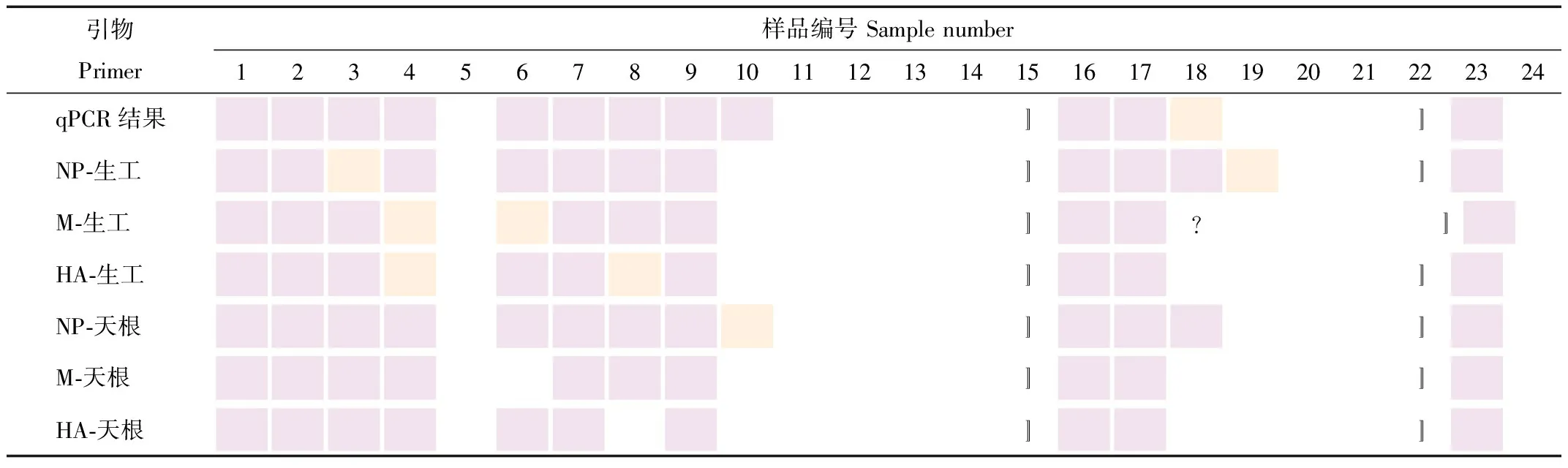
表1 二次PCR扩增结果(色块模式)

图2 二次PCR扩增结果Fig.2 Amplification results of the secondary PCR 注:M.DL2000 DAN Marker.1~21分别为样品1~21的二次RT-PCR扩增结果,其中,1~4、6~10、16~18为预期阳性样品;5、11~15、19~21为预期阴性样品;22~24分别为核酸提取阴性对照、RT-PCR阳性对照和RT-PCR阴性对照 Note:M,DL2000 DNA Marker.1-21 are the secondary RT-PCR amplification results of sample 1-21.1-4、6-10 and 16-18 are expected positive samples,while 5、11-15 and 19-21 are expected negative.22-24 are negative control of nucleic acid extraction,positive control of RT-PCR,and negative control of RT-PCR,respectively
RT-PCR方法灵敏度远低于qPCR,不考虑引物特异性,如1对引物出现阳性,暂判定为阳性。基于此,使用天根试剂盒的21份样品鉴定结果与qPCR结果符合率为100%(21/21),使用生工试剂盒,样品10、19鉴定结果与预期不符,符合率为90.48%(19/21)。
3.3 测序结果
单向测序得到6条NP基因部分片段序列,编号分别为016-1、16-1、02-2、016-2、2-2、16-2(一次RT-PCR产物编号为“01~021”,二次PCR产物编号为“1~21”,后缀“-1”表示样品RNA使用生工试剂盒提取,后缀“-2”表示使用天根试剂盒提取,下同),长度276~284 bp,经BLAST比对,6条序列均为禽流感病毒内部基因NP片段,与它们同源性最高(96.38%~97.40%)的毒株均为A/duck/Egypt/N13736E/2017(H5N8)。样品2的2条(02-2、2-2)序列同源性为97.8%(图3),样品16的4条序列(016-1、016-2、16-1、16-2)的同源性为96.4%~98.9%(图3)。

图3 NP基因部分片段序列同源性Fig.3 Sequence homologies of part NP gene fragments
单向测序得到15条M基因部分片段,编号分别为01-1、02-1、07-1、09-1、016-1、02-2、016-2、1-1、2-1、7-1、9-1、16-1、2-2、16-2和17-2,长度854~992 bp,经BLAST比对,15条序列均为禽流感病毒内部基因M片段,与其中13条序列同源性最高(98.05%~98.92%)的毒株为A/goose/Xinjiang/8.23_WLMQXL003-O/2017(mixed),与其他2条(02-2、16-2)同源性最高(98.75%、98.34%)的毒株为A/goose/Xinjiang/12.18_WLMQXL 004-C/2016(H5N8)。
由图4可知,样品1、7、9的2条M序列的同源性分别为99.3%、98.5%、99.6%,样品2和样品16的4条M序列的同源性分别为99.3%~99.8%、99.0%~99.9%,可见二次PCR对内部基因M测序影响较小。
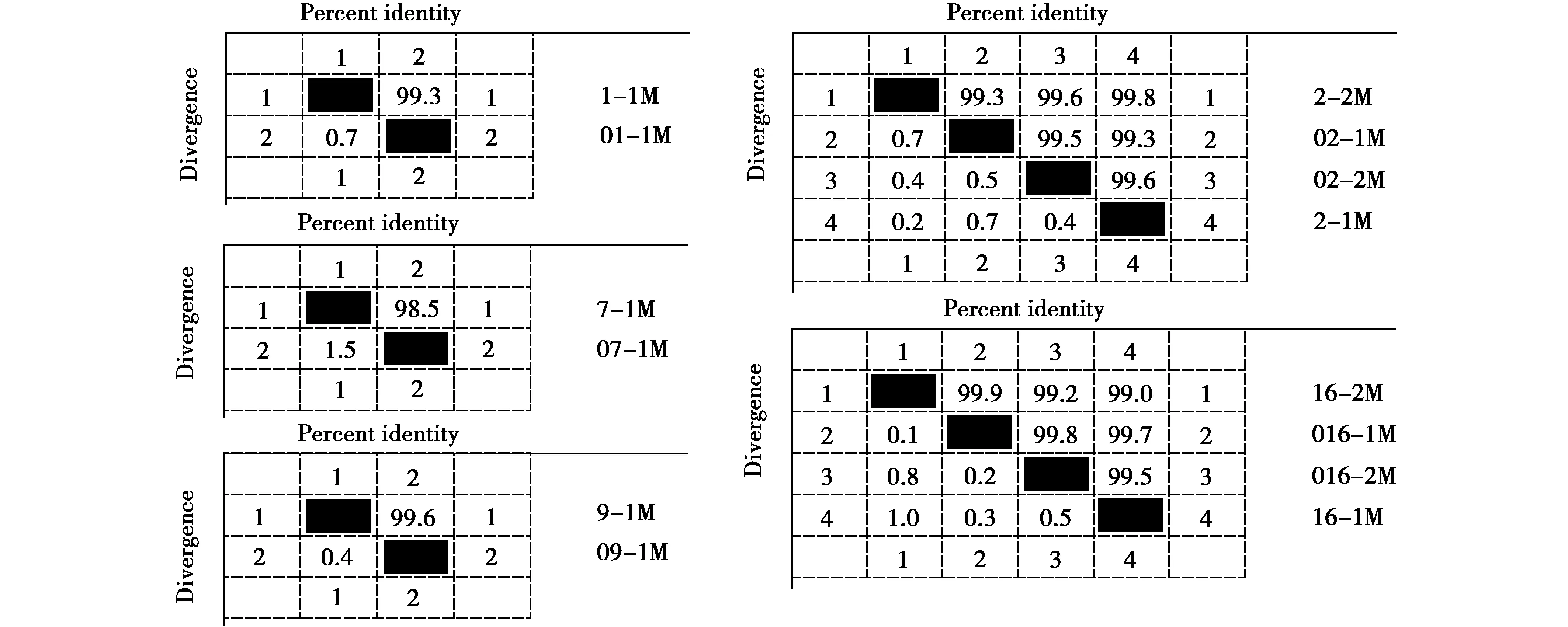
图4 M基因部分片段序列同源性Fig.4 Sequence homologies of part M gene fragments
单向测序得到13条HA基因部分片段,长度280~913 bp,与预期扩增片段长度差别较大,但经BLAST比对后,同源性最高的序列全部为禽流感病毒外部基因HA片段(表2)。
样品1、2、16的4条序列的同源性分别为95.7%~98.9%、79.8%~98.8%、95.0%~99.8%(图5)。同一份样品,由于使用的RNA提取试剂盒和PCR次数不同,同源性最高的序列与同源性产生了较大区别(表2、图5)。
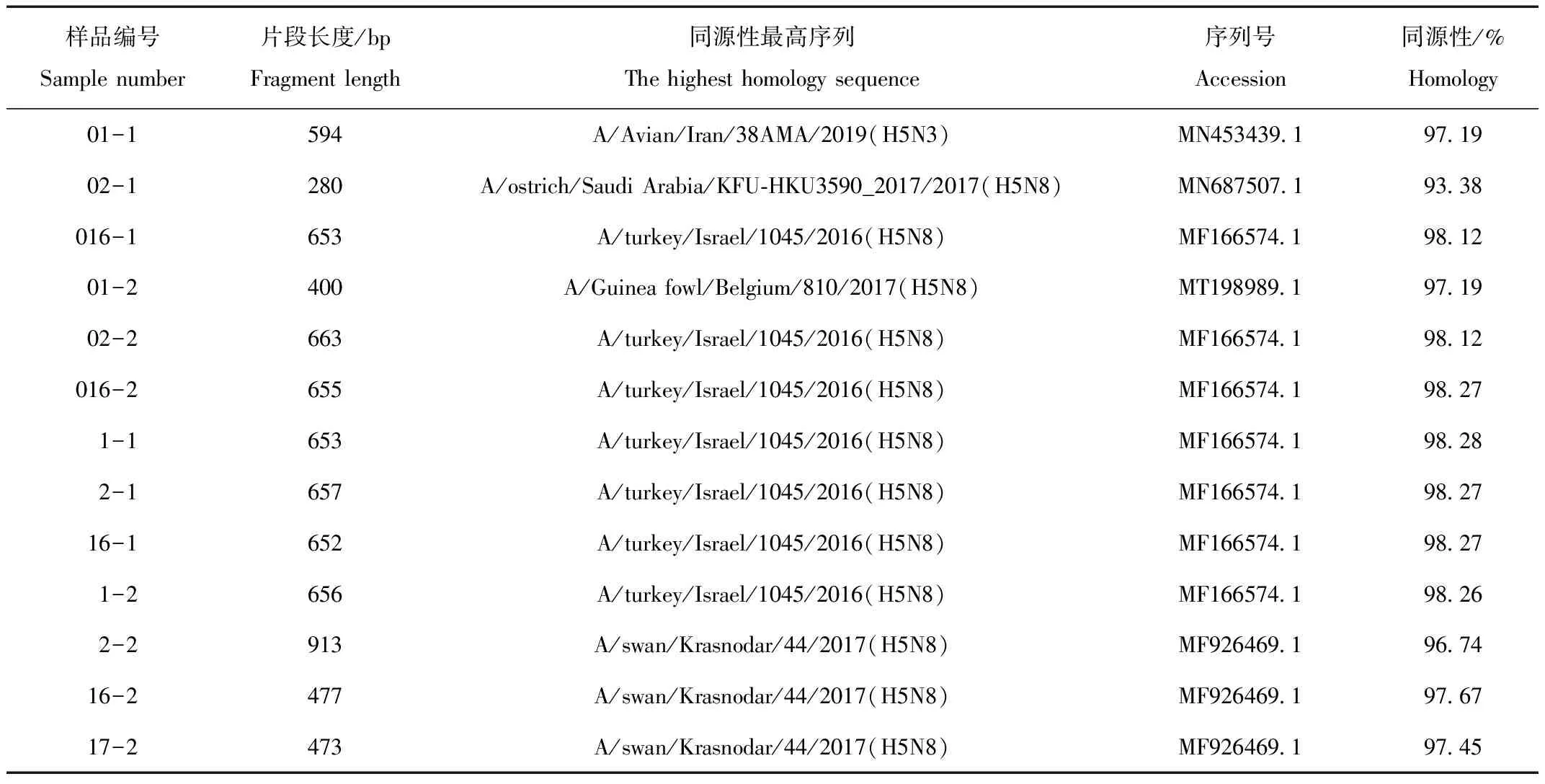
表2 HA基因BLAST比对结果

图5 HA基因部分片段序列同源性Fig.5 Sequence homologies of part HA gene fragments
4 分析与讨论
在各种病原鉴定方法中,常规病原分离鉴定和血清学鉴别方法虽较准确,但消耗时间长、对实验室生物安全级别要求高;qPCR方法灵敏度高、鉴定时间短,但设备昂贵,对操作人员的专业和实验技能要求高。本研究针对鸟类样品禽流感病毒核酸检测建立了二次PCR方法,即以一次RT-PCR扩增产物为模板进行二次PCR检测的方法。试验中,一次扩增未出现或疑似出现目的条带的样品,经二次扩增后部分样品仍可出现明显的目的条带,依据二次扩增出现目的条带情况判定最终结果。
试验证明,12份预期阳性样品经二次PCR后均可成功鉴定,而一次RT-PCR最多成功鉴定出8份(其中5份条带均较弱,具有偶然性),仅3份结果较为稳定,与二次PCR阳性判定结果(10~11份)差别较大,为提高检测的准确度,应进行二次PCR扩增。二次PCR与qPCR检测结果比较,符合率为90.48%~100.00%,可以认为二者在特异性和敏感性上并无明显差异。因此,采用二次PCR方法进行鸟类禽流感疫情应急检测,可以较好地满足对检测方法特异性和敏感性的要求,同时,能避免因实验室、仪器设备和人员配置等条件不足的限制,具有应用价值及可操作性。鉴于我国野生动物疫病检测实际情况,该方法的建立有助于在鸟类出现异常情况时和疫情应急处置中,初步、快速鉴定禽流感,为鸟类流感监测预警提供有效的技术支持,这对于提升我国野生动物疫源疫病的监测和防控能力具有重要的现实意义。
对HA引物扩增产物进行测序,可初步鉴定病毒HA亚型。测序情况表明,二次PCR方法对内部基因(M)测序结果影响较小,但对外部基因(HA)影响较大。本研究采用的样品均是在鸟类出现异常情况时采集的咽拭,样品带毒率较高,检测效果良好,可进一步将该方法用于主动监测中,探索在健康个体拭子、日常粪便或组织样品检测中的使用效果。
致谢:感谢东北林业大学野生动物与自然保护地学院提供技术支持,感谢中国科学院武汉病毒研究所流感病毒学科组陈全姣研究员团队提供样品检测报告。
