基于mtDNA D-loop区和Cyt b基因序列对鹅喉羚南疆亚种遗传多样性与系统进化地位的分析
2022-05-16张永浩韦庆浩郭丽君阿布都热合曼吐尔逊王玉涛
张永浩 韦庆浩 郭丽君 阿布都热合曼·吐尔逊 王玉涛
(喀什大学生命与地理科学学院,新疆帕米尔高原生物资源与生态重点实验室,喀什,844000)
鹅喉羚(Gazellasubgutturosa)又称长尾黄羊,属偶蹄目(Artiodactyla)反刍亚目(Ruminantia)牛科(Bovidae)羚羊亚科(Antilopinae)瞪羚属[1],雄性鹅喉羚在发情时期喉部会膨大(即甲状腺肿),形似鹅喉,因此称其为鹅喉羚。据报道[2],鹅喉羚有6个亚种,在新疆境内分布3种,近50年,由于人为因素(包括牧业的发展、过度捕猎和居民点扩充等)和自然灾害(全球气候变化、风雪严寒引起的食物短缺等)的影响,该物种的栖息环境越来越差,活动范围逐渐缩小,种群数量也迅速减少,面临更加严重的生存危机[3-5]。鹅喉羚已被列为国家二级重点保护野生动物,IUCN红色名录VU级(易危种)[6],《中国脊椎动物红色名录》易危物种(VU)[7]。
鹅喉羚多栖息于荒漠和半荒漠地区,以及沙土和黏土至盐滩及沙漠类型的区域。鹅喉羚全球分布广泛,从伊朗、阿拉伯半岛、中亚和阿富汗,向东拓展至中国的西北地区和蒙古境内的广大区域[8]。雌性鹅喉羚生角部位显著凸起,雄兽具角,角长22~30 cm[9]。我国学者[10-11]已对鹅喉羚进行了多方面的研究,如形态与分类学、栖息地的选择和觅食繁殖等,也有学者[12-13]将鹅喉羚的研究动态进行了整理,对其分类、地理分布、种群数量、生理、生化、细胞生物学、生态生物学和饲养繁殖与疾病防治进行了总结,探讨致危因素,提出保护对策,然而,从遗传多样性和系统发育地位为切入点,对鹅喉羚南疆亚种(G.s.yarkandensis)的保护制定合理措施的研究鲜有报道,本研究将弥补这一空缺。
线粒体DNA(mtDNA)是动物体内唯一的核外遗传物质,呈共价闭合环状,且为双链DNA,序列长15~20 kb,分子质量极小[14]。在哺乳纲(Mammalia)动物中,编码区和非编码区构成了完整的mtDNA结构,37个基因的编码序列呈线性排列在编码区,包括13个编码蛋白质的基因、22个编码tRNA的基因和2个编码rRNA的基因。mtDNA从雌性亲本个体传递给子代,过程中没有发生基因重组现象,后代中的某一个体可以代表其母系群体的遗传结构,能够保留祖先的特性并记录之前出现的进化事件,但是线粒体基因比核基因更容易受遗传漂变的影响[15]。基于mtDNA的以上特点,mtDNA分子标记技术在脊椎动物群体遗传学、分子遗传学和母系起源等领域的研究中得到普遍运用。随着分子生物学的飞速发展,人们对Cytb基因的结构了解越来越深入,它的相对分子质量约为427 000[3,16],密码子的第3位点进化最快,而第2位点最保守[17]。为明确鹅喉羚南疆亚种遗传多样性水平、遗传分化和系统进化地位,以鹅喉羚南疆亚种为研究对象,采用PCR和测序技术,研究mtDNA D-loop区和mtDNACytb基因的序列特征,下载GenBank中鹅喉羚基因序列,利用MEGA 6.06构建系统发育树和中介网络关系,以阐明鹅喉羚南疆亚种遗传多样性水平和系统地位,为鹅喉羚的相关研究提供基础数据,也为鹅喉羚南疆亚种遗传资源保护和利用提供理论依据。
1 材料与方法
1.1 试验材料
在叶城地区采集到鹅喉羚3份肌肉样本,在英吉沙县和莎车县分别采集到3份和8份耳部样本,共采集14份样本(分属于14只个体),均来自南疆地区,系野外死亡个体,将样本编号后冻存(-80 ℃)于新疆帕米尔高原生物资源与生态重点实验室。
1.2 试验方法
1.2.1 样本处理及DNA提取
取50~100 mg样本,用剪刀尽量剪碎,装于高压灭菌过的2 mL离心管中,加入800 μL STE抽提液,再加入蛋白酶K和十二烷基硫酸钠(SDS)充分混匀15 min,消化过夜后用常规酚-氯仿法提取总基因组DNA[18]。
1.2.2 PCR扩增
mtDNACytb基因上游引物为5′-GATATGAAAAACCATCGTTG-3′,下游引物为5′-CCTTCTCTGGTTTACAAGAC-3′[19]。反应总体系为50.5 μL,其中,上、下游引物各1.0 μL,2×TaqPCR Master Mix 30.0 μL,DNA模板2.5 μL,ddH2O 16.0 μL。反应程序为 94 ℃预变性5 min;94 ℃变性1 min,55.5 ℃退火1 min,72 ℃延伸1 min,35个循环;72 ℃终延伸10 min。mtDNA D-loop区上游引物为5′-CCACTATCAACACCCAAAGCTG-3′,下游引物为5′-GCATTTTCAGTGCCTTGCT-3′[20]。总反应体系为50.5 μL,其中,上、下游引物各1.0 μL,2×TaqPCR Master Mix 30.0 μL,DNA模板2.5 μL,ddH2O 16.0 μL。反应程序为 94 ℃预变性5 min;94 ℃变性1 min,61.5 ℃退火1 min,72 ℃延伸1 min,35个循环;72 ℃终延伸10 min。
1.2.3 PCR扩增产物凝胶电泳及送样测序
PCR扩增后的产物经2%琼脂糖凝胶电泳后,若目的条带清晰整齐,条带较亮,无杂带,且mtDNACytb基因片段长度与预期的1 100 bp相近,mtDNA D-loop区序列片段长度与预期的1 000 bp相近,即可由苏州金唯智生物科技有限公司进行正反向测序。
1.3 数据分析
通过Chromas version 2.65软件对DNA测序仪产生的原始序列峰图数据进行人工校对。在MEGA 6.06中对mtDNA D-loop区和mtDNACytb基因的序列测定结果进行人工多序列同源比对,辅以Clustal软件校对,校对后的文件保存为Fasta和MEGA格式。采用DnaSP v5软件计算核苷酸多样度、单倍型多样度和平均核苷酸差异数。用MEGA 6.06软件构建单倍型系统发育树,分析样品网络结构。
2 结果与分析
2.1 鹅喉羚mtDNA D-loop区和Cyt b基因组成
由图1可见,mtDNA D-loop区和Cytb基因PCR扩增产物测序结果较好,杂峰、套峰少,波谷波峰界限明确,不存在误读情况,可进行后续序列分析。
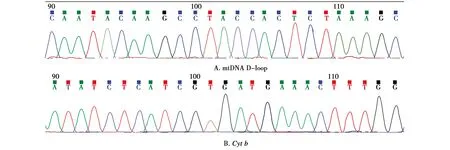
图1 鹅喉羚mtDNA D-loop区和Cyt b基因PCR产物测序结果Fig.1 PCR products sequencing results of mtDNA D-loop region and Cyt b gene in Gazella subgutturosa
将mtDNA D-loop区的测序结果和GenBank中的鹅喉羚mtDNA控制区序列进行同源对比,最终获得14条线粒体控制区序列,长度为791 bp。使用MAGE 6.06对所得序列进行分析,结果显示:腺嘌呤(A)、胸腺嘧啶(T)、胞嘧啶(C)和鸟嘌呤(G)的平均含量分别为33.18%、27.20%、21.87%和17.75%,其中鸟嘌呤含量最低,A+T的平均含量为60.38%,G+C的平均含量为39.62%,碱基组成存在明显的偏向性,这一特征符合脊椎动物mtDNA的序列特征。
将mtDNACytb基因的序列测序结果和GenBank中鹅喉羚mtDNACytb基因序列进行同源对比,最终获得14条线粒体控制区序列,长度为1 084 bp,这与哺乳动物Cytb基因扩增长度1 100~1 200 bp的结果[21]基本吻合。使用MAGE 6.06分析所得序列,结果显示:A、T、C和G的平均含量分别为31.58%、26.71%、28.71%和13.01%,其中鸟嘌呤的含量最低,G+C的平均含量(41.72%)显著低于A+T的平均含量(58.39%),与mtDNA D-loop区类似,具有明显的碱基偏向性,这一特征同样符合脊椎动物的基因序列特征。
2.2 鹅喉羚单倍型多样性
通过DnaSP v5软件对14条鹅喉羚mtDNA D-loop区序列进行多态性分析,结果显示共存在7种单倍型(Hap1~Hap7),其中有3种为共享单倍型,Hap3有2个个体,Hap5有6个个体,Hap6有2个个体,占总单倍型的42.86%;4个为单一单倍型,Hap1、Hap2、Hap4、Hap7,占总单倍型的57.14%。在莎车县采集的8个样本属于2个单倍型,分别为Hap5和Hap6;在叶城县采集的3个样品属于3个单倍型,分别为Hap2、Hap3和Hap4;在英吉沙县采集的3个样本属于3个单倍型,其中1个与叶城县采集的样本为共享单倍型Hap3,另外2个单倍型为Hap1和Hap7(表1)。本研究检测到保守性位点共762个,多态性位点共23个,占总位点数的2.90%,其中包括单一多态位点8个,位于第60、84、157、213、221、241、358和771碱基位,简约性信息位点15个,位于第135、142、199、200、246、337、356、357、440、455、722、723、729、741和743碱基位。
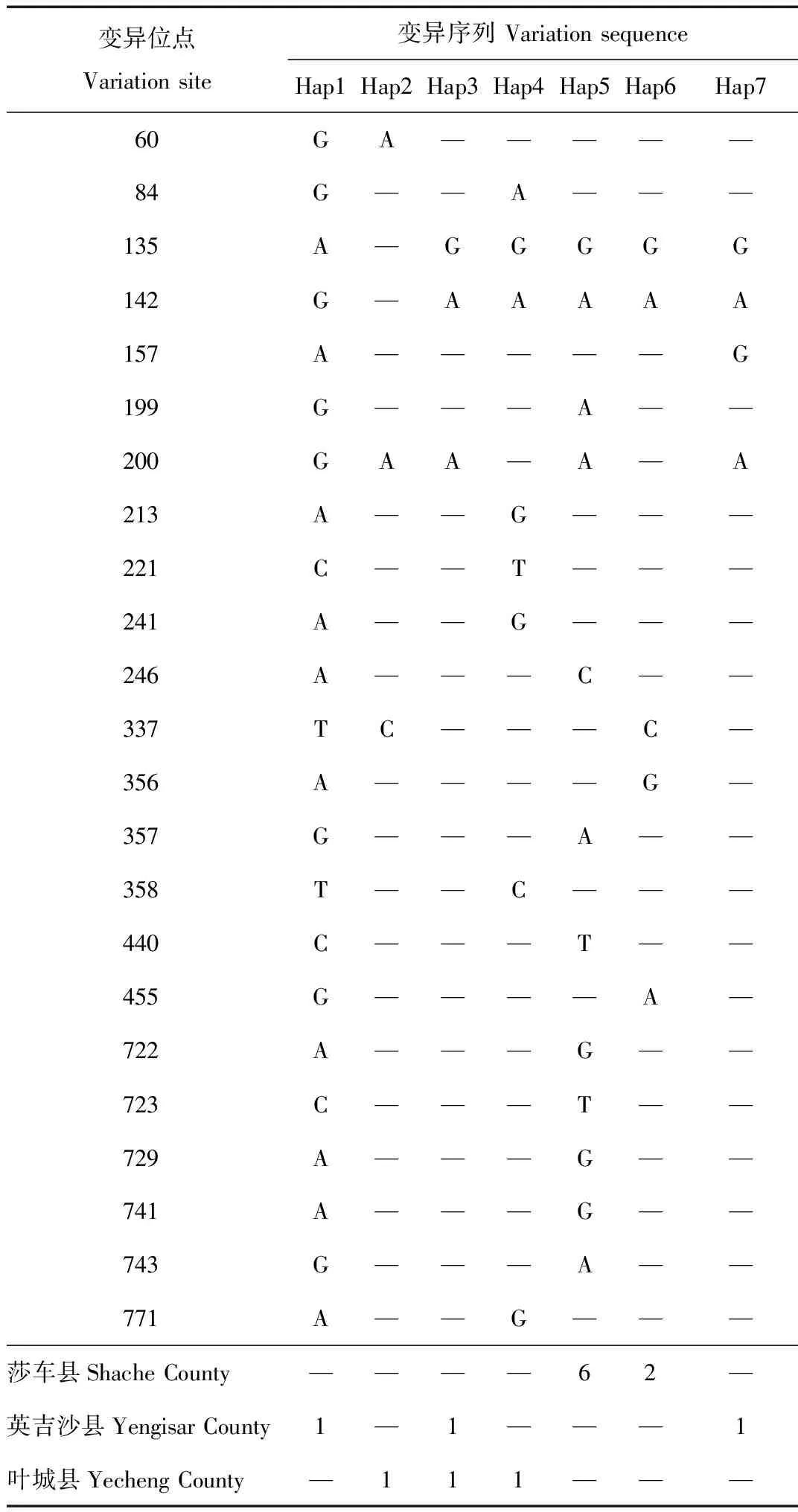
表1 鹅喉羚南疆亚种mtDNA D-loop区的7个单倍型变异序列
通过DnaSP v5软件对14条鹅喉羚mtDNACytb基因序列进行多态性分析,结果显示:存在5个多态性位点,共4种单倍型(Hap1~Hap4),其中有3种为共享单倍型:Hap1有5个个体,Hap2有6个个体,Hap4有2个个体,占总单倍型的75%;Hap3为单一单倍型,占总单倍型的25%。在莎车县采集的8个样本属于2个单倍型,分别为Hap2和Hap4;在叶城县采集的3个样品属于2个单倍型,分别为Hap1和Hap3;在英吉沙县采集的3个样品与在叶城县采集的2个样品属于共享单倍型Hap1(表2)。通过DnaSP v5软件对14条基因序列的1 084个位点进行检测,没有检测到碱基插入和缺失。本研究检测到保守性位点共1 079个,多态性位点共5个,占总位点数的0.46%,其中包括单一多态位点1个,位于第558碱基位,简约性信息位点4个,分别位于第130、525、615和690碱基位。
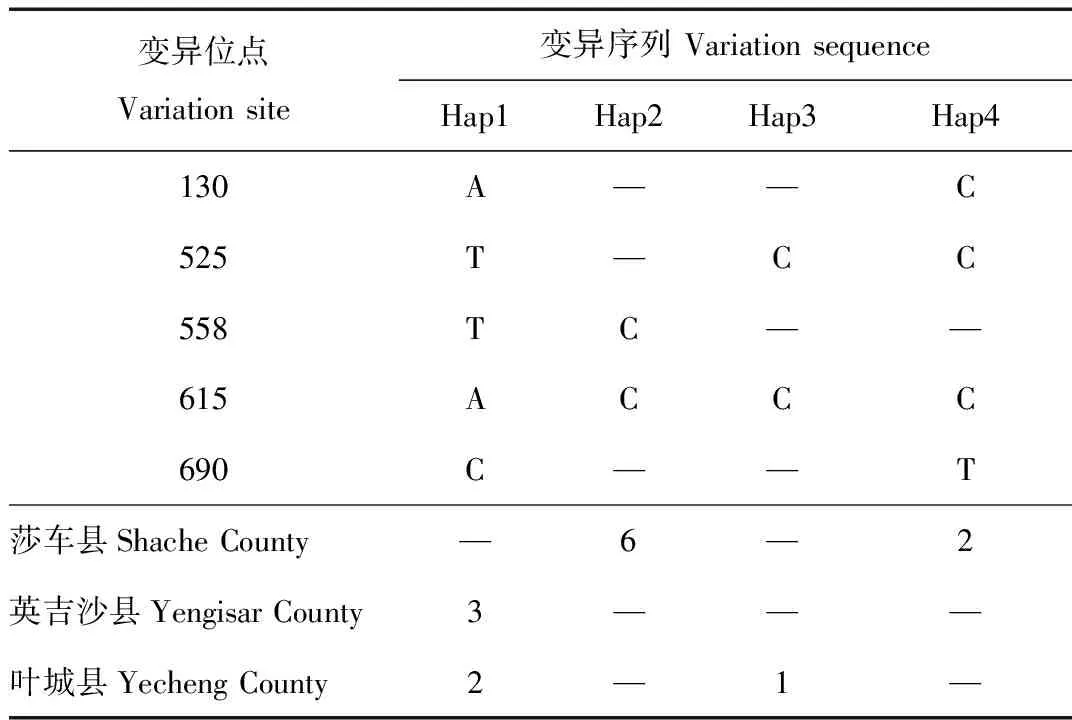
表2 鹅喉羚南疆亚种mtDNA Cyt b基因的4个单倍型变异序列
2.3 鹅喉羚的遗传多样性
14只鹅喉羚南疆亚种的mtDNA D-loop区序列、mtDNACytb基因平均单倍型多样度分别为0.813和0.714,核苷酸多样度为0.008 90和0.001 59,平均核苷酸差异度为7.747和1.725,表明鹅喉羚南疆亚种mtDNA D-loop区和mtDNACytb基因的单倍型多样度水平较高,核苷酸多样度水平低,遗传多样性较高。
2.4 鹅喉羚的系统发育
结合所得数据,下载GenBank中瞪羚属的mtDNA D-loop区同源序列,比对分析共获得36条长度为1 084 bp的序列,经单倍型分析后获得29条序列。使用MAGE 6.06的Kimura 2-parameter(双参数)模型,用邻接法构建NJ系统发育树,对拓扑图进行自展检验,重复抽样次数设置为1 000,以GenBank中山瞪羚(Gazellagazella)mtDNA D-loop区的序列作为外群,结果见图2。本研究中的7种单倍型与山瞪羚位于完全不同的2个进化支系上,表明亲缘关系较远;单倍型Hap1、Hap2、Hap4、Hap6、Hap3和Hap7聚类于进化支系E,Hap5聚类于进化支系F,且进化支系E和F中还包含了GenBank中鹅喉羚南疆亚种的序列,表明同一亚种的亲缘关系较近,7种单倍型聚类于进化支系I。
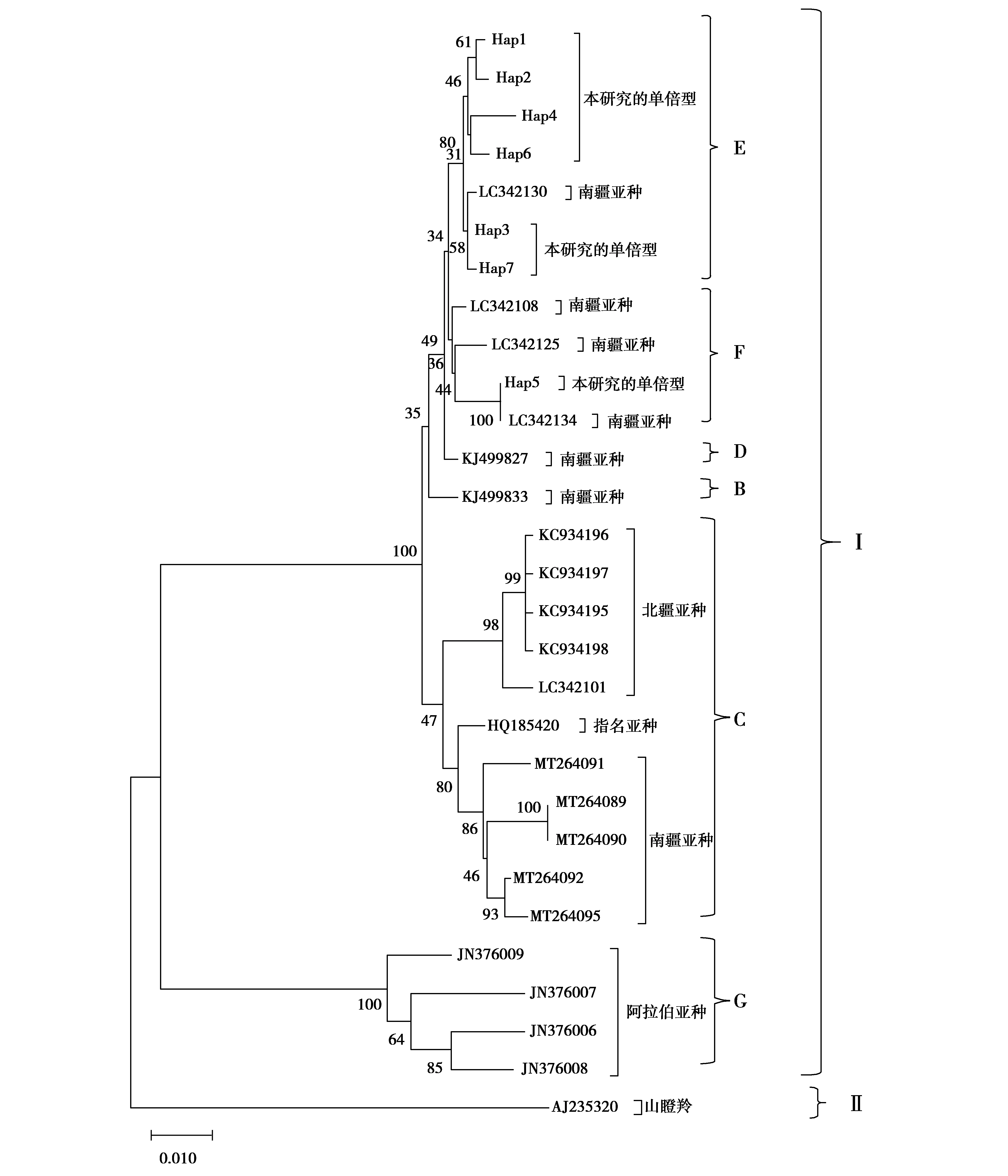
图2 鹅喉羚mtDNA D-loop区序列单倍型的NJ系统发育进化树Fig.2 NJ phylogenetic tree constructed by the sequence haplotypes in the mtDNA D-loop region of Gazella subgutturosa
结合所得数据,下载GenBank中瞪羚属mtDNACytb基因同源序列,将测序获得的序列比对和矫正,共获得35条长度为1 084 bp的序列,经单倍型分析后获得25条序列。以印度瞪羚(Gazellabennettii)的mtDNACytb基因序列作为外群,结果见图3。4种单倍型聚类于进化支系Ⅰ,且其中3种单倍型与GenBank中南疆亚种位于同一进化支系C,1种单倍型与GenBank中鹅喉羚北疆亚种(Gazellasubgutturosasairenses)位于同一进化支系D,说明亲缘关系南疆亚种高于北疆亚种。
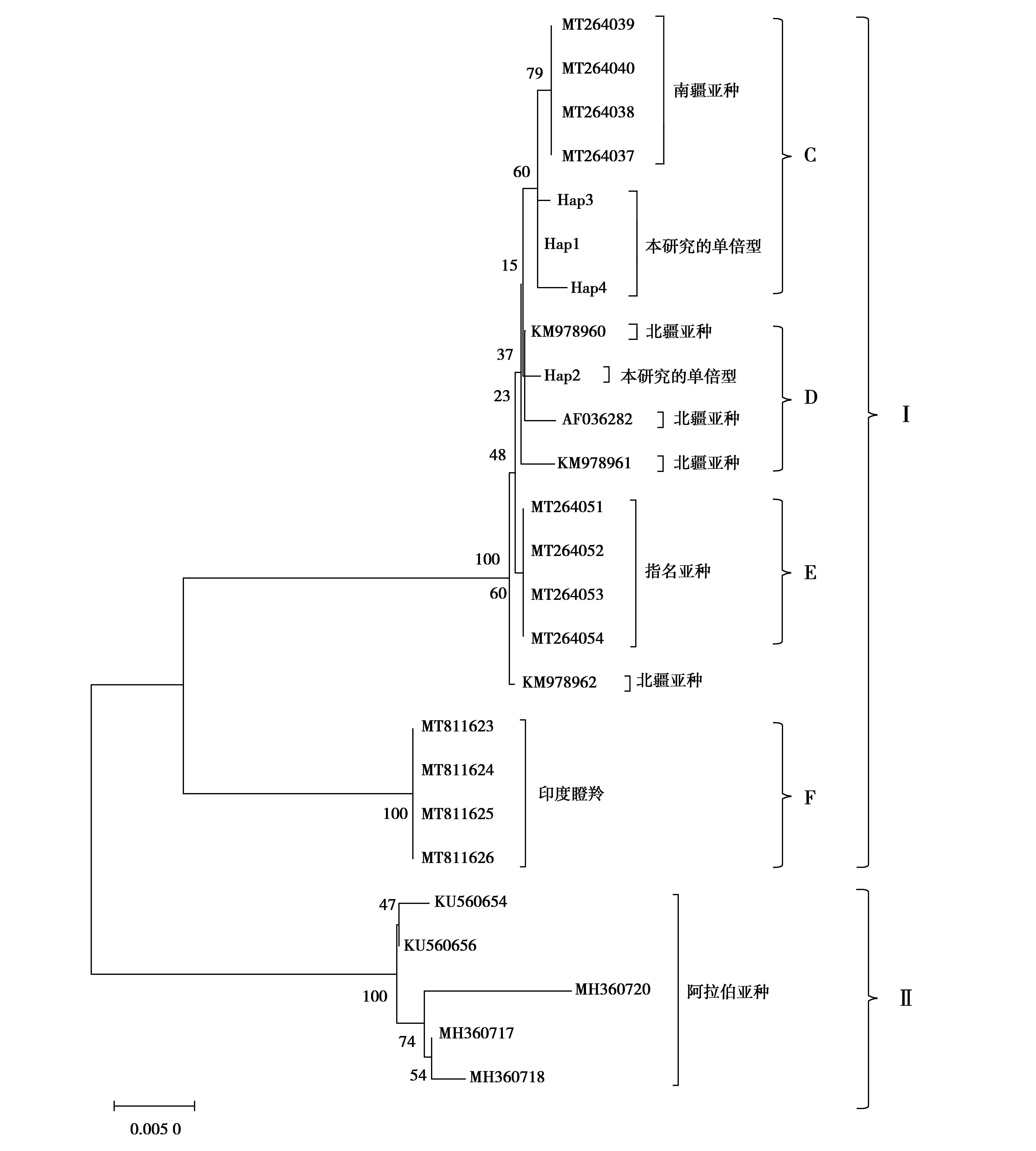
图3 鹅喉羚mtDNA Cyt b基因序列单倍型的NJ系统发育进化树Fig.3 NJ phylogenetic tree constructed by the sequence haplotypes of mtDNA Cyt b region of Gazella subgutturosa
2.5 鹅喉羚网络关系
使用MEGA 6.06构建的南疆亚种鹅喉羚和GenBank中下载的20条mtDNA D-loop区序列的网络关系(图4)与系统发育树显示的结果(图2)一致。鹅喉羚与山瞪羚(Hap8)呈现明显不同的2个分支,且鹅喉羚的各亚种聚为2个分支,未出现低频单倍型以高频单倍型为中心的散射分布,说明单倍型的遗传结构比较单一,基因交流较少。
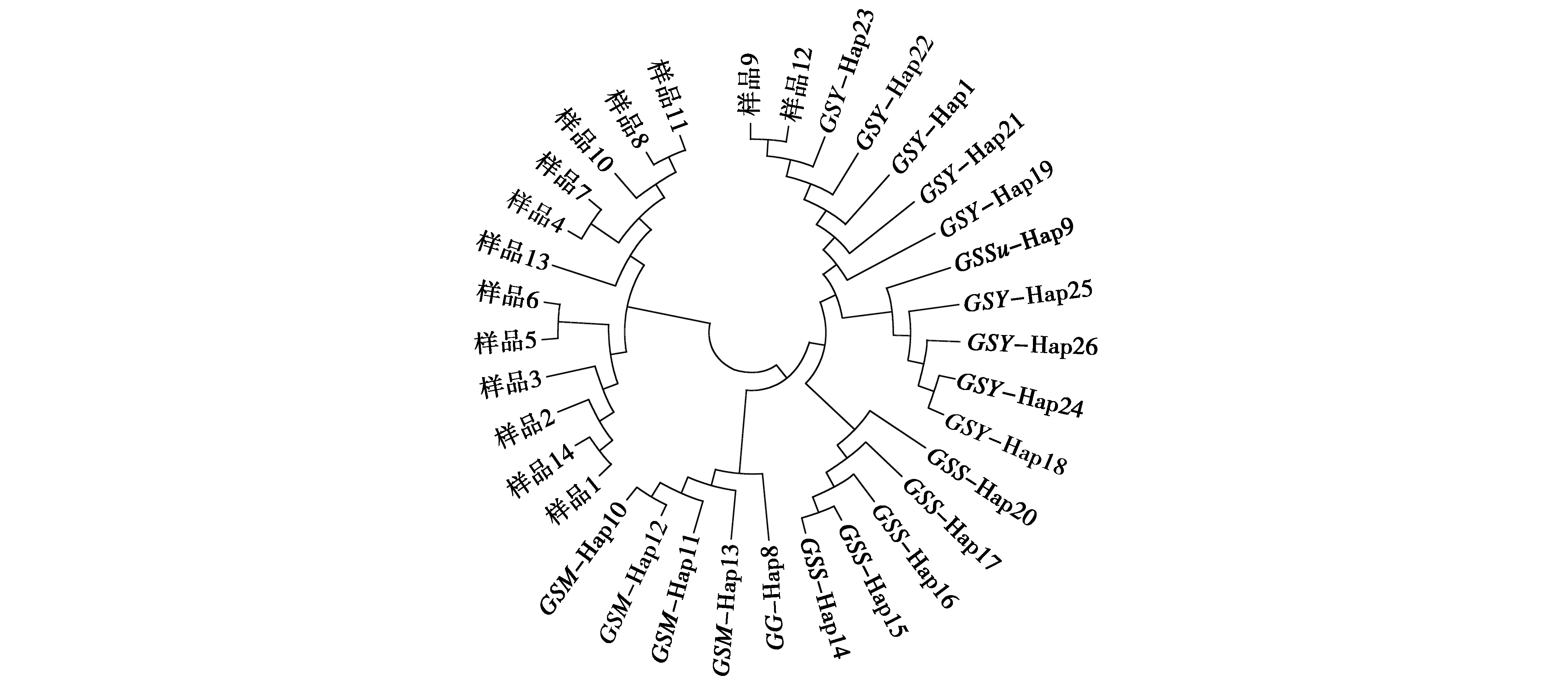
图4 鹅喉羚各亚种间mtDNA D-loop区序列网络关系图Fig.4 Sequence network diagram of mtDNA D-loop region among various subspecies of Gazella subgutturosa 注:GSY.鹅喉羚南疆亚种;GSS.鹅喉羚北疆亚种;GSM.鹅喉羚阿拉伯亚种;GSSu.鹅喉羚指名亚种;GG.山瞪羚 Note:GSY,Gazella subgutturosa yarkandensis.GSS,Gazella subgutturosa sairenses.GSM,Gazella subgutturosa marica.GSSu,Gazella subgutturosa subgutturosa.GG,Gazella gazella
使用MEGA 6.06构建的南疆亚种鹅喉羚和GenBank中下载的23条mtDNACytb序列的网络关系(图5)与系统发育树显示的结果(图3)一致。鹅喉羚与印度瞪羚(Hap14)属于不同分支,且鹅喉羚的各亚种聚为2个分支,未出现低频单倍型以高频单倍型为中心的散射分布,说明倍型的遗传结构比较单一,基因交流较少。
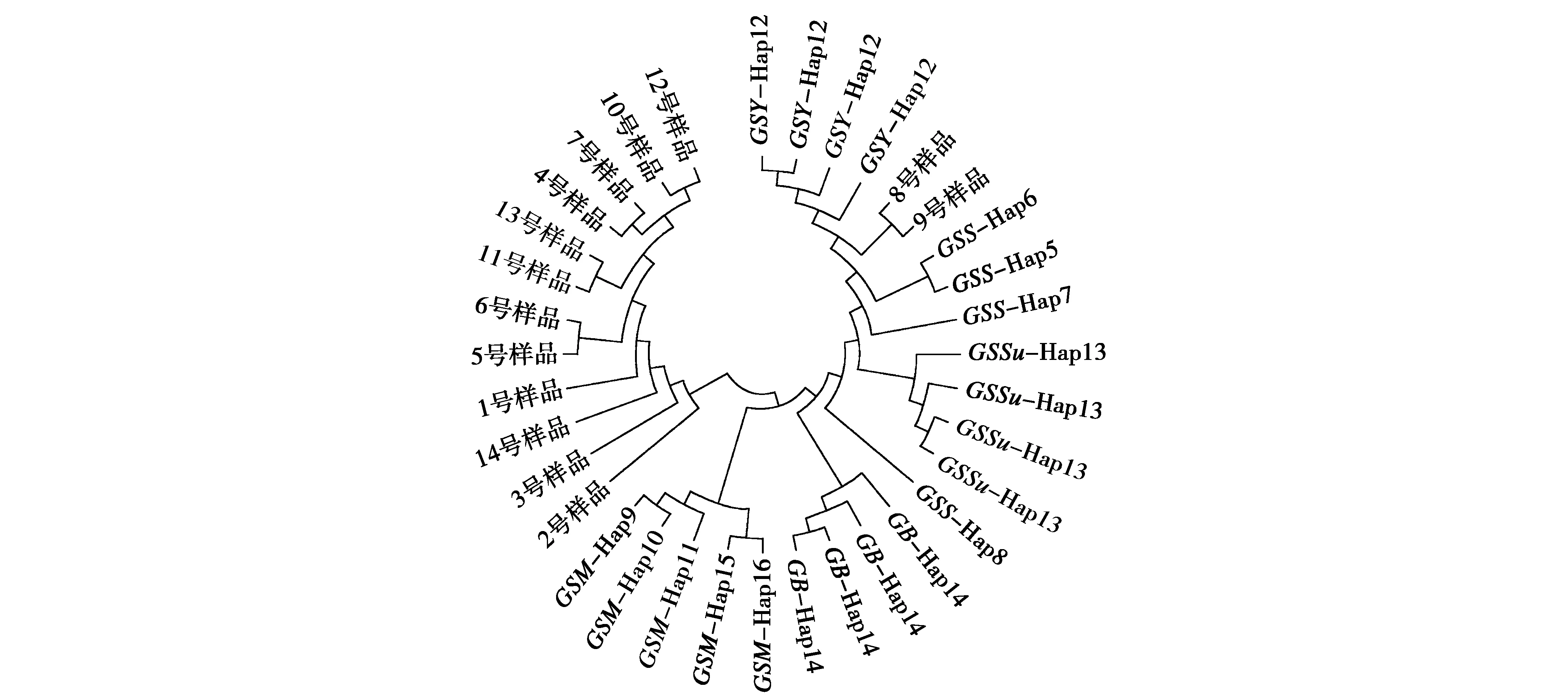
图5 鹅喉羚各亚种间mtDNA Cyt b基因序列网络关系图Fig.5 Sequence network diagram of mtDNA Cyt b region among various subspecies of Gazella subgutturosa 注:GSY.鹅喉羚南疆亚种;GSS.鹅喉羚北疆亚种;GSM.鹅喉羚阿拉伯亚种;GSSu.鹅喉羚指名亚种;GB.印度瞪羚 Note:GSY,Gazella subgutturosa yarkandensis.GSS,Gazella subgutturosa sairenses.GSM,Gazella subgutturosa marica.GSSu,Gazella subgutturosa subgutturosa.GB,Gazella bennettii
3 讨论
本研究对14只鹅喉羚南疆亚种mtDNACytb基因进行分析,在4种碱基中,鸟嘌呤的含量最低,G+C的平均含量(41.72%)显著低于A+T的平均含量(58.28%),与mtDNA D-loop区序列类似,具有明显的碱基偏向性,这一特征符合脊椎动物的基因序列特征。鹅喉羚南疆亚种平均单倍型多样度为0.714,核苷酸多样度为0.001 59,表明mtDNACytb基因的单倍型多样度水平较高,遗传多样性较高,但与董潭成等[22]对卡拉麦里山鹅喉羚mtDNACytb基因的研究结果对比,2个参数均有减弱趋势;相比于夏米西丁·阿不都热依木[23]对新疆鹅喉羚mtDNACytb基因的研究,本研究所得的核苷酸多样度较高,平均单倍型多样度略低。因此,应完善南疆喀什地区鹅喉羚栖息地的保护措施,为其种群提供适合的栖息地环境,可参照马可·波罗盘羊(Ovisammonpolii)保护措施建立鹅喉羚生态公园,进行人工扩繁,同时开展精、卵冷冻保存库离体保护[24]。为全面反应群体的多样性水平,还需要基于更多的基因对遗传多样性开展进一步研究。
鹅喉羚南疆亚种与其他亚种间不存在共享单倍型,可能是因为鹅喉羚在迁徙到叶尔羌河流域后,与其他地区鹅喉羚群体间基因交流较少,经过长期的适应性进化,形成了独特的遗传结构,成为现今的南疆亚种。鹅喉羚南疆亚种的保护措施应进行完善和加强,尤其是近几年冬季气温不断降低,降雪量增加,对鹅喉羚冬季的生存,尤其是觅食造成了很大的影响,建议有关部门在冬季采取适当措施以降低鹅喉羚冬季觅食的难度。
