鸟类传播捕食线虫真菌的可能性探究
2022-05-16李飞腾张淑霞杨晓燕
姜 林 邓 巍 李飞腾 谭 坤,2 张淑霞,2 杨晓燕,2,3*
(1.大理大学东喜玛拉雅研究院,大理,671003;2.中国三江并流区域生物多样性协同创新中心,大理,671003;3.大理大学三江并流区域生物多样性保护与利用云南省创新团队,大理,671003)
微生物作为生态系统中最重要的组成部分,在地球化学循环中扮演着非常重要的角色[1-2]。开展微生物空间分布格局的相关研究,可以帮助人们更合理地管理生态系统并进行功能调控,为微生物的利用和保护提供基础。传统观点认为微生物不受扩散限制的影响[3-4],然而,随着研究的不断深入,研究者发现许多微生物实际上受到扩散限制的影响,具有更复杂的生物地理分布模式[5-7]。研究认为,微生物在较小的空间尺度上不受扩散限制影响而随机分布,在较大空间尺度上可能会受到扩散的影响[8]。因此,扩散可能是影响微生物传播及其空间分布格局的关键因素。
微生物的传播通常需要介质,微生物通过空气等介质的传播往往具有一定的局限性,并且传播范围较小,高达95%的孢子仍然落在距子实体1 m范围之内[9-10]。依靠生物介质的传播则打破了这种局限,通过取食、运动和排泄等活动,动物极大地增加了微生物传播的范围[11-12]。鸟类迁徙可携带微生物跨国、跨洲,甚至全球传播[13-15],鸟类势必会对微生物的传播与分布格局造成影响,但目前相关研究主要集中于鸟类对病原微生物的传播[16-18],鸟类对微生物的扩散及对微生物分布格局的影响研究尚未得到关注。Lovas-kiss等[19]和Silva等[20]研究发现,鸟类可以将鱼卵携带到沙漠新形成的小湖泊中,这预示着对鸟类传播作用的研究不应仅仅局限于病原微生物,对其他微小生物的传播作用也可作为阐明生物分布格局的新视角。
综上所述,开展鸟类对微生物的传播及对微生物分布格局影响的研究很有必要。一方面由于鸟类与微生物分布格局的影响尚未引起重视,另一方面微生物种群复杂、生物量巨大,即便使用分子生物学方法,仍然无法对所有微生物类群进行定性和定量的研究[21-22],因此选择合适的微生物类群也是开展微生物空间分布格局相关研究的关键所在。捕食线虫真菌(nematode-trapping fungi,NTF)是一类在世界范围内各种生境中(主要分布于陆地土壤和水中底泥中)广泛分布的真菌[23-26],兼具腐生和捕食特性[27],是不同生境中线虫的重要平衡因子[27],也可影响土壤氮元素循环[28],因此具有重要的生态学功能。NTF种属少[27,29-31],易于在低倍镜下观察、分离和鉴定[27],菌丝、分生孢子和厚垣孢子均有可能会被鸟类携带并被传播到各处,是开展鸟类对微生物传播研究的理想对象。本研究以NTF为研究对象,采集云南大理州不同野生鸟类脚趾和脚爪、翅下覆羽、尾下覆羽、鸟喙部位的样品,以及粪便样品,以单孢子挑离法纯化NTF,结合形态和分子生物学方法鉴定物种,明确鸟类对NTF的携带与传播的可能性,探究鸟类生活习性对NTF携带的影响。研究结果不仅有助于理解微生物多样性空间格局和驱动机制,也可为微生物生物地理学研究提供支持。
1 试验方法
1.1 样品采集
选取云南省大理州南涧凤凰山环志站、云南云龙天池国家级自然保护区和剑川剑湖湿地省级自然保护区为采样地进行样品的采集。以雾网法和灯光诱捕法捕捉鸟类,将捕捉到的鸟放于铺有一次性塑料袋的鸟笼中,用于粪便采集;使用无菌棉拭子采集鸟的喙部、脚趾和脚爪、翅下覆羽和尾下覆羽处的微生物样品,置于无菌离心管中保存。样品采集后24 h内运送至实验室,冰箱4 ℃保存,一周内处理完采集到的所有样品。
1.2 捕食线虫真菌分离纯化
将放有采样棉拭子的离心管置于离心机4 500 r/min离心5 min,使棉签上的微生物样品分散于生理盐水中。采用土壤散布法[27]在玉米琼脂培养基(corn meat medium,CMA)[32]上撒入1 g左右无菌土样,滴加150 μL样品于无菌土上,再加入1 mL诱饵线虫悬液[33],诱导NTF生长。将平板置于恒温培养箱中25 ℃培养。从第3周开始镜检,同时使用无菌牙签转接NTF的单个分生孢子于CMA平板上,并置于恒温箱中26.5 ℃培养7 d,重复此操作,直至获得NTF纯培养物。
1.3 捕食线虫真菌鉴定
1.3.1 形态学鉴定
采用插片法和粘片法[27]制作捕食线虫真菌临时装片,用奥林巴斯BX53微分干涉显微镜拍取分生孢子、孢子梗和厚垣孢子等形态图片;采用观察室法[27]诱导捕食线虫真菌产生捕食器官,用体视显微镜观察确定捕食器官类型。参照Nematode-trappingfungi[27]和《中国真菌志·第33卷·节丛孢及相关属》[32]进行形态学鉴定。
1.3.2 分子生物学鉴定
通过ITS序列同源性比对和系统发育分析进行分子生物学鉴定。使用马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)[32]富集NTF菌丝,使用真菌基因组DNA快速抽提试剂盒提取真菌基因组DNA[34]。以真菌通用引物ITS4和ITS5[35]对ITS序列扩增。PCR扩增反应总体系为50.0 μL,其中PCR Buffer(10×)5.0 μL,MgCl2(25 mmol/μL)5.0 μL,dNTP(10 mmol/μL)1.0 μL,TaqDNA聚合酶0.5 μL,上游引物(10 μmol/μL)1.5 μL,下游引物(10 μmol/μL)1.5 μL,DNA模板2.0 μL,无菌超纯水33.5 μL。PCR扩增反应条件为94 ℃预变性4 min;94 ℃变性45 s,54 ℃复性1 min,72 ℃延伸1.5 min,共35个循环;最后72 ℃补平延伸10 min。采用2%琼脂糖凝胶电泳检测PCR扩增产物,具体操作参照《分子克隆实验指南》[36],PCR产物委托铂尚生物技术(上海)有限公司用扩增引物双向测序。对所测得的ITS序列拼接和筛查,复制到NCBI中,用BLAST工具进行同源性比对。基于BLAST同源性比对结果,从GenBank数据库中下载亲缘关系较近的物种的ITS序列,用Mafft线上工具[37]生成ITS多序列比对矩阵,用BioEdit v7.2.3[38]对序列矩阵手动调节提高其准确度,在MEGA 6.0[39]中用邻接法(Neighbor-joining,NJ)构建系统发育树。若系统发育分析结果与形态学鉴定结果相符即可认定为相应物种。
1.3.3 数据处理
检出率=(检出的样品数/总的样品数)×100%。
2 结果与分析
2.1 鸟类捕捉及样品采集结果
共捕捉到35种104只野生鸟,采集到脚趾和脚爪、翅下覆羽、尾下覆羽样品各104份,粪便样品21份,体型较大的鸟类采集到喙部样品46份,共计379份样品(附录1)。
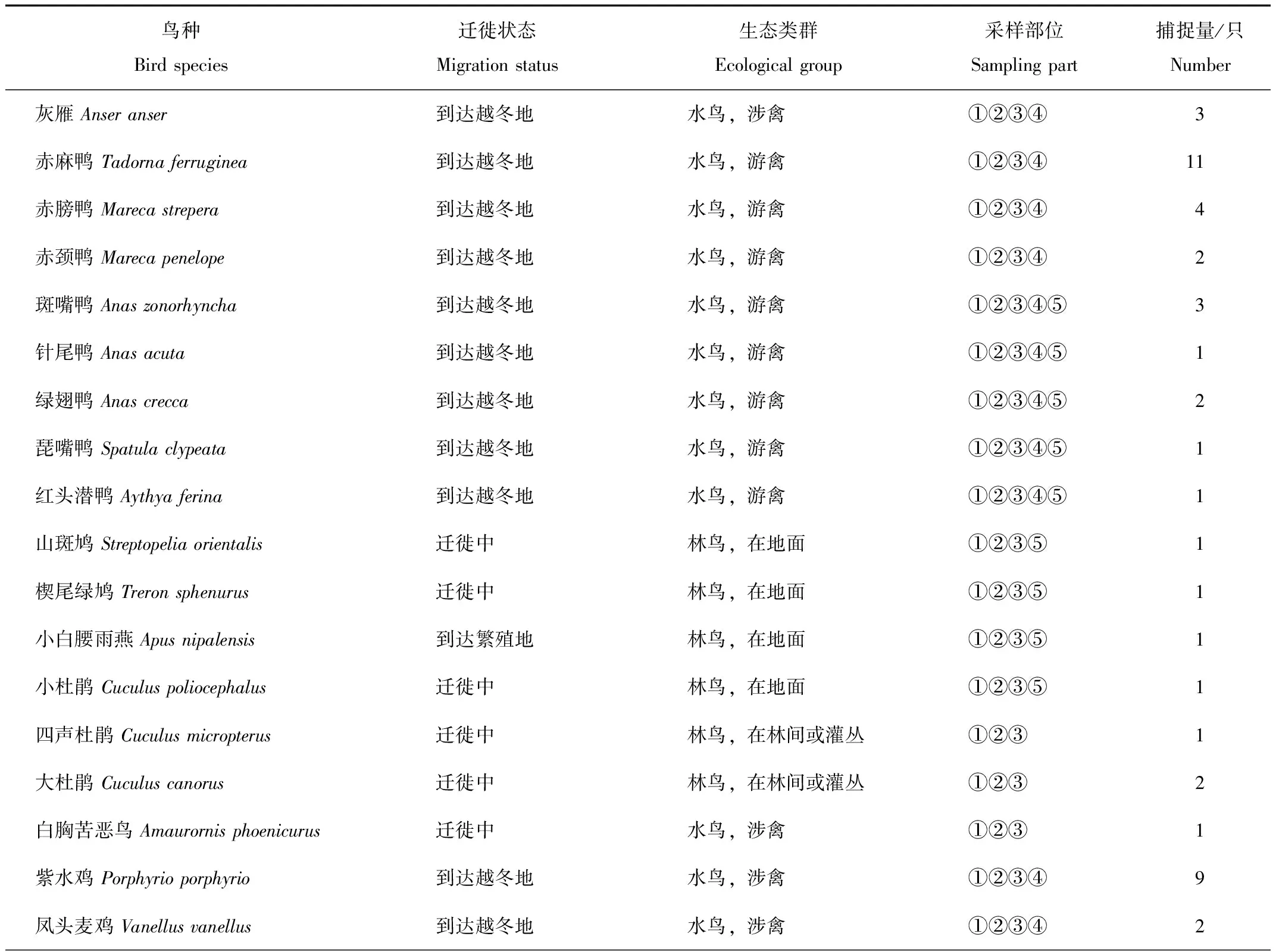
附录1 样品采集信息汇总
2.2 鸟类不同部位携带的捕食线虫真菌种类
从379份样品中共分离到9株捕食线虫真菌,检出样品均来自鸟类的脚趾和脚爪部位,鸟喙、翅下覆羽、尾下覆羽和粪便样品均未检出捕食线虫真菌(表1)。
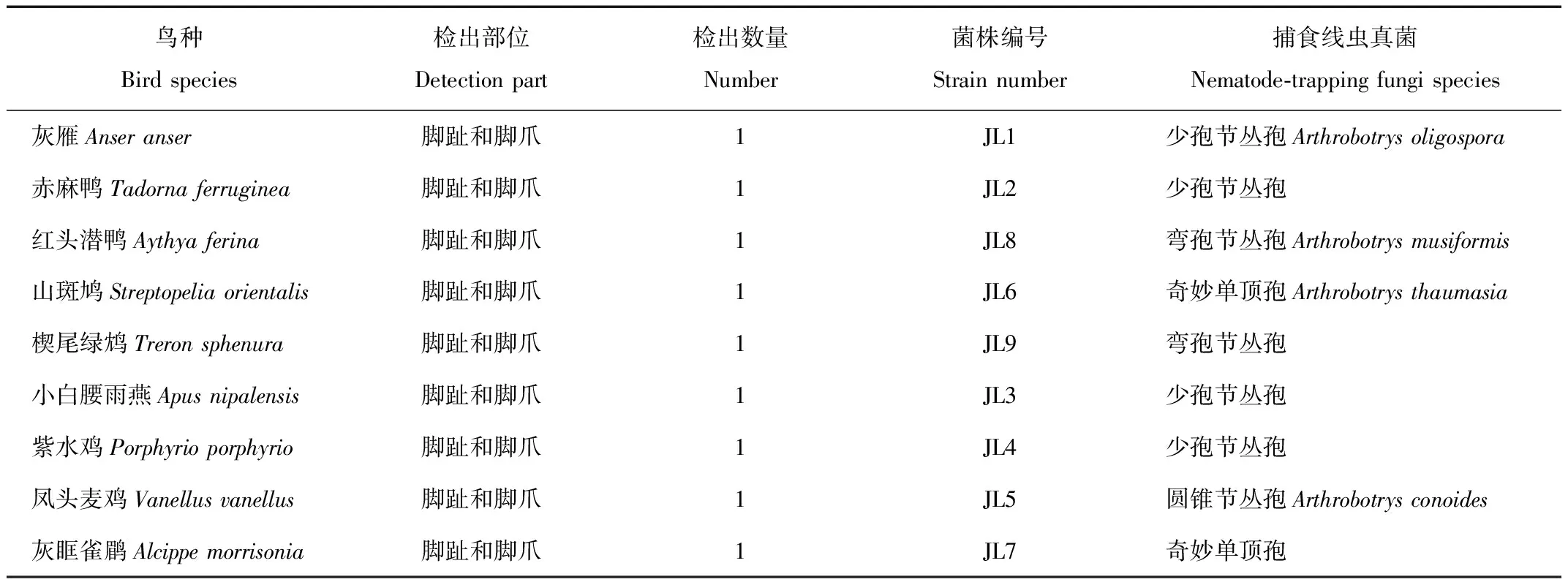
表1 野生鸟类携带的捕食线虫真菌种类
2.3 捕食线虫真菌检测结果
从379份样品中共分离到9株(JL1~JL9)捕食线虫真菌,根据其捕食器官类型(均为黏性三维菌网)和分生孢子形态分别鉴定为少孢节丛孢(Arthrobotrysoligospora,JL1~JL4)、圆锥节丛孢(A.conoides,JL5)、奇妙单顶孢(A.thaumasia,JL6~JL7)和弯孢节丛孢(A.musiformis,JL8~JL9)(图1)。基于ITS序列的系统发育分析显示,JL1~JL4与少孢节丛孢聚为一支(Bootstrap值:100),JL5与圆锥节丛孢聚为一支(Bootstrap值:100),JL6~JL7与奇妙单顶孢聚为一支(Bootstrap值:99),JL8~JL9与弯孢节丛孢聚为一支(Bootstrap值:100)(图2)。系统发育分析结果与形态学鉴定结果相符。

图1 野生鸟类携带的捕食线虫真菌孢子形态Fig.1 Conidia morphology of nematode-trapping fungi species carried by birds 注:A.奇妙单顶孢;B.少孢节丛孢;C.圆锥节丛孢;D.弯孢节丛孢。比例尺为20 μm Note:A,Arthrobotrys thaumasia.B,Arthrobotrys oligospora.C,Arthrobotrys conoides.D,Arthrobotrys musiformis.Scale bar,20 μm
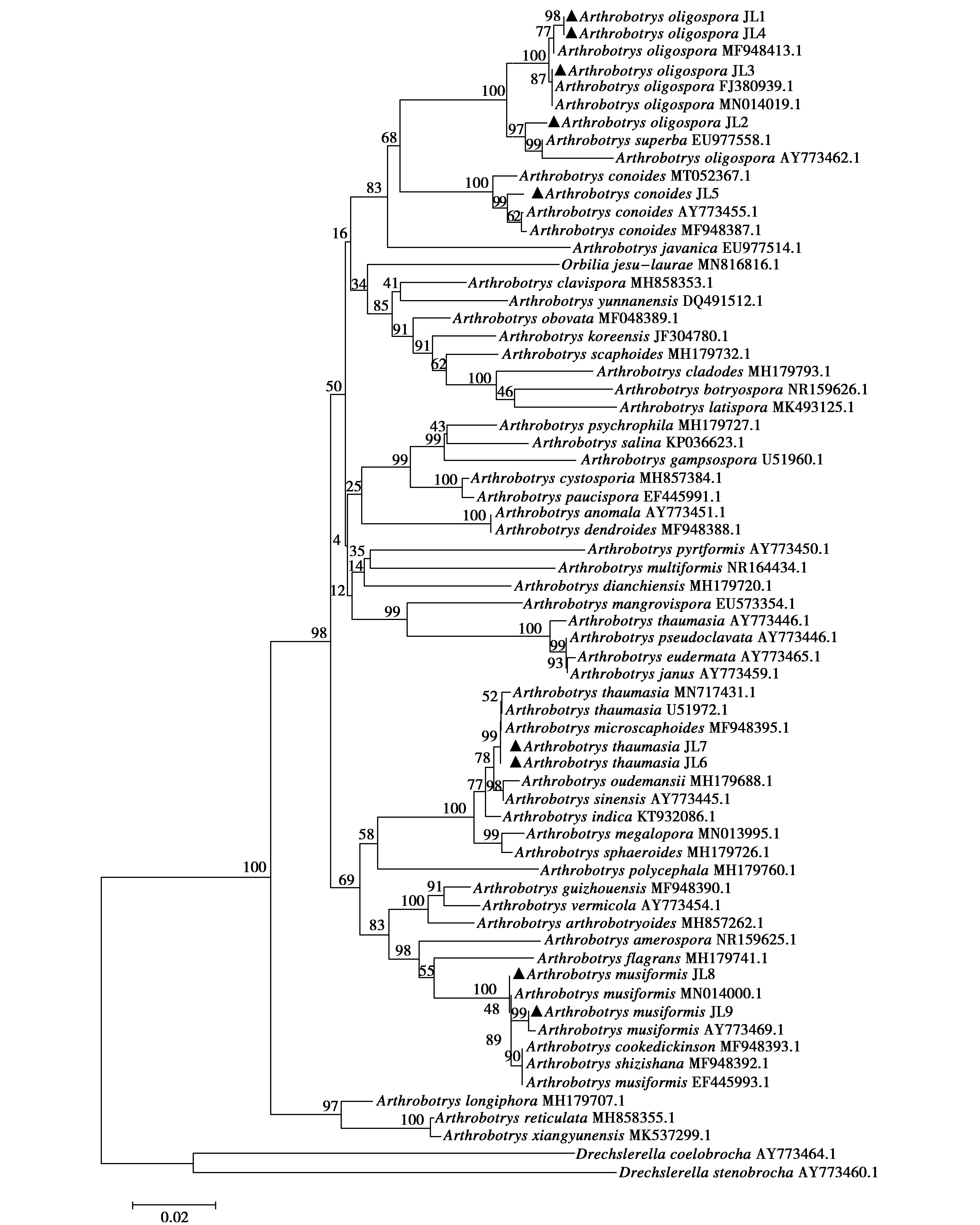
图2 基于ITS1-5.8S-ITS2序列构建的邻接系统发育树Fig.2 Neighbor-joining phylogenetic tree generated based on the ITS1-5.8S-ITS2 rDNA sequence
2.4 不同类群鸟类捕食线虫真菌的检出率
从迁徙状态看,迁徙途中候鸟的NTF检出率为3.6%(共56个样品,检出2个);留鸟的NTF检出率为12.5%(共8个样品,检出1个);已到达越冬地或繁殖地候鸟NTF检出率为15.0%(共40个样品,检出6个)。留鸟和已到达越冬地或繁殖地候鸟的检出率高于迁徙途中的候鸟,留鸟和已到达越冬地或繁殖地候鸟检出率相差不大。
从生态类群看,水鸟NTF的检出率为10.9%(共46个样品,检出5个);林鸟NTF的检出率为6.9%(共58个样品,检出4个)。此外,水鸟又可细分为游禽和涉禽两类,采集到游禽样品28个,有3个样品检出NTF,检出率为10.7%;采集到涉禽样品18个,有2个样品检出NTF,检出率为11.1%。林鸟又可细分为仅在林间乔木灌丛中活动和在地面活动两类,仅在林间乔木灌丛活动的鸟类样品有36个,NTF检出率为0;在地面活动的鸟类样品有22个,有4个样品检出NTF,检出率为18.2%。
3 讨论
3.1 鸟类能够通过鸟爪携带并存在传播捕食线虫真菌的可能性
目前国内外有关鸟类对微生物传播的研究主要针对病原微生物[16-18],相关内容大多聚焦于粪便的传播途径[41-42],仅有少数研究关注到了鸟类羽毛对病原微生物的携带作用[43],尚未有研究关注到鸟类对其他微生物的携带和传播及传播方式。本研究证明鸟类脚趾和脚爪能够携带NTF,而鸟类其他部位样品均未检出NTF,这可能是在鸟类的各种活动中,脚趾和脚爪更频繁地接触地面土壤,土壤又是NTF原始生境[25-26],有着更丰富的NTF类群,因而鸟类的脚趾和脚爪更易于接触并携带NTF。
林慧彪等[44]和杨琳等[45]的研究表明,一些哺乳动物的粪便中检测出了NTF,而本研究野生鸟类粪便样品中并未检出NTF,这可能是鸟类直肠短小,体内基本无储存的粪便,与其他哺乳动物相比,鸟类每次产生的粪便量较少,从而导致鸟类粪便中的NTF检出率较低。
3.2 鸟类的生境选择决定微生物传播的能力和范围
在捕捉到的鸟类中,留鸟样品NTF检出率略低于已到达越冬地或繁殖地的候鸟,但二者都明显高于在迁徙途中的候鸟。这可能是留鸟和已到达越冬地或繁殖地的候鸟在栖息地内活动频次高、时间长,接触地面土壤的机会更多,有了较高的NTF携带率,可能具有更高的传播概率。而迁徙途中的候鸟需要长时间、远距离的迁徙,大部分时间都在飞行,停歇、补充能量的时间很短,接触NTF的概率小,因而NTF检出率更低。此外,候鸟样品中检出的NTF物种均是节丛孢属,表明候鸟具备携带并远距离传播NTF的可能性。
与林鸟相比,水鸟的NTF检出率更高。水鸟虽然在水中活动,但在夜晚会停留在水边湿地处休息,而土壤、泥沼中存在大量NTF[23-26],本研究游禽和涉禽的捕捉地就是在泥沼中,这是水鸟NTF检出率较高的原因。在林鸟中,局限在林间乔木灌丛活动觅食的鸟类基本不落地活动,很难接触到NTF的原始生境(土壤),仅在地面以上乔木灌丛中活动的林鸟样品中未检出NTF;而在林间地面或岩石上活动的林鸟有较大概率接触土壤,这些鸟类样品的NTF检出率较高,例如灰眶雀鹛(Alcippemorrisonia)在地面觅食,小白腰雨燕(Apusnipalensis)攀附在竖直的岩石上栖息。
由此可见,鸟类的生境选择,即是否在NTF广泛存在的地面土壤或泥沼中活动,决定了NTF的携带能力。
3.3 鸟类对广布微生物的携带和传播概率更高
目前对NTF的研究表明[27],少孢节丛孢是NTF中的广布种,对其广泛分布的解释一般是产三维菌网的NTF(节丛孢属)多营腐生生活,在不同生境中更易获得生长优势,使它们的生物量较其他属(Dactylellina和Drechslerella)更高,更容易被检测到。但这仅能解释其局域范围内的广布种分布,无法解释其世界性的广泛分布。本研究结果显示,鸟爪所携带的NTF均为节丛孢属真菌,其中少孢节丛孢占比更大,考虑到鸟类具备的跨洲迁徙的能力,土壤中的广布种也更有机会被鸟类携带而传播到世界各地,这在一定程度上解释了少孢节丛孢的世界性分布。
基于研究结果可知,鸟类对微生物的传播作用不应该仅局限于病原微生物及粪便传播方面,鸟类通过脚趾和脚爪等部位携带并传播微生物,影响微生物的空间分布格局,应该纳入相关研究范畴,这可能会加深人类对微生物多样性空间分布格局形成和驱动机制的理解。
致谢:感谢云龙天池国家级自然保护区管护局、南涧凤凰山环志站、剑湖省级自然保护区管护局工作人员为此次野外采样工作给予的协调和帮助;感谢大理大学东喜玛拉雅研究院肖文研究员、李德品副教授、王荣兴助理研究员在本研究过程中提供的指导和帮助。
