血管生成素样蛋白8促进大鼠主动脉血管平滑肌细胞表型转化
2022-05-16孙秋菊焦晓璐于华惠吕倩雯秦彦文
孙秋菊,焦晓璐,于华惠,李 凡,吕倩雯,王 钰,秦彦文
(首都医科大学附属北京安贞医院 北京市心肺血管疾病研究所, 北京 100029)
中国心血管疾病的患病率处于持续上升阶段,现患人数有3.30亿,心血管疾病死亡占城乡居民总死亡原因的首位[1]。动脉粥样硬化(atherosclerosis,AS)是多种心血管疾病的病理生理基础。AS的主要发病机制包括内皮损伤学说、炎性反应浸润学说、平滑肌细胞(vascular smooth muscle cells, VSMCs)增殖学说等[2]。VSMCs表型转化是其增殖迁移的起始环节,在AS发生发展中发挥重要作用[3]。在生理状态下,位于动脉中膜的VSMCs呈收缩型,没有增殖特性,主要维持血管壁的张力和血液的生理稳态,但当受到病理性刺激后,如遇到氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL),VSMCs收缩型表型发生转化,转化为具有分泌和增殖功能的合成型表型,促进VSMCs的增殖、迁移,从而促进AS的发生发展[4]。
血管生成素样蛋白8(angiopoietin-like protein 8, ANGPTL8),是血管生成素样蛋白家族(angiopoietin-like proteins, ANGPTLs)的非典型成员,参与多种病理生理过程,包括脂代谢、糖代谢、炎性反应、细胞增殖迁移等过程。近年来,临床研究发现在AS患者血浆中ANGPTL8水平显著增加,循环ANGPTL8浓度与冠心病和颈动脉斑块的严重程度呈正相关[5-6],这表明ANGPTL8参与动脉粥样硬化性心血管疾病的发生发展。研究表明ANGPTL8可以通过促进巨噬细胞形成泡沫细胞从而促进AS的发展[2],在某些病理状态下VSMCs可表达分泌ANGPTL8[7],那么,ANGPTL8是否可以通过影响VSMCs功能从而影响AS的发生发展,目前尚不清楚。因此,本研究探讨了AS发病过程中ANGPTL8对VSMCs功能的作用及潜在机制。
1 材料与方法
1.1 材料
1.1.1 动物: SPF 级 8 周龄雄性ApoE-/-小鼠(北京市华阜康生物科技有限公司)。所有动物的使用均遵循美国健康国立研究所出版的实验动物管理和使用指南和首都医科大学实验动物管理和使用规则并通过首都医科大学实验动物伦理委员会批准(批准文号:GZR-3-059)。
1.1.2 主要材料:大鼠主动脉血管平滑肌细胞(VSMCs)(上海信裕生物科技有限公司);DMEM培养基(Thermo Fisher Scientific公司);胎牛血清(HyClone公司);Ox-LDL(北京协生生物技术有限公司);ERK信号通路抑制剂PD98059(Selleck公司);抗ANGPTL8抗体、抗OPN抗体、抗PCNA抗体和抗Ki67抗体(Abcam公司);抗α-SMA抗体(北京中杉金桥生物技术公司);抗SM22α抗体(武汉三鹰生物技术公司);抗ERK抗体和抗p-ERK抗体(Santa Cruz 公司);二抗(CST公司)。
1.2 研究方法
1.2.1 动物模型的构建:西方饮食(21%脂肪+0.15%胆固醇)喂养 ApoE-/-小鼠12周,构建动脉粥样硬化模型。
1.2.2 免疫荧光染色检测共定位:收取小鼠主动脉根部制备为5 μm的冰冻切片,4%多聚甲醛固定30 min,内源性过氧化物酶阻断20 min,血清封闭30 min,一抗(1∶200)4 ℃孵育过夜,二抗室温避光孵育1 h,DAPI染核封片。使用荧光显微镜获得图像。
1.2.3 大鼠主动脉VSMCs的培养及分组处理:将细胞培养于含有10%胎牛血清及 1%的青霉素/链霉素DMEM培养基中,置于 37 ℃、5% CO2孵箱。根据转染说明书,将含有绿色荧光蛋白(green fluorescent protein,GFP)的对照组和ANGPTL8过表达(LV-ANGPTL8)慢病毒(lentivirus,LV)感染至VSMCs 中,构建稳转细胞株。将细胞分为对照(control)组,ANGPTL8过表达(LV-ANGPTL8)组,ox-LDL(50 mg/L)组,(ox-LDL+ ANGPTL8过表达)组,[ANGPTL8过表达+ERK通路抑制剂(PD98059)]组。
1.2.4 细胞划痕实验检测细胞迁移情况:将VSMCs以1×105/mL接种到6孔板上,待细胞汇合度达80%~90%时,200 μL移液枪头垂直培养皿进行划痕,PBS冲洗3次,倒置光学显微镜下拍照,放入37 ℃、5% CO2孵箱培养24 h,取样观察、倒置光学显微镜下拍照,使用Image J软件分析迁移率[8]。
1.2.5 Western blot检测α-SMA、SM22α、OPN、PCNA、Ki67等蛋白的表达:使用含有RIPA 裂解液提取蛋白质,测定蛋白浓度。每个泳道按30 μg蛋白质样品进行上样,SDS-PAGE分离目标蛋白,电转至PVDF膜上。5%牛奶封闭1 h,一抗(1∶1 000)4 ℃孵育过夜,二抗 (1∶10 000)室温孵育2 h, ECL化学发光法显影, 使用Image Lab软件分析目标条带。
1.3 统计学分析

2 结果
2.1 AS斑块中VSMCs表达分泌ANGPTL8
在AS斑块中, ANGPTL8与VSMCs存在共定位(图1)。
Ox-LDL呈浓度-时间依赖性地促进VSMCs 中ANGPTL8的表达 (图2)。
2.2 ANGPTL8促进VSMCs表型转化
与对照组相比,ox-LDL刺激后,VSMCs收缩型标志物 SM22α表达显著降低(P<0.05),VSMCs合成型标志物OPN表达显著增加(P<0.05)。与ox-LDL刺激相比, ox-LDL刺激后再过表达ANGPTL8,SM22α表达显著降低(P<0.05),OPN表达显著增加(P<0.05)。与对照组相比,未加ox-LDL刺激时ANGPTL8过表达抑制SM22α表达(P<0.05),促进OPN表达(P<0.05)(图3)。
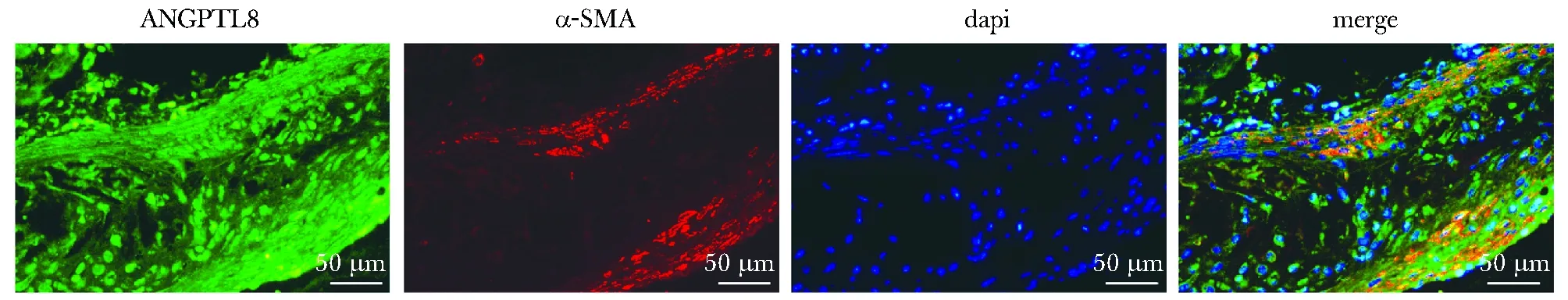
图1 ANGPTL8与α-SMA免疫荧光染色Fig 1 Immunofluorescence co-staining of α-SMA (red) and ANGPTL8(green) (×400) (n=6)

A.ANGPTL8 levels in VSMCs were increased with ox-LDL treatment with 25, 50 or 100 mg/L ox-LDL for 24 hours, as assessed by Western blot; B.ANGPTL8 levels in VSMCs were increased with 50 mg/L ox-LDL treatment with 6, 12 or 24 hours, as assessed by Western blot; *P<0.05 compared with control group
2.3 ANGPTL8促进VSMCs增殖迁移
与对照组相比,ox-LDL刺激后,VSMCs增殖标志物Ki67、PCNA的表达水平显著增高(P<0.05),VSMCs细胞迁移能力显著增加(P<0.05)。与ox-LDL组相比,ox-LDL+LV-ANGPTL8组中 Ki67、PCNA的表达水平显著增高(P<0.05),VSMCs细胞迁移能力增加(P<0.05)。与对照组相比,单纯过表达ANGPTL8显著增加了 Ki67、PCNA的表达水平(P<0.05)(图4A),促进了VSMCs细胞迁移能力(图4B)。
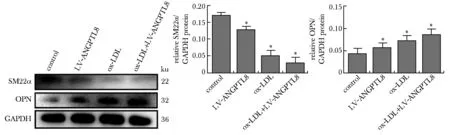
SM22α and OPN expression as assessed by Western blot in VSMCs treated with 50 mg/L ox-LDL; *P<0.05 compared with control group; #P<0.05 compared with ox-LDL group
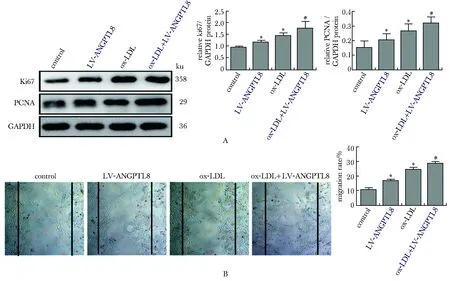
A.Ki67 and PCNA expression as assessed by Western blot in VSMCs treated with 50 mg/L ox-LDL; B.migration of VSMCs treated with saline or 50 mg/L ox-LDL, as evaluated by wound-healing assay (×40); *P<0.05 compared with control group; #P<0.05 compared with ox-LDL group
2.4 ANGPTL8通过ERK通路影响VSMCs功能
与对照组相比,ox-LDL激活ERK磷酸化(P<0.05),与ox-LDL组相比,过表达ANGPTL8后,ANGPTL8进一步激活了ERK的磷酸化(P<0.05)(图5A);在加入ERK通路抑制剂PD98059后,与ANGPTL8过表达组相比,ERK通路抑制剂显著促进α-SMA、SM22α的表达(P<0.05),显著抑制OPN、PCNA的表达(P<0.05)(图5B),显著降低其迁移能力(P<0.05)(图5C)。
3 讨论
VSMCs在AS的发生发展中发挥着重要作用,其增殖迁移能力与表型转化密不可分,在AS形成过程中, VSMCs作用的起始环节为表型转化, 受到致病因子刺激后从收缩型变为合成型,促进自身的增殖迁移,促进AS早期阶段纤维帽的形成从而促进AS的发生发展[3]。本研究发现ANGPTL8过表达可促进VSMCs表型转化与增殖迁移。

A.ERK and p-ERK expression as assessed by Western blot; *P<0.05 compared with control group; #P<0.05 compared with ox-LDL group; B.α-SMA,SM22α,OPN and PCNA expression as assessed by Western blot; C.migration of VSMCs as evaluated by wound-healing assay (×40); *P<0.05 compared with control group; #P<0.05 compared with LV-ANGPTL8 group
研究表明ANGPTL8在心血管疾病的发生和发展中起作用。在冠状动脉疾病患者中ANGPTL8水平升高并与内皮功能障碍独立相关[5];与单纯2型糖尿病(diabetes mellitus type 2,T2DM)患者相比,T2DM合并AS患者血清中ANGPTL8水平明显升高,提示ANGPTL8是T2DM合并AS的一种新的生物标志物[9]。研究表明,间歇性低氧刺激可促进VSMCs表达ANGPTL8[7]; 血管生成素II可呈时间与剂量依赖性促进VSMCs中 ANGPTL8表达[10]。本研究发现,在AS斑块中,VSMCs也可表达分泌ANGPTL8,ox-LDL可呈时间-剂量依赖性的促进VSMCs细胞ANGPTL8表达增加,这些结果提示,在AS形成过程中,ANGPTL8可以通过影响VSMCs发挥作用。
研究表明ANGPTL8参与细胞增殖与迁移过程。ANGPTL8通过内质网应激途径诱导主动脉VSMCs增殖[10];早期给予ANGPTL8可促进糖尿病新生儿的β细胞增殖[11];在小鼠椎间盘退变模型中,ANGPTL8敲除降低了VSMCs迁移标志物MMP-3和MMP-9的表达[12]。本研究发现ANGPTL8过表达可抑制收缩型标志物α-SMA、SM22α表达,促进合成型标志物OPN的表达,促进增殖标志物PCNA、Ki67的表达,促进VSMCs细胞迁移,表明了ANGPTL8在VSMCs表型转化、增殖迁移中发挥重要作用。
ERK 是一种丝氨酸/苏氨酸蛋白激酶,是一种传递有丝分裂原信号的信号传导蛋白,ERK通路参与多种细胞过程。研究表明,miR-155通过调控MEK/ERK/NF-κb通路激活NLRP3炎性小体从而促进ApoE-/-小鼠AS斑块的形成[13];过表达Pim-1可以激活ERK通路促进VSMCs迁移[14]; ANGPTL8重组蛋白可以激活肝细胞、脂肪细胞和胰腺β细胞中的 ERK通路[15]。本研究发现,ANGPTL8可以激活VSMCs的ERK通路,加入ERK通路抑制剂后,可显著逆转ANGPTL8引起的VSMCs表型转化和增殖迁移,证明ANGPTL8通过调控ERK通路促进VSMCs表型转化和增殖迁移从而促进AS的发生发展。
综上所述,本研究发现ANGPTL8可通过激活ERK信号通路促进VSMCs 表型转化和增殖迁移,为ANGPTL8促进VSMCs表型转化从而促进动脉粥样硬化提供了新的证据。
