不同控制水平哮喘儿童的肠道菌群分析
2022-05-16邹羽彤黄林生
邹羽彤 黄林生 钟 慧 杨 蓉 谷 丽
1.安徽理工大学上海十院临床学院(安徽淮南 232001);2.同济大学附属第十人民医院(上海 200072)
支气管哮喘(简称哮喘)是儿童时期最常见的慢性气道疾病之一。近20余年来,我国儿童哮喘的患病率呈明显上升趋势[1-3],严重影响儿童的身心健康。我国在2012 年—2013 年对10 个城市大型医院的3 069 例哮喘儿童控制现状的调查显示,即使严格遵循哮喘全球防治创意(GINA)方案治疗,仍有28.7%与45.0%的患儿未得到控制或部分控制[4]。因此,如何有效提高哮喘控制水平,对改善哮喘患儿的生活质量,减轻其家庭以及社会负担意义重大。目前越来越多的研究致力于探索新的方法来改变哮喘的控制现状[5-6]。其中,肠道菌群的研究成为热点领域。肠道菌群作为人体最复杂的微生态系统,除了影响肠道内的微环境外,在人体免疫稳态中也起到重要作用[7]。研究表明肠道菌群失调与哮喘的发生发展均密切相关[8-10]。本文拟通过研究不同控制水平哮喘患儿之间肠道菌群水平的差异,探讨肠道菌群对哮喘患儿控制水平的影响,为微生态制剂在哮喘治疗中的应用提供理论基础。
1 对象与方法
1.1 研究对象
选取2020年1月至2020年12月于上海市第十人民医院儿科门诊诊治并确诊为哮喘的患儿为研究对象。入选标准:①符合我国儿童支气管哮喘诊断与防治指南的诊断标准(2016 年版)[11];②年龄10~12岁;③患儿具有良好的依从性,坚持规律治疗。随机选取同期本院健康体检儿童为对照组。对照组入选标准:①年龄10~12岁;②体检未见异常,且无哮喘及其他过敏性疾病史。各组排除标准:①不配合肺功能检查、粪便检测者;②近4周服用益生菌;③近4 周有呼吸系统感染及抗生素使用史;④合并除哮喘以外的慢性呼吸道疾病;⑤并发其他系统疾病如内分泌疾病、肝肾功能不全、心血管疾病和自身免疫疾病等。
根据我国儿童支气管哮喘诊断与防治指南的诊断标准[11],对哮喘患儿近4 周日间症状、夜间是否憋醒、应急缓解药使用频率、活动受限情况,进行哮喘控制水平分级评估;存在1 项及以上症状归入未控制/部分控制组,无以上任一症状归入控制组。
本研究经医院伦理委员会批准(SHSY-IEC-4.0/19-175/01),所有受试者在研究开始前签署知情同意书。
1.2 方法
1.2.1 临床资料收集 包括性别、年龄、身高、体质量等一般临床资料。
1.2.2 治疗 所有患儿均依照我国儿童支气管哮喘诊断与防治指南[11]进行治疗,在入组前均接受沙美特罗替卡松粉雾剂(50ug/100ug)作为长期治疗药物。治疗时间为开始规律用药至入组当天。
1.2.3 样本采集 所有研究对象均在入组后当天留取2g新鲜粪便样本,置于可室温保存的一次性大便样本采集处理器中;在24h内转移至冻存管中收存,放入-80℃冰箱保存备测。
1.2.4 肺功能检测 所有研究对象入组当天,由专业人员使用Medi-soft 肺功能检测仪行肺功能检测,检测指标包括用力肺活量(forced vital capacity,FVC)、第一秒用力呼气量(forced expiratory volume in 1 second,FEV1)、FEV1/FVC、最大呼气中段流量(maximal mid-expiratory flow,MMEF)、用力呼气流速(forced expiratory flow,FEF)的FEF25、FEF50、FEF75。
1.2.5 粪便16 s rRNA 细菌检测 ①DNA 提取与扩增:按照TIANamp stool DNA Kit粪便基因组DNA提取试剂盒操作步骤提取粪便样本中的DNA,而后行靶向PCR 扩增,回收纯化PCR 产物,进行荧光定量,而后按照每个样本的测序量要求进行相应的比例混合。②高通量测序与分析:采用Illumina Miseq高通量测序平台测序,后经数据拆分、去引物序列、成对末端读长拼接、序列质量及长度过滤和截取以及去嵌合体后获得最终的有效OTU(operational taxonomic unit)聚类分析数据。基于OTU聚类数据再对各个分类数据进行群落结构的统计分析。③Alpha 多样性指数:反映微生物群落的丰富度和多样性,其中Observed otus指数是指样本中实际测定得到的物种数量,Shannon指数用于衡量样品中物种均匀度的指数,Pielou E指数的计算考虑到样品中的分类总数和每个分类所占的比例,Faith pd指数基于系统发生树来计算的一种多样性指数,它用各个样品中OTU 的代表序列计算出构建系统发生树的距离,将某一样品中的所有代表序列的枝长加和,从而得到数值。
1.3 统计学分析
采用SPSS 21.0统计软件进行数据分析。计量资料符合正态分布的以均数±标准差表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验,两组间比较采用两独立样本t检验;非正态分布的以中位数(P25~P75)表示,组间比较采用秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2检验。绘制受试者工作特征(receiver operating characteristic,ROC)曲线分析Veillonella丰度对哮喘控制水平的预测价值。以P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况
共入组哮喘患儿34例,过程中控制组有1例不配合肺功能检查,未控制/部分控制组有1例近4周有抗生素使用史,2例不配合粪便采集。共4例患儿脱落,最终纳入30例。
控制组16例,男10例、女6例,年龄(12.19±1.11)岁,身高(156.50±9.08)cm,体质量(56.7±13.68)kg;未控制/部分控制组14例,男8例、女6例,年龄(12.92±1.59)岁,身高(159.64±14.11)cm,体质量(58.46±18.25)kg;控制组中临床缓解期12例,慢性持续期4例;未控制/部分控制组中慢性持续期14例。对照组12例,男6例、女6例,年龄(13.17±1.03)岁,身高(161.48±5.84)cm,体质量(52.54±10.29)kg。三组间性别(χ2=0.80,P=0.804)、年龄(F=2.33,P=0.110)、身高(F=0.83,P=0.443)及体质量(F=0.56,P=0.579)比较,差异均无统计学意义。控制组治疗时间为(1.22±0.18)年,未控制/部分控制组为(1.24±0.15)年,差异无统计学意义(t=0.41,P=0.684)。
2.2 三组主要肺通气功能检测结果比较
三组间FVC、FEV1、FEV1/FVC、MMEF、FEF25、FEF75绝对值差异均无统计学意义(P>0.05)。三组间FEF50绝对值差异有统计学意义(P<0.05),未控制/部分控制组较低。见表1。
表1 三组通气功能指标(绝对值)比较()
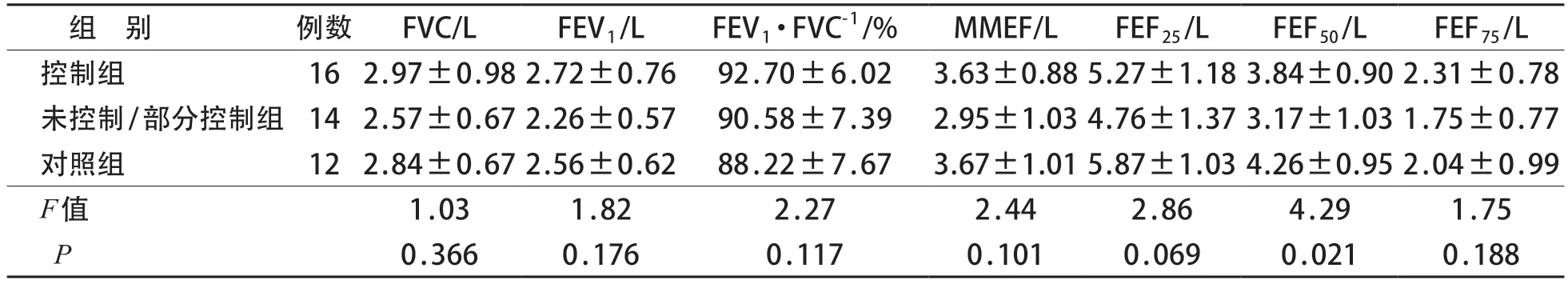
表1 三组通气功能指标(绝对值)比较()
2.3 肠道菌群的物种数量与Alpha多样性比较
通过对42个粪便样本的高通量测序分析,分析得到2 721个OTU,其中三组共有OTU数目1 289个,对照组特有257 个OTU,未控制/部分控制组特有198个OTU,控制组特有158个OTU(图1a)。三组之间Alpha多样性指数(4个指数)差异均无统计学意义(P>0.05)。见表2。
表2 三组间肠道菌群测序的Alpha多样性比较()

表2 三组间肠道菌群测序的Alpha多样性比较()
通过对三组肠道菌群属水平结构组分分析发现,三组均主要由25个属构成。两种菌属均是肠道菌群的主要菌属(图1b),其中拟杆菌属(Bacteroides)物种相对丰度控制组为29.61(27.13~36.11)%,未控制/部分控制组为30.22(26.88~48.19)%,对照组为27.43(20.82~33.99)%,三组间差异无统计学意义(H=3.39,P=0.184);粪杆菌属(Faecalibacterium)物种相对丰度控制组为(20.05±10.10)%,未控制/部分控制组为15.55(11.15~21.28)%,对照组为(23.95±8.47)%,三组间差异无统计学意义(H=3.36,P=0.186)。

图1 肠道菌群丰度及物种差异分析
未控制/部分控制组中韦荣球菌属(Veillonella)物种相对丰度为0.06(0.01~0.25)%,控制组为0.53(0.19~0.92)%,对照组为0.17(0.09~0.82)%,三组间差异有统计学意义(H=9.03,P=0.011)。两两比较发现,未控制/部分控制组中Veillonella丰度较控制组以及对照组明显降低,差异有统计学意义(P<0.05)。
LEfSe 分析结果提示殊异韦荣菌(Veillonella.dispar)是控制组中的特征性菌属,而戈登副拟杆菌(Parabacteroides.gordonii)是未控制/部分控制组的特征性菌属(图1c)。
2.4 Veillonella丰度对哮喘控制水平预测的ROC曲线分析
行ROC曲线分析可见,Veillonella丰度对哮喘控制水平预测的曲线下面积为0.82(95%CI:0.66~0.98,P=0.003)。取最佳临界值点丰度为0.0018时,预测哮喘控制水平的特异性为28.6%,敏感度为86.7%。见图2。

图2 Veillonella 丰度预测哮喘控制水平的ROC 曲线分析
3 讨论
哮喘长期治疗方案的制订及调整以其控制水平为依据,可使患儿得到更充分的治疗,从而达到并维持临床控制[11]。近年来,我国儿童哮喘的规范化管理模式及治疗手段在不断改进,也取得了一定的进展,但是仍有不少患儿未能达到理想的治疗目标,儿童哮喘的总体控制水平有待进一步提高[4,12]。达到症状的良好控制和维持正常肺功能是哮喘治疗的主要目标。小气道因其自身细小且分支多的特点,是呼吸系统疾病中较早且容易被侵犯的部位,也是气道高反应发生的关键部位[13]。有研究表明,较多哮喘患者存在小气道受损,小气道功能与气道高反应之间密切相关,与哮喘控制水平及远期预后都有着十分紧密的联系[14-17]。本研究中,三组间通气功能指标比较差异均无统计学意义,但未控制/部分控制组小气道指标FEF25、FEF50较对照组有下降趋势,提示小气道通气功能障碍可能与哮喘控制不佳有关。因此,仅根据临床症状以及肺通气功能参数FEV1、FEV1/FVC 而判断哮喘控制,易忽视患儿小气道功能障碍的情况,可能导致未来哮喘控制不良,进而影响哮喘儿童的远期预后。
肠道菌群作为肠道免疫系统的重要刺激因素,通过机体局部或全身免疫应答反应等多种途径调节免疫平衡,促进肠黏膜相关淋巴组织的成熟,增强肠黏膜的屏障功能。肠道菌群的构成与过敏性疾病的发生有关,肠道菌群的改变可引起肺部免疫和肺部疾病的变化[18]。肠道微生物群可通过产生细菌配体、细菌代谢物和能够通过血液循环到达肺部的免疫细胞来调节肺免疫[19-20]。一些研究显示,成人哮喘患者与健康人群的肠道菌群之间虽没有显著差异,但存在一些产丁酸盐的特异性菌属,可能在症状早期控制中发挥作用[21]。
人体的肠道主要菌群是拟杆菌门与厚壁菌门,本研究中哮喘控制组的特征菌属Veillonella是一类以利用有机酸转化产生乙酸盐、丙酸盐为主的革兰阴性厌氧微小球菌,属于厚壁菌门,参与构成人和动物的口腔、泌尿生殖器、呼吸道及肠道内的正常菌群。一项来自加拿大的纵向研究显示,哮喘高风险的婴儿肠道中韦荣球菌(Veillonella)、粪肠球菌(Faecalis)、毛螺菌(Lachnospira)、罗氏菌(Rothia)的相对丰度显著降低[9]。在进一步的动物实验中,这四种菌的肠道定植也明显改善了无菌小鼠的气道炎症[22],但哮喘的高危儿童是否可通过早期补充这些益生菌来改善哮喘的控制水平,仍有待临床证实。相关研究发现1 岁时粪便中丁酸盐和丙酸含量高的儿童在3~6岁患哮喘的可能性也较小,而在小鼠哮喘模型中补充短链脂肪酸可减轻其气道炎症反应[23-25]。有研究表明,在出生后第一年补充特定的微生物制剂对哮喘高危儿童来说具有一定益处[8]。另有研究发现,补充益生菌辅助治疗支气管哮喘,可调节患儿免疫功能,降低哮喘复发率[26]。值得注意的是,目前多为肠道菌群与哮喘发病机制之间的相关性研究,而肠道菌群对哮喘控制水平影响的研究较少。近年来多项研究表明,单一或复合益生菌(如鼠李糖乳杆菌、双歧杆菌、副乳杆菌、发酵乳杆菌等)在哮喘的防治中具有一定的辅助效果[27-29],虽然其机制尚不明确,但是提示肠道菌群可能在一定程度上可影响哮喘患者的控制水平。本研究提示控制不佳的哮喘患儿肠道菌群特征性菌属Veillonella丰度明显减少,可能与哮喘控制水平具有一定的相关性。但具体影响途径,是通过减少对有机酸的分解转化或是肠道菌群紊乱促进促炎因子转录[30]亦或是其他通路,现有研究并无法确定。该研究为哮喘儿童的长期控制治疗可能提供了一种新思路,通过补充优势菌群的微生物制剂或进行优势菌群移植来调节或改善哮喘患儿的肠道菌群紊乱,以达到控制哮喘水平的目的;为哮喘的临床治疗提供了可能性,但仍需对肠道菌群与哮喘发病机制的影响进一步研究证实。
综上所述,控制不佳的哮喘儿童肠道菌群中Veillonella丰度明显减少,相关机制有待于进一步研究深入。本研究仍存在一定的不足之处,首先纳入的样本量较少,入组患儿均未处于急性发作期,主要通气功能结果无统计学差异,可能存在单中心偏倚,试验数据的准确性还有待进一步增加样本量来论证;其次,本研究采用16 s rRNA 的检测方式,对未控制/部分控制组的特征性菌属并没有更深入的分析,使用更精确的检测技术分析或许会得到更好的结果;第三,本研究仅检测了单节点的患儿肠道菌群,还需对临床入组人群进行肠道菌群动态追踪和分析,或哮喘规范治疗前后肠道菌群比较。也期待大样本、多中心的临床研究做进一步的论证,为临床儿童哮喘的防治提供新的思路。
