PD-1抑制剂联合长春瑞滨节拍化疗后线治疗晚期非小细胞肺癌疗效观察
2022-05-16宛新安方明星周勤韦永明刁海霞
宛新安,方明星,周勤,韦永明,刁海霞
(芜湖市第二人民医院,安徽 芜湖 241000)
肺癌是最常见的恶性肿瘤,发病率高,病死率高。近年来,PD-1/PD-L1免疫检查点疗法在非小细胞肺癌治疗中的应用越来越广泛,也取得了良好的疗效,但免疫检查点抑制剂单药有效率仅10%~30%,且会出现耐药,因此为提高有效率、减缓耐药,免疫检查点治疗联合其他治疗方法是目前研究的热点和发展方向[1-4]。本研究使用PD-1抑制剂联合长春瑞滨节拍化疗三线及以上治疗晚期非小细胞肺癌(NSCLC),观察其疗效和安全性。报告如下。
1 资料与方法
1.1 一般资料
选取2020年1月—2021年6月收治的56 例非小细胞肺癌患者,其中男36 例,女20 例,年龄42~84 岁,将其随机分为PD-1抑制剂单药组(单药组)和PD-1抑制剂联合长春瑞滨节拍化疗组(联合组),每组28 例。入组患者均有胸部CT可测量病灶。
1.2 纳入及排除标准
纳入标准:经组织学或细胞学确诊,按国际抗癌联盟/美国癌症联合委员会(UICC/AJCC)第8版肺癌分期为临床Ⅳ期的NSCLC,或者手术/放疗后复发转移的晚期NSCLC患者;经EGFR/ALK-TKI或者化疗二线及以上治疗失败;有临床可评价病灶,卡氏评分(KPS)>60分,预计生存期>3个月;血常规、肝肾功能、心脏功能无明显异常,无化疗、免疫治疗禁忌证。
1.3 治疗方法
单药组采用PD-1抑制剂(信迪利单抗,商品名为达伯舒,信达生物制药有限公司,国药准字:S20180016,规格:10 mL∶100 mg)200 mg,静脉滴注30~60 min,每21天为一个周期;联合组在单药组的基础上联合长春瑞滨(酒石酸长春瑞滨软胶囊,商品名为盖诺,江苏恒瑞医药股份有限公司,国药准字:H20061234,规格:20 mg×2片)20 mg,隔天口服一次,直至疾病进展或不能耐受,每21天为一个治疗周期。治疗期间监测患者血常规、肝肾功能及心电图。考虑免疫治疗起效时间较长,此研究中患者于治疗2个周期和4个周期后各评价疗效一次。以下情况停止治疗:患者自行放弃治疗;不良反应不能耐受。
1.4 观察指标
近期疗效:治疗2个周期和4个周期后分别复查胸部CT,参照实体瘤免疫治疗疗效评价标准(irRECIST)[5]对比治疗前后肿瘤病灶大小的变化,进行近期疗效评价。疗效分为完全缓解(irCR)、部分缓解(irPR)、稳定(irSD)、疾病进展(irPD)。客观缓解率(ORR)=(irCR+irPR)例数/总例数×100%。疾病控制率(DCR)=(irCR+irPR+irSD)例数/总例数×100%。不良反应:常见免疫治疗相关不良反应(irAE)为乏力、皮肤毒性、腹泻、肝脏毒性、肺炎、内分泌系统毒性等;化疗药物不良反应按照NCI-CTCAE标准评价,分为Ⅰ~Ⅳ级,以Ⅲ~Ⅳ级为严重毒副反应。
1.5 统计学方法
采用SPSS19.0统计学软件使用χ2检验和Fisher精确概率法,P<0.05为差异有统计学意义。
2 结 果
2.1 近期疗效
入组56 例患者均完成了既定治疗,于治疗2个周期和4个周期后复查,评价疗效。治疗2个周期后:单药组ORR为7.1%,DCR为25.0%;联合组ORR为32.1%,DCR为67.9%。治疗4个周期评价:单药组ORR为10.7%,DCR为46.4%;联合组ORR为35.7%,DCR为75.0%。联合组的ORR和DCR均高于单药组,疗效较确切,差异有统计学意义(P<0.05)(见表1)。

表1 两组治疗效果对比
进一步对不同病理类型分层分析,比较治疗4个周期后的疗效,腺癌患者中单药组ORR为12.5%,DCR为43.7%;联合组ORR为33.3%,DCR为73.3%。鳞癌患者中单药组ORR为8.3%,DCR为50.0%;联合组ORR为38.5%,DCR为76.9%。无论是腺癌患者,还是鳞癌患者,联合组的ORR和DCR数值均高于单药组,但经过Fisher精确概率法统计差异无统计学意义(P>0.05)(见表2)。
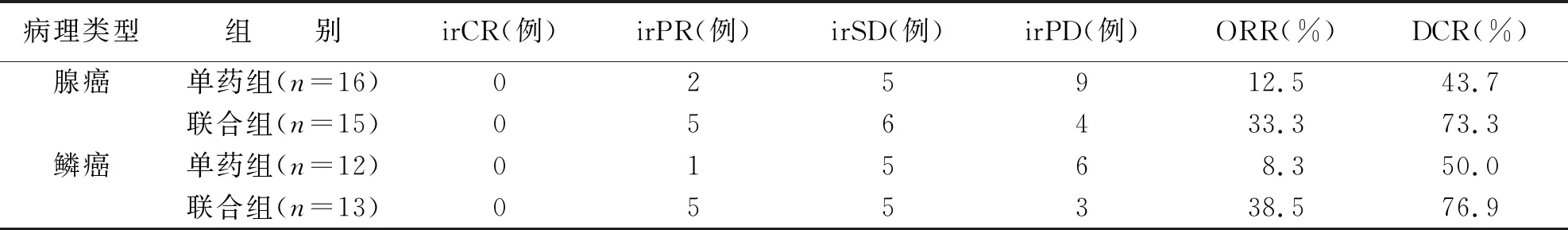
表2 治疗4个周期后两组不同病理类型治疗效果对比
2.2 不良反应
联合组因加入长春新碱会出现神经毒性、血小板下降、白细胞下降、肝功能受损、恶心呕吐等。两种药物毒副作用有不同也有重叠,但多为Ⅰ~Ⅱ级不良反应,患者能耐受,予以相应对症处理后完成治疗,无Ⅳ级不良反应,无一例患者因不良反应暂停治疗。联合组仅恶心呕吐和白细胞下降这两种常见的毒副作用发生率较单药组高,但均为Ⅰ~Ⅱ级,经对症处理好转后患者可耐受治疗,其余不良反应两组比较差异无统计学意义(P>0.05)(见表3)。

表3 两组不良反应 单位:例(%)
3 讨 论
肿瘤免疫检查点PD-1的发现和应用是肿瘤治疗领域的里程碑,取得了令人瞩目的临床疗效。2015年PD-1抑制剂Nivolumab和Pembrolizumab上市,2016年PD-L1抑制剂Atezolizumab上市,2018年首个国产PD-1抑制剂特瑞普利上市,免疫检查点疗法迅速发展、方兴未艾。近年来,PD-1/PD-L1免疫检查点疗法大量运用到肺癌的治疗中[6-8],也取得了一定的疗效。然而,免疫检查点抑制剂虽改善了部分晚期非小细胞肺癌患者的预后,但免疫检查点抑制剂单药有效率仍然较低,且容易出现耐药,为提高疗效、减缓耐药,联合免疫检查点治疗和其他治疗方法是目前的研究热点。
节拍化疗不同于常规化疗,是通过低剂量、高频率、持续给药的方式,在保证良好的杀伤肿瘤细胞作用的同时,不良反应更少,且在常规化疗耐药的情况下,仍可以达到抑制肿瘤的效果[9-10]。节拍化疗的给药剂量相对较小(通常为常规剂量的1/10~1/3),并且通过较频繁的给药抑制肿瘤血管生成,也被称为抗肿瘤血管生成化疗[11]。从目前已经阐明的机制来看,节拍化疗通过拮抗血管内皮生长因子(VEGF)或血管内皮生长因子受体(VEGFR)信号传导,发挥抗肿瘤血管生成作用,增加组织灌注,诱导肿瘤血管内皮细胞分泌黏附性分子,促进免疫细胞浸润,减少免疫抑制相关细胞及因子的产生和聚集,重塑肿瘤免疫微环境,从而提高免疫治疗的疗效[12]。
对于二线及以上治疗失败的非小细胞肺癌患者,仍然没有标准方案可循,但根据具体病理分型和驱动基因情况,可以选择单药化疗、抗血管生成治疗或免疫治疗等。这类NSCLC患者已经经历过多线治疗,一般情况较差,免疫治疗和节拍化疗相对较低的毒副作用以及另辟蹊径的抗肿瘤机制为我们提供了新的思路。
本研究具体分析PD-1抑制剂联合长春新碱节拍化疗后线治疗晚期NSCLC的临床疗效。研究分为单药组和联合组进行,考虑到免疫治疗起效时间较长(通常需要2~3个月),单药组可能在2个周期(6周)后疗效仍未显现,而联合组因为有长春新碱化疗药,起效较快,所以在2个周期和4个周期后评价近期疗效,可以看出2个周期后联合组客观缓解率和疾病控制率均高于单药组;4个周期后,虽然单药组疗效有所提高,但联合组客观缓解率和疾病控制率仍然高于单药组,疗效较确切,差异有统计学意义。进一步按病理类型分层分析发现,无论是腺癌,还是鳞癌,联合组的ORR和DCR均高于单药组,但差异无统计学意义(P>0.05),考虑可能是因为入组病例数较少。不良反应方面,无论是单药组还是联合组多为Ⅰ~Ⅱ级不良反应。联合组仅恶心呕吐和白细胞下降发生率较单药组高,差异有统计学意义,但均不严重,经对症处理后缓解;其余不良反应两组比较差异无统计学意义,由此可见,PD-1抑制剂联合长春新碱节拍化疗总体耐受性良好。
总之,联合PD-1抑制剂和长春新碱节拍化疗后线治疗晚期NSCLC有较好的疗效,优于PD-1抑制剂单药治疗,毒副作用较小,患者耐受性良好,安全性较高。另一方面,本研究主要观察近期疗效,初步评价了此种联合疗法的有益趋势,但节拍化疗的抗血管生成作用及其免疫促进作用、对免疫微环境的影响以及联合疗法是否能进一步放大免疫疗法的拖尾效应,从而获得更好的生存期,都有待于进一步研究阐明。
