动物消化道微生物培养组学研究进展
2022-05-16王佳堃
米 兰,王佳堃
(浙江大学奶业科学研究所,浙江杭州 310058)
消化道微生物与其宿主的健康及生产性能密切相关。高通量组学技术有利地揭秘了特定生境下的微生物组成和潜在的群落功能。但受测序深度和测序读长的限制,组学技术难以追踪低丰度的微生物,难以在种水平上比较菌群间的差异;且组学获得的功能信息未能在菌株水平上加以验证,仍停留在基因或相关分析水平。因此,结合传统纯培养和高通量组学技术的培养组学,分离、培养基于组学技术获得的“尚未被培养”的微生物,验证其形态特征、生理功能、生长特性、代谢功能、酶促反应等,已成为近年来微生物研究的热点和突破口。
培养组学利用微生物基因组测序数据,获得目标微生物的最佳生存环境,大大提高了目标微生物的可培养性,成功分离、培养和鉴定了生境中大量新的菌株。为人们研究微生物功能及其与宿主间的互作关系提供了菌株资源,使微生物功能研究进入个性化时代。本文主要综述了影响微生物培养的因素、培养组学的分选和鉴定技术、培养组学在动物消化道研究中的应用,为进一步研究动物肠道微生物提供参考依据。
1 影响微生物培养的因素
微生物的代谢网络极其复杂,其生长依赖于非常严格的环境条件,任何偏差都可能导致微生物无法被成功分离和培养。影响微生物人工培养的因素除微生物生长环境条件和营养物质外,主要有微生物间的生态关系和“群体感应(Quorum-Sensing)”、休眠微生物的诱导复苏及低丰度微生物的竞争性。
1.1 微生物间的生态关系和“群体感应”自然环境中微生物间的生态关系复杂多样,主要包括互利共生、互养共栖、共代谢、协同作用、拮抗作用、寄生等。人工培养微生物时,往往忽视或破坏了自然环境中微生物间的生态关系。具有共生或者互养关系的微生物可在共培养条件下稳定生长,但在相同人工培养条件下单独分离培养时,却无法正常生长和存活。产氢细菌(H-Producing Bacteria)和氢利用产甲烷菌(H-Consuming Methanogens)是自然环境中典型的互养共生微生物。Guzman 等使用电化学生物反应器模拟产甲烷菌的共生作用,可成功富集,但完全去除产甲烷菌却无法获得。微生物间的相互接触是保证共生或互养微生物正常生长的重要条件,使用透析膜分隔培养具有共生或互养关系的微生物,其生长速率远低于共培养。另外,微生物具有“群体感应”功能,可以依据特定的信号分子(如环磷酸腺苷和酰基高丝氨酸内酯等)浓度,判断环境中其他微生物数量的变化,通过诱导菌体中相关基因的表达来适应环境。当微生物从自然环境被转移到人工培养条件下时,“群体感应”系统可通过一系列协调应答反应,促进适应性强的微生物快速生长,但适应性较弱或生长速度较慢的微生物或因营养物质不足而受到抑制。
1.2 休眠微生物的诱导复苏 休眠是一种低代谢活动的可逆状态,很多与人类健康密切相关的微生物(如能够引起炭疽、结核病和霍乱的细菌)遇到有压力的环境就会进入此状态。不少种类微生物还会产生特殊的休眠构造。由于休眠微生物特殊的休眠结构和代谢机制,休眠的微生物需要在特定条件下进行诱导复苏,但这一过程具有随机性,加大了人工分离培养的难度。Dworkin等研究证明,一些信号分子以及微生物间的互作等都有可能影响休眠微生物的复苏。因此,深入探究休眠微生物的形成机制,开发诱导复苏休眠体的方法,对人工分离培养这类微生物至关重要。
1.3 低丰度微生物的竞争性 低丰度微生物在维持生态系统稳定和物质循环中同样发挥着重要的作用。为了提高低丰度微生物人工分离培养的成功率,人们通常借助已公开发表的16S rRNA 基因测序数据,获得目标微生物生存的最佳环境(即相对丰度最高的环境),从最佳环境中对其进行富集分离。但是,当对已分离的目标微生物进行培养时,环境中有生长优势的共培养微生物往往可以利用培养基中的营养物质快速生长,迅速成为高丰度微生物,代替目标微生物占据主导地位,从而导致目标微生物难以被成功培养。从环境中分离单细胞作为接种体(Inocula)进行培养,是近年来开发的分离培养低丰度微生物较为有效的方法。另外,对于寡营养的低丰度微生物,使用营养成分较低的培养基进行培养,在一定程度上可以抑制生长速度较快的共培养微生物生长。
模拟自然环境条件,使微生物生长在适宜浓度的环境因子中,是成功分离、培养目标微生物的关键因素。但由于传统微生物纯培养技术的局限性以及目前对微生物生长特性掌握的片面性,使人工培养条件无法完全还原微生物生长的自然环境,无法完全提供微生物生长所需的全部营养物质。针对传统培养技术缺陷问题,近年来,科学家们开发出一系列微生物培养的新技术,使越来越多自然环境中的新菌株可被分离、培养和鉴定。
2 培养组学的分选和鉴定技术
培养组学(Culturomics)通常指基于已有的微生物基因组测序数据,获得目标微生物的最佳生存环境,从最佳环境中富集目标菌株/菌群细胞,通过多重培养方法对已富集的菌株/菌群进行分离培养,以获取培养物,并结合基质辅助激光解析电离质谱(MALDI-TOFMS)和16S rRNA 基因测序等新生检测技术,对培养物加以鉴定,是新兴的微生物培养方法学(图1)。
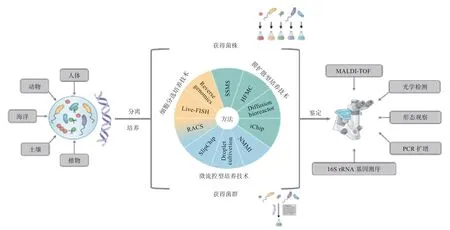
图1 微生物培养组学技术的工作流程[3]
2.1 培养组学的技术 分离是获得微生物纯培养物的关键步骤。为了实现高通量分离培养单一菌株或分离培养具有特定生物功能的菌群,培养组学主要采用的分离方法有膜扩散型培养技术、微流控型培养技术和细胞分选培养技术(表1)。

表1 培养组学的分选技术及其特点
2.1.1 膜扩散型培养技术 膜扩散型培养技术使用特定孔径的滤器或隔膜装置,将微生物细胞与原生环境进行物理分隔,原生环境中的生长因子可通过孔径进入装置,为微生物细胞生长提供所需的营养物质。
土壤基质膜系统(Soil Substrate Membrane System,SSMS)是一种利用膜扩散型培养技术分离培养土壤中功能微生物的装置。该装置将土壤悬浮液中分离的微生物细胞接种在基质膜上,覆盖在可为微生物提供生长因子的土壤上层,进行培养并获得目标微生物的菌落。Sipkema 等利用与SSMS 类似的原理,使用漂浮过滤培养法(Floating Filter Cultures),成功从海水样本中分离培养出海绵体()sp.。
中空纤维膜室装置(Hollow-Fiber Membrane Chamber,HFMS)是一种将大量中空纤维管与细胞隔离室连接的细胞培养装置,纤维管可通过连续稀释环境中的细胞悬浮液来获得单细胞个体,并使其在原生液体环境下进行培养。
分离芯片(isolation Chip,iChip)以及一些衍生装置通常由许多小孔室组成,是一种可以实现从环境中高通量分离培养多种微生物细胞的装置。人们将琼脂稀释的单一或几种混合微生物分别加入到iChip 小孔室中,置于自然环境中进行培养,iChip 两侧的半渗透树脂膜可以使营养因子和其他物质从周围环境中进入到小孔室内,并阻止环境中其他微生物进入,为微生物细胞提供生长所需的全部营养物质。Ling 等通过使用iChip 从土壤中分离、培养出许多新的菌株,并发现一种新型抗生素——滴虫肌动蛋白(Teixobactin)。
膜扩散生物反应器(Diffusion Bioreactor)是一种适用于微生物大体积培养的装置,由内外两层腔室组成,内层是微生物细胞培养室,外层可为内层微生物细胞生长提供环境因子。利用膜扩散生物反应器,自然环境中的微生物细胞可以快速生长、增殖,为后续菌株单细胞分离提供试验材料。
膜扩散型培养技术可以为微生物生长提供最适宜的生长环境,克服了传统微生物人工培养无法完全提供微生物生长所需全部营养物质等局限。利用膜扩散培养技术,微生物细胞不仅可以进行原位培养,也可以与共生或互养关系的微生物进行共培养。另外,微生物生长过程中产生的潜在抑制生长的代谢产物,可以透过孔径扩散到环境中,避免了由于聚集而产生的毒害作用。
2.1.2 微流控型培养技术 微流控芯片技术可以在芯片大小的区域内实现多数生物化学实验室的基本功能,被喻为“芯片实验室”。因其具有微型化、自动化、多样化、高通量、可扩展、低消耗、所需样本体积小、反应速率快等优点,被广泛应用于生命科学领域。利用微流控型技术进行微生物细胞培养,不仅可以对微生物生长条件、培养时间等进行精确调控,实时监测微生物的形态变化,还可以实现在不同生长条件和营养因子下,同时对微生物单细胞进行培养。另外,一些微流控芯片可以通过控制芯片中氧气的含量,对厌氧微生物进行培养。
滑移芯片(SlipChip)一般由两块含通道和小孔的微流控芯片紧密连接构成。其核心特征在于通过两块芯片的相对滑动,改变不同的通道结构,来实现通道和小孔不同的连接状态,从而执行不同的处理和操作。当两块芯片紧密接触时,微生物单细胞可以在装有不同营养因子的滑移芯片小孔中进行高通量培养;当滑动分离时,两块芯片可以成为独立的单块单层微流控芯片,一块可用于观察微生物生长或分类鉴定等,另一块可继续进行微生物高通量培养。Ma 等利用该技术,首次成功从人体消化道中分离出瘤胃球菌属()。
纳米微孔微生物孵化器(Nanoporous Microscale Microbial Incubator,NMMI)是由多个具有膜扩散功能小孔组成的微流控芯片系统。微生物单细胞可以在小孔中单独生长,周围环境因子及共生微生物的代谢产物可以通过隔膜进入小孔为微生物生长提供营养物质。NMMI 将微流控型培养技术和膜扩散型培养技术相结合,克服了微流控技术无法为目标微生物生长提供原生环境和共生伙伴的局限性。
液滴微流控培养(Droplet Cultivation)技术是一种操作微小液体体积的技术,可以通过无限稀释法(Dilution-To-Extinction)将单个微生物分散到微液滴中,每个微液滴单元可以作为独立微反应器进行微生物培养。液滴微流控培养技术具有高效的微生物分散能力,可以高通量、高效率、低成本的构建大规模单菌株培养阵列,从而实现目的微生物的选择性扩增。
2.1.3 细胞分选培养技术 微生物细胞分选技术主要包括传统涂布法(Spreading)、光学镊子(Optical Tweezers),以及微体积、高通量的液滴法(Droplet-Based)、微流控法(Microfluidic-Based)和流式细胞术(Flow Cytometry)等。
荧光激活细胞分选(Fluorescence-Activated Cell sorting,FACS)技术是一种利用组织自身荧光信号或通过与荧光染料结合,对单细胞进行定量分析和分选的技术,近年来广泛应用于微生物细胞的分选和检测。
荧光原位杂交(FISH)技术可以通过荧光标记,快速识别、定量特异的微生物细胞。被FISH 技术标记的微生物细胞可以通过FACS 技术进行分离培养,并用于后续高通量测序分析。但是化学固定以及荧光染料和标记探针等都会影响微生物的活性和细胞通透性。Batani 等通过改进传统FISH 技术,省略化学固定等操作步骤,成功将标记探针导入到活的微生物细胞中,并通过FACS 技术,从海水样本中分离出活的-变形杆菌(),但是其细胞成活率仍然处于较低水平(1.24%~2.82%)。
反向基因组学(Reverse Genomics)可以对新的目标微生物细胞进行标记,并维持其细胞活性。首先,对目标微生物进行单细胞基因测序,鉴定出编码胞外膜蛋白的基因,筛选胞外膜蛋白上的特定表位,合成靶蛋白结构域抗原,然后将抗原接种到受体体内进行免疫反应产生抗体,纯化抗体并使用荧光染料进行标记,接着将荧光标记的抗体加入到环境样本中,使其对目标微生物细胞进行染色,最后利用FACS 技术对目标微生物细胞进行分离培养。Cross 等通过使用反向基因组学技术,从人体口腔中成功分离培养了3 株归类于候选门级辐射类群(Candidate Phyla Radiation,CPR)细菌的(TM7)菌株。
另外,拉曼活细胞分选(Raman-Activated Cell Sorting,RACS)技术可以利用特定的拉曼谱带作为生物标记物对微生物细胞进行荧光标记,并结合微流控法或光学镊子对拉曼光谱标记的微生物细胞进行分选。RACS 能够实现对微生物细胞进行无损预处理,保证其分选后的细胞具有活性,可被纯培养。
上述这些微生物分离、培养技术的快速发展,使人们从人体和自然环境中获得了大量新的微生物。但精简微生物分离、培养的操作步骤是培养组学进一步发展的关键。
2.2 培养组学的鉴定方法 通过上述培养组学技术分离获得的高通量克隆或微生物细胞,需要同样高通量的鉴定技术对其分类学地位进行快速鉴定,准确筛选出具有生长活性的目标微生物细胞,才能提高目标微生物的培养效率,为后续功能研究等奠定良好的基础。为此,培养组学对应的高通量的鉴定技术有基质辅助激光解析电离质谱(MALDI-TOF-MS)鉴定、16S rRNA 基因扩增测序鉴定和拉曼光谱鉴定。
2.2.1 MALDI-TOF-MS 鉴定 MALDI-TOF-MS 可以通过检测微生物多肽或蛋白质,形成微生物特有的蛋白质质谱峰,通过与数据库中已知的微生物“多肽指纹图谱”进行比对,实现对微生物分类学地位的快速鉴定。因其具有成本低、操作简单、快速、准确、高通量等优点,被广泛应用于微生物的高通量筛选和快速鉴定中。但是,MALDI-TOF-MS 无法同时对混合的微生物进行鉴定,且参考数据库更新较慢。
2.2.2 16S rRNA 基因扩增测序鉴定 16S rRNA 基因存在于全部细菌和古菌基因组中,其可变区序列具有高度异质性,可作为判断物种间差异的依据。通过对目标微生物的16S rRNA 基因全长进行扩增、测序,并通过与16S rRNA 基因数据库进行比对,可以推断目标微生物物种的多样性和相对丰度。16S rRNA 基因扩增测序被广泛应用于鉴定混合微生物培养物或检测连续富集培养的微生物群落,但其测序结果往往受测序深度和引物选择等影响,且不同可变区16S rRNA 基因比对的准确性不同。
2.2.3 拉曼光谱鉴定 拉曼光谱鉴定是近年来发展起来的一种新型微生物鉴定方法,可以通过微生物自身生成的“拉曼光谱指纹图谱”,对其进行快速、准确、无损伤的鉴定。与其他两种鉴定方法相比,拉曼光谱鉴定对微生物样品需要量更少,对菌体无损伤,并且可以对混合的微生物进行鉴定。但是,利用拉曼光谱鉴定微生物仍处于初步发展阶段,其数据库和技术等仍需科学家们不断完善和改进。
3 培养组学在动物消化道研究中的应用及局限性
微生物培养组学使动物消化道中大量未知或“尚未被培养”的微生物的功能得到了深入研究,促进了动物消化道微生物资源的开发和利用。
小鼠是研究消化道微生物种类和功能最常见的模式动物之一,但是大部分小鼠消化道微生物仍未被培养和鉴定。Liu 等对12 只小鼠和12 只C57BL/6J小鼠盲肠中的微生物进行大规模分离、培养和鉴定,通过设计不同种类的固体和液体培养基,设置厌氧和需氧等多种培养条件以及一系列标准化的微生物分离、培养流程,从小鼠盲肠中先后分离获得1 831 个纯培养物,通过对这些纯培养物进行16S rRNA 基因测序鉴定,最终对来自126 种微生物的1 437 个菌株进行扩大培养和菌种保藏,其中,来自43 个属水平的77 个菌株是首次被分离、培养的潜在新微生物。该研究中建立的小鼠消化道微生物资源库(mGMB)覆盖了超过52% 的小鼠消化道微生物宏基因组非冗余基因集;使可分离、培养的小鼠消化道微生物在属水平上从48 种扩大到110 种,在种水平上从76 种扩大到180 种;使小鼠消化道16S rRNA 基因数据库在reads 水平上的覆盖度从18.37%增加到42.20%。
Zhou 等利用微流控高通量单细胞培养(Micro fludic Streak Plate,MSP)技术,从白蚁消化道中共成功分离获得99 个OTU 分类单元,其中18 个OTU 分类单元是首次在白蚁消化道中被报道;分离培养出396 个微生物,主要是来自于属、属和属的新菌株。
Medveck 等利用添加了30%瘤胃液的Wilkins-Chalgren 厌氧菌肉汤培养基,在厌氧条件下,对鸡盲肠中的微生物进行分离、培养,共获得204 个纯培养物,通过对这些纯培养物进行全基因组测序分析和鉴定,最终获得来自7 个门的133 个厌氧菌株,其中84 个属于厚壁菌门、29 个属于拟杆菌门、15 个属于放线菌门、2 个属于变形菌门、1 个属于疣微菌门、1 个属于Elusimicrobia 门、1 个属于Synergistetes 门。该研究建立的菌株资源库,为鸡消化道功能益生菌的开发提供了丰富的菌株资源。Duquenoy 等根据微生物的不同特性,如有无孢子、是否需要氧气等,设置了不同类型的固体培养基,对鸡盲肠中的微生物进行分离、培养,最终获得了347 个纯培养物,经过MALDI-TOF-MS 和16S rRNA 基因测序技术鉴定,发现这347 个纯培养物至少归类于60 个菌种。
董等利用培养组学方法对3 头断奶前后仔猪回肠和结肠中的细菌进行高通量分离、培养和鉴定,通过25 种不同类型培养基,分别在有氧和厌氧条件下对样品进行富集培养,共筛选获得包括梭杆菌、拟杆菌等较难分离的菌株和乳酸菌等在内的1 385 株厌氧、好氧和兼性厌氧细菌及116 个疑似新菌株。
培养组学技术的应用,在反刍动物消化道微生物分离、培养中鲜有报道。Zehavi 等在改良的M10 培养基中添加30 mL 厌氧蒸馏处理的瘤胃液,在厌氧培养箱中(5% H、20% CO、75% N)获得的纯培养物约占牛瘤胃中微生物总OTU 数的23%~40%。该研究发现,样品稀释的倍数和培养基类型是影响瘤胃微生物在琼脂培养基上生长的关键因素。
培养组学技术已经在动物消化道微生物研究中得到了应用,但仍处于初步发展阶段。通过培养组学技术获得的大量新菌株,不仅丰富了动物消化道微生物数据资源库,为深入挖掘消化道微生物功能、阐明宿主与消化道微生物的关系等提供重要信息,也为开发具有潜在利用价值的益生菌提供了重要的菌株资源和基因资源。
但培养组学作为微生物研究的新兴方法,仍存在许多不足之处:无法对形成生物膜的微生物进行分离;无法分离固体样品(如土壤、沉积物和粪便等)中的微生物;难以实现对厌氧微生物的分离培养,也无法为微生物提供生长所需的气体基质。总的来说,大多数培养组学方法依赖于复杂的实验操作以及精密的实验条件,明确微生物生存的最佳环境条件,精简微生物分离培养的操作程序,开发、优化多种微生物鉴定方法,是微生物培养组学进一步发展的关键。
5 小 结
高通量测序技术的迅猛发展,使人们忽视了对微生物的分离培养。近年来微生物培养组学技术的快速兴起,足以说明微生物培养在微生物功能研究以及对微生物资源开发和利用中的重要性。微生物培养组学技术的发展,极大提高了复杂生境中微生物的可培养性,极大增加了新菌种的数量,为深入探究微生物功能与宿主间的作用关系、微生物资源的开发利用提供了原材料。虽然微生物培养组学技术相较于高通量测序技术,程序繁琐且工作量大,但是其在微生物研究中发挥的重要作用显而易见。
