内生细菌Pantoea alhagi NX-11及其胞外多糖对低温胁迫下水稻苗的促生效应
2022-05-16赵友学杨燕波朱宇峰张国庆薛听听孙良雷鹏徐虹冯小海许宗奇
赵友学 杨燕波 朱宇峰 张国庆 薛听听 孙良 雷鹏 徐虹 冯小海 许宗奇

摘要:以1株高產胞外多糖的内生细菌Pantoea alhagi NX-11为研究对象,通过构建的多糖分泌缺失菌株NX-11eps-以及分离到的胞外多糖(EPS)纯品,研究菌株NX-11及其胞外多糖对低温胁迫下水稻苗的促生效应。结果表明,菌株NX-11显著缓解了低温胁迫导致的水稻苗茎长、根长、鲜质量、干质量和相对含水量的降低。对其作用机制研究发现,NX-11通过诱导水稻苗内抗氧化酶活性提高显著降低了低温胁迫对水稻苗的氧化伤害;通过增强水稻苗脂肪酸去饱和酶(FADS)活性,提高了膜脂的不饱和度和双键指数,增强了膜脂流动性;通过影响水稻苗的激素合成,进而增强水稻苗在低温胁迫环境下的调控能力,增强其低温耐受性。与NX-11相比,低温胁迫下,多糖分泌缺失的菌株NX-11eps-对水稻苗的促生效应降低,而胞外多糖纯品表现出与NX-11一致的促生效果,表明NX-11胞外多糖在增强水稻苗低温耐受性的过程中发挥了关键作用。
关键词:Pantoea alhagi;水稻苗;胞外多糖;低温胁迫;低温耐受性
中图分类号:S432.4+2文献标识码:A文章编号:1000-4440(2022)02-0296-08
Effects of endophytic bacterium Pantoea alhagi NX-11 and its extracellular polysaccharides on the growth of paddy rice seedlings under low temperature stress
ZHAO You-xue YANG Yan-bo ZHU Yu-feng ZHANG Guo-qing XUE Ting-ting SUN Liang LEI Peng XU Hong FENG Xiao-hai XU Zong-qi
Abstract:In this study, the endophytic bacterium Pantoea alhagi NX-11 with high extracellular polysaccharide production was used as the research object. The growth-promoting effects of strain NX-11 and its extracellular polysaccharides on rice seedlings under low temperature stress were studied by constructing polysaccharide secretion deficient strain NX-11eps- and adding the isolated pure extracellular polysaccharide (EPS). The results showed that strain NX-11 significantly relieved the decrease of stem length, root length, fresh weight, dry weight and relative water content of rice seedlings caused by low temperature stress. The research on the action mechanism showed that, NX-11 significantly reduced the oxidative damage to rice seedlings under low temperature stress by inducing the increase of antioxidant enzyme activities in rice seedlings. The unsaturation degree and double bond index of membrane lipids were improved, and the fluidity of the membrane lipids was increased by enhancing the activity of the fattyacid desaturases (FADS) of the rice seedlings. The hormone synthesis of the rice seedlings was affected to enhance their regulation ability under the environment of low temperature stress, and to enhance their tolerance of low temperature. Compared with NX-11, under low temperature stress, the growth-promoting effect of polysaccharide secretion deficient strain NX-11eps- to rice seedlings was reduced, while the pure exopolysaccharide showed the same growth-promoting effect as NX-11, suggesting that exopolysaccharide of NX-11 played a key role in enhancing the low temperature tolerance of rice seedlings.
Key words:Pantoea alhagi;rice seedling;extracellular polysaccharide;low temperature stress;low temperature tolerance
因强冷空气及寒潮侵入造成的短时间内气温急剧下降引起的低温冷冻灾害,是一种使作物因环境温度过低而受到损伤以致产量降低的农业气象灾害。按照灾害发生的季节区分,影响农业生产的低温灾害天气主要包括倒春寒、寒露风、寒潮等。其中,倒春寒是指春天(一般在3-5月)发生的农作物持续遭受冻害的天气气候现象,是一种非常常见的农业气象灾害。水稻是中国的主要粮食作物,种植面积和总产量分别占粮食作物总种植面积和总产量的27.4%和36.1%[1]。同時水稻是一种喜温型粮食作物,因此中国主要的水稻种植区分布在淮河以南,一般在3-4月份播种,而这段时间内水稻苗容易遭遇“倒春寒”导致的低温环境胁迫,造成稻苗生长受阻,严重时甚至会造成稻苗死亡,粮食减产减收[2]。
许多研究发现,一些植物促生菌(Plant growth-promoting rhizobacteria,PGPR)能够缓解低温胁迫对植物的伤害,提高植物耐寒能力[3-5]。例如Subramanian等[6]在冬季农田土壤中筛选到40株具有低温耐受性的菌株,分别来源于节杆菌属(Arthrobacter)、黄色单胞菌属(Flavimonas)、黄杆菌属(Flavobacterium)、马赛菌属(Massilia)、地杆菌属(Pedobacter)、假单胞菌属(Pseudomonas)等菌属,其中4个分离株(OS211、OB146、OB155和OS261)在15 ℃低温胁迫下均能显著提高番茄的萌发率和生长性能,使番茄叶片中脯氨酸合成量和膜损伤减少,抗氧化酶活性降低,表现出显著的低温耐受性。Turan等[7]将巨大芽孢杆菌(Bacillus megaterium) M3、枯草芽孢杆菌(Bacillus subtilis) OSU142、巴西固氮螺菌(Azospirillum brasilense) Sp245、土生拉乌尔菌(Raoultella terrigena) 4种促生菌接种于小麦和大麦上,发现它们可以通过改变矿物质吸收提高叶绿素含量、光合活性和相对含水量以及降低膜损伤等,诱导植物的寒冷耐受性增强。
随着越来越多的PGPR被分离培养,研究者发现其中相当一部分(包括细菌和真菌)都具有分泌胞外多糖(Exopolysaccharide,EPS)的特性。这些胞外多糖在单糖组成、连接方式上呈现出多样性,这也使得其具有丰富的功能性和独特的生物学活性。而近些年的研究结果表明,PGPR胞外多糖的这些生物活性在影响宿主植物的生理及生长方面,也发挥着重要的作用。Alami等[8]发现,在干旱条件下接种分泌胞外多糖的根瘤菌YAS34显著提高了向日葵根系上黏附土壤的体积,增强了向日葵对干旱环境的耐受能力。Ashraf等[9]发现给作物接种一些能分泌胞外多糖的根际内生菌,可以减少盐胁迫下作物对Na+的吸收,降低Na+对作物的毒害效应,并认为这与胞外多糖具有聚阴离子属性并能够结合阳离子的特性有关。
本研究团队前期从滩涂海水稻根际筛选到1株高产胞外多糖的内生细菌Pantoea alhagi NX-11[10],拟考察NX-11对水稻苗低温抗性的影响,并通过构建的多糖分泌缺失菌株以及分离到的胞外多糖纯品,研究NX-11胞外多糖发挥的作用。
1材料与方法
1.1菌株
野生菌Pantoea alhagi NX-11是从海水稻根际分离出来的1株水稻内生细菌,保藏于中国普通微生物菌种保藏管理中心(CGMCC,No.15525),具有较强的胞外多糖分泌能力,发酵培养基中,胞外多糖产量可达12 g/L以上。
Pantoea alhagi NX-11eps-是野生菌株NX-11通过CRISPR/Cas 9无痕编辑系统敲除了胞外多糖合成关键基因(pspD)构建的,其胞外多糖产量降低至0.6 g/L[11]。
1.2发酵液的制备
挑取单菌落至液体LB培养基中,37 ℃ 200 r/min过夜培养。随后以4%接种量接种于发酵培养基(10 g/L蛋白胨、10 g/L NaCl、5 g/L酵母提取物、40 g/L蔗糖)中,37 ℃ 200 r/min发酵24 h,即得发酵液。
1.3胞外多糖的提取
将P.alhagi NX-11的发酵液用3倍体积的超纯水稀释,与硅藻土充分混合抽滤除菌,再将滤液浓缩至初始体积的1/3,随后用Sevag试剂(异戊醇∶三氯甲烷=1∶4,体积比)脱蛋白3次,水相在4 ℃下用终浓度为80%的乙醇沉淀过夜,沉淀冻干得到胞外多糖。
1.4水稻苗培育与样品收集
水稻种子由江苏省农业科学院馈赠。将种子用0.1%的氯化汞溶液浸泡表面消毒20 min后,用无菌水冲洗3~5次,置于水培盒中(每盒800粒种子,水培盒中的水为无菌水,总共24盒)并于24 ℃黑暗环境下催芽2~3 d。然后将水培盒中的水替换为1/2 MS营养液(每盒约1.5 L),置于人工气侯室培养,其中,光∶暗=14 h∶8 h,温度周期24 ℃∶20 ℃,湿度为 65%,光照度为4 000 lx。至水稻幼苗长出2张叶片(约14 d)后,随机挑选15盒长势相似的水稻幼苗,将其随机等分为5个处理:NT-Control组,向水培液中加入10 ml灭菌后的发酵培养基(常温培养);LT-Control组,向水培液中加入10 ml灭菌后的发酵培养基(低温培养);LT-NX-11组,向水培液中加入10 ml NX-11发酵液;LT-NX-11eps-组,向水培液中加入10 ml NX-11eps-发酵液(NX-11发酵液和NX-11eps-发酵液的OD600均为4.1);LT-EPS组,向水培液中加入10 ml NX-11胞外多糖纯品水溶液,胞外多糖质量浓度为12 g/L。
按照上述处理,将水稻苗培养48 h。48 h后,将所有处理中的水培液更换为1/2 MS营养液,开始模拟低温胁迫:将NT-Control组置于24 ℃气候箱中;LT-Control组、LT-NX-11组、LT-NX-11eps-组、LT-EPS组置于10 ℃气候箱中。2个气候箱的其他参数设置一致:湿度=65%,光∶暗=14 h∶8 h,光照度=4 000 lx。试验过程中1/2 MS营养液每隔2 d更换1次。
模拟低温胁迫后的0 h、24 h、48 h、72 h、96 h和120 h,在每组处理中随机选取30株水稻幼苗用于内源激素检测等相关检测。胁迫结束后,再从各处理中随机选取30株水稻苗用于根长、茎长、鲜质量、干质量等表观指标的检测,各处理剩余样品置于液氮中冻存。
1.5水稻苗的表观生长指标测定
用直尺测量水稻根长和茎长,用分析天平测量水稻鲜质量。水稻含水量的测定:将每组水稻苗浸入纯水中,使水稻吸水饱和(约24 h),将水稻叶表面水珠用吸水纸擦干并称质量,为饱和鲜质量;然后,将水稻幼苗置于60~80 ℃的烘箱中,干燥至恒质量后称质量(约72 h),为水稻干质量;水稻幼苗的相对含水量=(鲜质量-干质量)/(饱和鲜质量-干质量)[12]。
1.6水稻苗的生化指标测定
参照李仕友[13]的方法进行水稻苗丙二醛(MDA)含量的测定。参照Xia等[14-15]的方法进行水稻幼苗H2O2浓度的测定。参照Lei等[16]的方法进行过氧化物酶(POD)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPX)、抗坏血酸过氧化物酶(APX)酶活性测定。使用南京草本源生物科技有限公司试剂盒测定脂肪酸去饱和酶(FADS)的活性。参考Ur等[17]的方法进行脂肪酸的提取。参照Baltruschat等[18]的方法进行脂肪酸含量的相关测定,并测定其不饱和度(UFA/SFA=不饱和脂肪酸相对含量/饱和脂肪酸相对含量)和双键指数[DBI=∑(各个不饱和脂肪酸相对含量×双键数目)/饱和脂肪酸相对含量]。水稻样品中植物激素ABA(脱落酸)、JA(茉莉酸)和SA(水杨酸)的含量使用南京草本源生物科技有限公司的酶联免疫试剂盒测定。植物样本的提取方式参照粗酶液的提取,然后按照试剂盒的说明书操作。在波长为450 nm的条件下测定吸光度,并计算样品的质量浓度。
2结果与分析
2.1NX-11及其胞外多糖对水稻苗低温耐受性的影响
如表1所示,低温胁迫(LT-Control)抑制了水稻生长,其茎长、根长、鲜质量、干质量和相对含水量相比常温对照组(NT-Control)分别显著下降。与LT-Control组相比,LT-NX-11组的茎长、根长、鲜质量、干质量和相对含水量显著提高,表明菌株NX-11能够提高水稻苗的低温耐受性。与LT-Control组相比,LT-NX-11eps-组茎长、根长、鲜质量、干质量和相对含水量均显著提高,这表明多糖缺失显著降低了NX-11的促生活性。与LT-Control组相比,LT-EPS组的5个指标显著提高,这进一步验证了在NX-11增强水稻苗低温耐受性的机制中,其胞外多糖作为一种活性成分,发挥了至关重要的作用。
2.2低温胁迫下NX-11及其胞外多糖对水稻苗氧化伤害的缓解作用
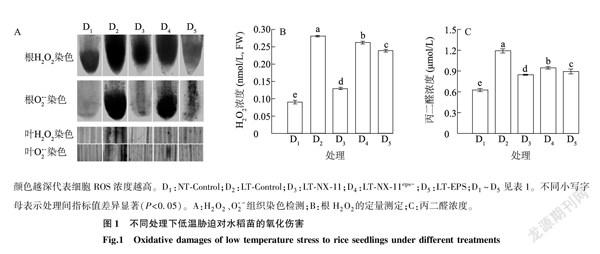
活性氧(ROS)是生物細胞内有氧代谢过程的产物。在正常情况下,植物体内ROS的产生与清除处于动态平衡,而在低温等胁迫环境中,这种平衡被破坏,导致ROS过量积累。过量的ROS与细胞蛋白质、DNA和脂质相互作用会引起氧化损伤,并破坏细胞的正常功能。H2O2是ROS的主要成分之一,如图1A所示,与常温组(NT-Control)相比,低温对照组(LT-Control)H2O2浓度显著提高,这表明低温胁迫使水稻苗受到了较大的氧化伤害。与LT-Control相比,LT-NX-11组、LT-NX-11eps-组、LT-EPS组水稻苗H2O2浓度分别显著降低了53.75%、6.54%、14.72%,这表明菌株NX-11可以促进低温胁迫导致的ROS的清除,有利于降低ROS对细胞的伤害作用;多糖分泌能力的缺失,会降低NX-11在低温胁迫下对水稻苗ROS的清除能力;单独施用多糖纯品水溶液也能提高水稻苗清除ROS的水平。图1A为染色法测定的水稻根部和叶片中H2O2和O2·-浓度,颜色越深代表细胞ROS浓度越高,其结果与图1B一致。丙二醛(MDA)是细胞脂类过氧化的终产物,常用来反映植物遭受逆境伤害的程度。图1C表明,低温胁迫导致水稻苗MDA浓度显著升高,与LT-Control相比,LT-NX-11组、LT-NX-11eps-组、LT-EPS组水稻苗MDA浓度显著降低,进一步表明NX-11可以缓解低温胁迫对水稻苗的氧化伤害,并且其功效与其分泌的胞外多糖密切相关。
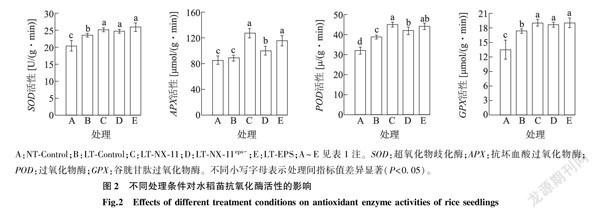
如图2所示,低温胁迫显著提高了SOD、POD、GPX的活性,这是植物自身应对环境胁迫的主动反应。与LT-Control组相比,经过NX-11、NX-11eps-以及EPS处理之后,SOD活性均显著提高。POD、GPX活性的变化与SOD相似。低温胁迫虽然没有显著提高APX的活性,但经过EPS、NX-11与NX-11eps-处理,其活性也显著提高。经过EPS、NX-11以及NX-11eps-处理均可以提升水稻幼苗中与抗氧化相关的酶的活性。结果表明,NX-11能够降低低温胁迫对水稻苗的氧化伤害,可能与其诱导水稻苗内抗氧化酶活性提高有关,并且其诱导水平受到胞外多糖的影响。
2.3低温胁迫下NX-11及其胞外多糖对水稻苗膜脂的保护作用
由表2可知,低温胁迫使得水稻中脂肪酸的不饱和度(UFA/SFA)和双键指数(DBI)下降,与NT-Control组相比,分别显著下降了8.71%、10.16%。相比LT-Control组,菌株NX-11处理使得脂肪酸的不饱和度与双键指数有显著提高,分别提升了26.59%、26.94%。与LT-NX-11组对比,胞外多糖处理组(LT-EPS)在脂肪酸不饱和度与双键指数上无显著差异,而LT-NX-11eps-组则表现为显著下降。结果表明,NX-11能够影响水稻苗膜脂的组成,提高脂肪酸的不饱和度和双键指数,维持细胞膜在低温环境下的流动能力。菌株NX-11对膜脂的保护作用与其分泌的胞外多糖有关。
为进一步探究NX-11及其胞外多糖影响水稻苗膜脂组分的作用机制,本研究考察了不同处理下,水稻苗FADS的活性变化。由图3可知,低温胁迫显著提高了FADS活性。相比于LT-Control组,LT-NX-11组和LT-EPS组FADS活性提升较为显著,分别达到了LT-Control组的2.0倍、1.5倍。LT-NX-11eps-组的FADS活性与LT-Control组相比也有显著提升,但是提升程度显著低于LT-EPS组和LT-NX-11组。结果表明,NX-11及其胞外多糖可以通过增强水稻苗FADS活性,提高膜脂的不饱和度和双键指数,增强膜脂流动性,在低温环境下维持细胞形态。
2.4低温胁迫下NX-11及其胞外多糖对水稻苗抗逆激素的影响
植物激素参与植物对各种生物胁迫和非生物胁迫的响应,在调节植物发育和信号传递网络过程中发挥着重要作用。ABA、SA和JA是植物重要的抗逆激素。本研究检测了各处理组在处理0 h、24 h、48 h、72 h、96 h和120 h时的水稻苗中SA、ABA、JA含量。由图4可知,在低温胁迫的72 h内,各处理组中的水稻苗激素含量基本无显著差异。当低温胁迫到96 h以后,LT-Control组的ABA、JA、SA含量较常温处理组显著降低,这表明低温胁迫降低了植物合成激素的水平,抑制了植物通过自我调控应对胁迫的能力。与LT-Control组相比,LT-NX-11组、LT-NX-11eps-组和LT-EPS组的SA、ABA、JA含量尽管出现了动态波动,但整个处理期基本维持在相对较高的水平。结果表明,菌株NX-11及其胞外多糖可能通过影响水稻苗的激素合成,进而增强水稻苗在低温胁迫环境下的调控能力,增强其低温耐受性。
3讨论
低温灾害是对中国农业经济有重要影响的非生物胁迫因子[19-20]。尽管现在全球面临气候变暖的趋势,但低温冷害气候也时有发生,特别是持续时间较长的突发性低温气候,往往会给农业生产带来巨大经济损失。
一些植物促生微生物一方面能够通过固氮、解磷、解钾等功能提高植物的养分利用效率[21],另一方面它们能够分泌植物激素(如生长素、赤霉素、乙烯等)、抗氧化物等活性物质,提高植物应对环境胁迫的能力[22]。近年来植物促生微生物作为一种绿色高效的微生态肥料,开始备受关注[23-24]。随着研究的深入,越来越多的PGPR被发现能够分泌细胞外聚合物物质或细胞外多糖,形成生物膜,促进其与植物根表面的黏附作用[25]。EPS是PGPR向环境中释放的高分子量聚合物,一般是作为PGPR对不良环境(如高盐[26]、不适温度[27]或重金属污染[28])产生的应对策略,用以保护这些PGPR免受外部环境变化的影响。伴随着近年来兴起的天然活性多糖研究热,这些PGPR胞外多糖的生物活性逐渐被揭示,包括抗氧化、抗肿瘤、抗炎症、抗过敏及益生元活性等多种生物活性。PGPR分泌的EPS可能在缓解植物非生物胁迫方面也发挥重要作用。然而,迄今PGPR胞外多糖自身生理活性与其宿主植物胁迫抗性之间的关系却鲜有报道,特别是涉及PGPR胞外多糖与植物低温抗性之间的研究更是寥寥无几。Kasotia等[29]发现Pseudomonas sp.胞外多糖能够限制土壤Na+的自由流动,通过减少植物对Na+的吸收量缓解盐胁迫对大豆的伤害。Khan等[30]发现,PGPR胞外多糖能够通过维持土壤较高水分含量,缓解小麦干旱胁迫。一些研究发现,低温胁迫可以提升PGPR分泌胞外多糖的能力。例如,来自喜马拉雅山西北部的耐冻假单胞菌在寒冷条件下能够比常温条件下产生更多的EPS[31]。同样的,芽孢杆菌CJCL2和RJGP41可以通过分泌EPS来增强小麦幼苗的抗寒能力,不仅可以使细菌细胞能够在冷胁迫下生存,还可分泌特定的代谢物来保护它们的寄主植物,并促进PGPR在低温环境下的根际定植[32]。此外,低温胁迫会导致植物的脱水和渗透不平衡,改变根系中Na+与K+的浓度比,影响许多代谢酶活性和营养摄取,而PGPR产生的EPS可以螯合Na+,限制根系对Na+的吸收,从而保护植物免受低温介导的脱水[33-34]。本研究中,菌株NX-11分泌的胞外多糖可能作为一种植物生物刺激素或信号类物质,通过影响水稻苗的激素合成,进而提高水稻苗在低温胁迫下的抗氧化酶、脂肪酸去饱和酶等相关抗逆酶活性水平,增强水稻苗在低温胁迫中ROS清除能力,维持膜脂流动性,进而缓解了低温胁迫对细胞的伤害,促进了水稻苗在低温中的生长性能。
低溫胁迫导致水稻苗生长性能降低,本研究考察了菌株NX-11及其胞外多糖对低温胁迫下水稻苗的促生效应。外源施用NX-11及其分泌的EPS缓解了低温胁迫对水稻苗生长的不利影响,通过提高水稻苗内抗氧化酶活性显著降低了低温胁迫对水稻苗的氧化伤害;通过增强水稻苗FADS活性,提高了膜脂的不饱和度和双键指数,增强了膜脂流动性;通过影响水稻苗的激素合成,进而增强水稻苗在胁迫环境下的调控能力,增强其低温耐受性。综上所述,将P. alhagi NX-11或者其分泌物EPS开发成为具有缓解低温胁迫能力的生物肥料具有非常大的潜力。
参考文献:
[1]YOSHIDA S. Fundamentals of rice crop science[M].Laguna:Philippines,1981.
[2]丁旗. 低温天气对水稻育苗的影响及综合预防[J].吉林农业, 2017(15): 99.
[3]孙韵雅,陈佳,王悦,等. 根际促生菌促生机理及其增强植物抗逆性研究进展[J].草地学报,2020,28(5):1203-1215.
[4]姜焕焕,王通,陈娜,等. 根际促生菌提高植物抗盐碱性的研究进展[J].生物技术通报,2019,35(10):189-197.
[5]纪超,王晓辉,刘训理. 盐胁迫环境下植物促生菌的作用机制研究进展[J].生物技术通报,2020,36(4):131-143.
[6]SUBRAMANIAN P, KRISHNAMOORTHY R, CHANRATANA M. Expression of an exogenous 1-aminocyclopropane-1-carboxylate deaminase gene in psychrotolerant bacteria modulates ethylene metabolism and cold induced genes in tomato under chilling stress[J].Plant Physiol Biochem,2015,89:18-23.
[7]TURAN M, GULLUCE M, CAKMAK R, et al. Effect of plant growth-promoting rhizobacteria strain on freezing injury and antioxidant enzyme activity of wheat and barley[J].J Plant Nutr,2013, 36:731-748.
[8]ALAMI Y, ACHOUAK W, MAROL C, et al. Rhizosphere soil aggregation and plant growth promotion of sunflowers by an exopolysaccharide-producing Rhizobium sp. strain isolated from sunflower roots[J].Appl Environ Microbiol,2000,66, 3393-3398.
[9]ASHRAF M, HASNAIN S, BERGE O, et al. Inoculating wheat seedlings with exopolysaccharide-producing bacteria restricts sodium uptake and stimulates plant growth under salt stress[J].Biol Fertil Soils,2004, 40, 157-162.
[10]SUN L, YANG Y, LEI P, et al. Structure characterization, antioxidant and emulsifying capacities of exopolysaccharide derived from Pantoea alhagi NX-11[J].Carbohydrate Polymers, 2021, 261:117872.
[11]SUN L, YANG Y, WANG R, et al. Effects of exopolysaccharide derived from Pantoea alhagi NX-11 on drought resistance of rice and its efficient fermentation preparation[J].International Journal of Biological Macromolecules, 2020, 162(9):46-55.
[12]赵海新. 碱胁迫对水稻叶绿素及叶片脯氨酸和可溶性糖含量的影响[J].作物杂志, 2020(1):98-102.
[13]李仕友. 植物富集铀镉特征及其响应机制试验研究[M]. 衡阳:南华大学,2019.
[14]XIA X J, WANG Y J, ZHOU Y H, et al. Reactive oxygen species are involved in brassinosteroid-induced stress tolerance in cucumber[J]. Plant Physiology, 2009, 150(2): 801-814.
[15]DROGE W. Free radicals in the physiological control of cell function[J].Physiological Reviews, 2002,82:47-95.
[16]PENG L, XU Z Q, DING Y, et al. Effect of poly(γ-glutamic acid) on the physiological responses and calcium signaling of rape seedlings(Brassica napus L.) under cold stress[J].J Agr Food Chem,2015,63:10399-10406.
[17]UR I, SKOCZOWSKI A, NIEMCZYK E, et al. Changes in the composition of fatty acids and sterols of membrane lipids during induction and differentiation of Brassica napus (var. oleifera L.) callus [J]. Acta Physiologiae Plantarum, 2002, 24(1): 3-10.
[18]BALTRUSCHAT H, FODOR J, HARRACH B D, et al. Salt tolerance of barley induced by the root endophyte Piriformospora indica is associated with a strong increase in antioxidants [J]. The New Phytologist, 2008, 180(2): 501-510.
[19]千春录,朱芹,高姗,等. 外源褪黑素处理对采后水蜜桃冷藏品质及冷害发生的影响[J].江苏农业学报,2020,36(3):702-708.
[20]马娟娟,赵斌,陈颖,等. 4个北美冬青品种苗对低温胁迫的生理响应及抗寒性比较[J].南京林业大学学报(自然科学版),2020,44(5):34-40.
[21]张典利,孟臻,亓文哲,等. 植物根际促生菌的研究与应用现状[J].世界农藥,2018,40(6):37-43,50.
[22]麦靖雯,黎瑞君,张巨明. 植物根际促生菌研究综述[J].现代农业科技,2018(12):179-180,183.
[23]官宇,余伟,辜运富,等. PGPR菌剂对砷胁迫下蜈蚣草根际微生物群落的影响[J].江苏农业科学,2020,48(19):275-280.
[24]韦江璐,覃英,谢显秋,等. 促生菌对土壤养分、酶活性及细菌群落功能多样性的影响[J].南方农业学报,2020, 51(10):2348-2357.
[25]纪超,王晓辉,刘训理. 盐胁迫环境下植物促生菌的作用机制研究进展[J].生物技术通报,2020,36(4):131-143.
[26]UPADHYAY S K, SINGH J S, SINGH D P,et al. Exopolysaccharide-producing plant growth-promoting rhizobacteria under salinity condition[J]. Pedosphere,2011, 21:214-222.
[27]NANDAL K, SEHRAWAT A R, YADAV A S, et al. High temperature-induced changes in exopolysaccharides, lipopolysaccharides and protein profile of heat-resistant mutants of Rhizobium sp. ( Cajanus )[J]. Microbiological Research,2005,160(4):367-373.
[28]PULSAWAT W,LEKSAWASDI P, ROGERS L, et al. Anions effects on biosorption of Mn(Ⅱ) by extracellular polymeric substance (EPS) from Rhizobium etli[J]. Biotechnology Letters,2003,25(15):1267-1270.
[29]KASOTIA A, VARMA A, TUTEJA N, et al. Amelioration of soybean plant from saline-induced condition by exopolysaccharide producing Pseudomonas-mediated expression of high affinity K+ transporter (HKT1) gene[J]. Current Science,2016,111(12):1961-1967.
[30]KHAN N, BANO A. Exopolysaccharide producing rhizobacteria and their impact on growth and drought tolerance of wheat grown under rainfed conditions[J]. PLoS One,2019,14(9):1267-1270.
[31]MISHRA P K, BISHT S C, RUWARI P, et al. Alleviation of cold stress in inoculated wheat (Triticum aestivum L.) seedlings with psychrotolerant Pseudomonads from NW Himalayas[J]. Archives of Microbiology,2011,193(7):497-513.
[32]ZUBAIR M, HANIF A, FARZAND A, et al. Genetic screening and expression analysis of psychrophilic Bacillus spp. reveal their potential to alleviate cold stress and modulate phytohormones in wheat[J]. Microorganisms,2019,7(9):337.
[33]UPADHYAY S K, SINGH J S, SINGH D P. Exopolysaccharide-producing plant growth-promoting rhizobacteria under salinity Condition[J]. Pedosphere,2011,21(2):214-222.
[34]ASHRAF, M, HASNAIN S, BERGE O, et al. Inoculating wheat seedlings with exopolysaccharide-producing bacteria restricts sodium uptake and stimulates plant growth under salt stress[J]. Biology and Fertility of Soils,2004,40(3):157-162.
(責任编辑:陈海霞)
收稿日期:2021-07-28
基金项目:国家自然科学基金青年科学基金项目(3180011491);江苏省自然科学基金青年科学基金项目(BK20180158);国家级大学生创新创业计划项目(202110291010Z)
作者简介:赵友学(1999-),山东聊城人,本科,研究方向为根际促生微生物对作物的促生抗逆作用机制。(E-mail)201821019117@njtech.edu.cn
通讯作者:雷鹏,(E-mail)lei-peng@njtech.edu.cn
