深圳湾海域赤潮生物演变及赤潮预警关键因子分析
2022-05-14李丽马方方翟晓辉杨伟思叶鹏浩刘悦
李丽, 马方方, 翟晓辉, 杨伟思, 叶鹏浩, 刘悦,*
深圳湾海域赤潮生物演变及赤潮预警关键因子分析
李丽1, 马方方2, 翟晓辉1, 杨伟思1, 叶鹏浩1, 刘悦1,*
1深圳市海洋发展研究促进中心, 深圳 518029 2清华苏州环境创新研究院, 苏州 215163
2020年5月初,深圳湾海域发生近5年来首次赤潮, 面积达到6 km2, 前期赤潮优势种为中肋骨条藻(), 后期转变为赤潮异弯藻()。布放于深圳湾海域的海洋环境综合浮标自动监测到了赤潮发生过程的海水水质和生态数据变化: 赤潮发生前(4月底)硝酸盐和磷酸盐均大幅升高; 赤潮发生期间, 叶绿素浓度迅速升高, 最高值达到127.1 μg·L-1(5月2日), 海水温度持续升高, 盐度整体下降; 5月4日开始, 赤潮逐渐消散, 当日水温日均值达到28 ℃以上, 风力也开始升高, 盐度则继续降低。经研究分析, 本次深圳湾赤潮的主要调控因素可能是水温, 活性磷酸盐大幅升高可能是引发中肋骨条藻大规模增殖的诱因, 而赤潮后期的陆源水体输入导致的悬浮物增加导致了赤潮快速消亡。本次赤潮优势种从硅藻到针胞藻的转变, 主要原因可能是赤潮前期磷酸盐快速消耗导致的磷供应不足。通过数据分析发现, 近十几年来, 深圳湾海域赤潮生物逐渐从硅藻转变为甲藻及其他藻类, 其原因与海域氮磷比持续升高、磷成为限制因子有关, 故海域赤潮监测预警应重点关注磷酸盐的变化。
深圳湾; 磷酸盐; 赤潮; 中肋骨条藻; 赤潮异弯藻
0 前言
深圳湾位于珠江口东侧, 是一个半封闭感潮海湾, 整个海湾纵深约为14 km, 宽4.5—5.6 km, 平均水深2.9 m[1]。深圳湾海域入海河流众多, 其中深圳河、新洲河、大沙河及元朗河直接排放入湾内。由于河流入海污染物通量较大, 深圳湾水质较差、富营养化程度较高, 近年来深港两市均采取了一系列治理措施[2–4], 海域营养盐自2005年开始整体呈下降态势[5–6], 但由于影响海域污染的因素众多, 根据2018年监测结果, 深圳湾海域3月、5月、8月、10月4次水质监测结果均为劣四类[7], 香港后海湾水质管制区2018年水质整体达标率为53%, 虽然较近10年均值有所提高, 但无机氮和磷酸盐水平仍较高, 湾内无机氮和磷酸盐浓度分别为2.02 mg·L-1和0.13 mg·L-1[8]。
深圳湾由于富营养化程度较高、且水体交换能力较弱, 有利于赤潮生物的生长和聚集。据不完全统计, 1980年至2019年, 深圳湾海域共记录赤潮35次, 其中赤潮大多集中在2000年至2009年间, 2010年至2019年仅发生3次赤潮。在深圳的三湾一口(大亚湾、大鹏湾、深圳湾和珠江口)4个海域当中, 深圳湾赤潮次数相对较少, 但累计赤潮面积最大[9]。深圳湾的富营养化特征导致海域随时有暴发赤潮的潜在风险[10], 其赤潮发生频次低于营养盐较低的深圳大鹏湾海域, 可能是由于陆源排污及潮流冲刷导致的水体悬浮物较多限制了水中浮游植物的光合作用和正常增殖[8], 随着污染治理的加强, 海域透明度升高可能导致赤潮次数增多, 而营养盐的降低则可能导致赤潮生物继续演变。2020年5月初, 深圳湾暴发一次较大规模的赤潮, 赤潮原因种为中肋骨条藻()和赤潮异弯藻(), 这是2015年至今, 深圳湾首次发现赤潮, 本次赤潮暴发的生消原因是什么?深圳湾海域环境特征及赤潮生物是否均已发生变化?这些变化发生之后, 海域赤潮预警应该主要考虑哪些因素?近年来针对这方面的研究较少。本文将结合赤潮期间邻近海域海洋环境浮标连续自动监测数据及赤潮生物的生理生态特征, 对本次赤潮的生消原因进行分析, 并进一步从深圳湾赤潮生物历史演变及其水质变化情况, 分析海域赤潮的发生变化趋势, 以期为深圳湾赤潮的预警提供科学支撑。
1 材料与方法
1.1 赤潮生物的采样与分析
赤潮生物采集采用水采方式。取1 L表层样品, 冷藏保存, 于采样当天在莱卡倒置显微镜(LEICA DMi1)下用0.1 mL浮游植物计数框进行种类鉴定和计数。
1.2 浮标数据采集
本文主要数据来源于深圳湾海洋环境监测浮标的监测数据, 浮标的位置见图1。该浮标搭载海水水质、气象等传感器。其中水质参数、气象参数的监测频率均为1 次·30 min-1; 营养盐监测频率为1 次·4 h-1。本文用于分析的环境参数包括水温、盐度、溶解氧、叶绿素、风速、硝酸盐、活性磷酸盐。浮标的水质监测传感器为美国YSI公司的YSI6600型多参数水质监测仪, 水质传感器海上运行期间均定期(每月1至2次)进行维护、校准和数据比对。
1.3 赤潮历史数据来源
本文所提及的赤潮生物变化的数据来源于已公开发表的著作、文章及历年的海洋环境状况公报。其中, 1980年至2008年, 赤潮记录主要来源于《中国典型海域赤潮灾害发生规律》中深圳海域部分[11], 2009年至2017年赤潮记录来源于广东省海洋环境质量/状况公报[12–13], 2018年至2019年赤潮记录来源于广东省生态环境状况公报[14]。
2 结果与分析
2.1 2020年5月深圳湾赤潮发生过程
2020年4月29日至30日, 浮标自动监测数据显示叶绿素和溶解氧含量较高, 提示海域有赤潮风险。2020年5月2日, 中心技术人员赴现场采样, 鉴定结果显示该海域赤潮生物优势种为中肋骨条藻(); 5月3日, 监测结果发现赤潮优势种转变为赤潮异弯藻(), 赤潮累计面积约为6 km2。5月3日当天, 赤潮中心区域赤潮异弯藻的平均细胞密度为6.7×106个·L-1, 氨氮和硝酸盐浓度分别为2.42 mg·L-1, 活性磷酸盐浓度为0.026 mg·L-1; 5月4日, 现场监测发现赤潮消散。
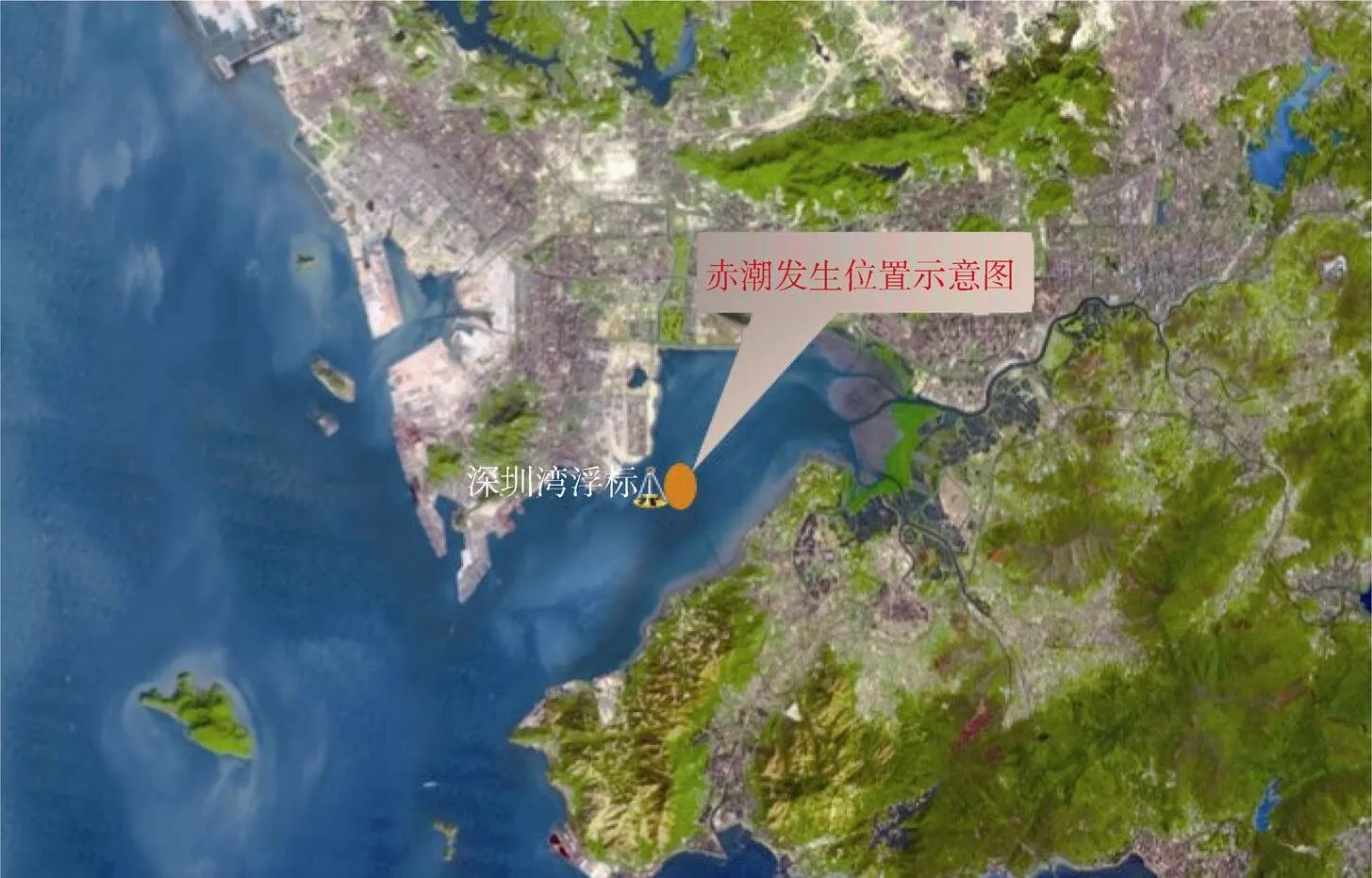
图1 深圳湾浮标站位及赤潮发生位置示意图
Figure 1 Buoy station and location of HAB in Shenzhen Bay
2.2 赤潮发生前后浮标数据变化
深圳湾浮标4月22日至5月5日海洋生态环境相关参数变化见图2至图5。
根据图2中叶绿素变化情况, 将赤潮发生过程分为4个阶段: 赤潮发生前(4月28日之前), 赤潮早期(4月29日至30日), 赤潮暴发期(5月1日至3日)和赤潮消亡期(5月4日至5日); 各阶段水质参数特征值见表1。
赤潮发生前: 4月28日之前, 叶绿素整体较低且变化较小, 除偶有高值外, 大部分时间低于10 μg·L-1, 28日下午叶绿素升高。由于4月22日开始降温, 水温从26 ℃持续下降至22 ℃, 自26日开始, 水温则又波动升高, 至28日水温日均值升高至24.5 ℃; 盐度受潮汐影响波动较大, 但日均值稳定在17—19之间。海域风速(图4)则从23日开始保持稳定, 风力均小于3级。从图5可知, 4月22日至26日, 营养盐总体稳定, 硝酸盐小幅降低、活性磷酸盐则缓慢升高(浮标氨氮数据异常, 不纳入分析), 27日开始, 硝酸盐和活性磷酸盐连续两天大幅升高, 浓度分别升高1倍和1.5倍, 日均值分别达到0.799 mg·L-1和0.219 mg·L-1。
赤潮早期: 4月29日至4月30日, 叶绿素有所升高, 且变化幅度增大, 29日和30日叶绿素日均值分别为20.4 μg·L-1和26.8 μg·L-1, 峰值浓度则达到40 μg·L-1以上。溶解氧变化范围也增大, 尤其4月30日, 叶绿素达到峰值时, 溶解氧最高值达到15 mg·L-1以上。这两日水温继续升高, 4月30日水温日均值为25.5 ℃, 盐度日均值则整体高于上一阶段, 且波动范围较小。营养盐也有较大变化, 活性磷酸盐大幅降低, 降至0.05 mg·L-1, 硝酸盐也有降低, 但降低幅度相对较小。
赤潮暴发期: 从5月1日叶绿素浓度变化可以发现, 明显进入赤潮暴发期。5月1日至3日, 叶绿素日均值在36.9—40.5 μg·L-1之间, 其中5月2日浓度最高, 当日最高值为127.1 μg·L-1; 溶解氧与叶绿素变化趋势保持一致, 日均值在11.78— 12.79 mg·L-1之间, 最高值则出现在5月1日, 可能与当日赤潮生物生长速率最快有关。水温缓慢升高, 日均值从26.0 ℃升高至27.3 ℃, 风速均较小, 风力保持在3级以下, 盐度则大幅降低, 5月1日盐度日均值较前一日下降1.2, 至5月3日, 盐度日均值又下降了3左右, 表明陆源输入突然增加。5月1日活性磷酸盐浓度较前一日降低一半, 之后保持稳定, 其中5月3日浮标磷酸盐日均值为0.022 mg·L-1, 与现场采样监测结果(0.026 mg·L-1)较为一致; 硝酸盐在5月1日和2日大幅下降, 降低了30%左右, 5月3日又有所升高。
赤潮消亡期: 5月4日, 叶绿素突然降低, 峰值浓度降为22.7 μg·L-1, 日均值降至8 μg·L-1以下, 且5月5日继续降低, 溶解氧日均值也随之大幅降低, 5月5日日均值已降至7 mg·L-1。现场监测表明赤潮已消退。水温、盐度延续之前的变化, 水温继续升高, 日均值达到28 ℃以上, 盐度继续下降, 风力则有所增强, 5月5日全天大部分时间风力高于3级。硝酸盐和活性磷酸盐浓度保持稳定。
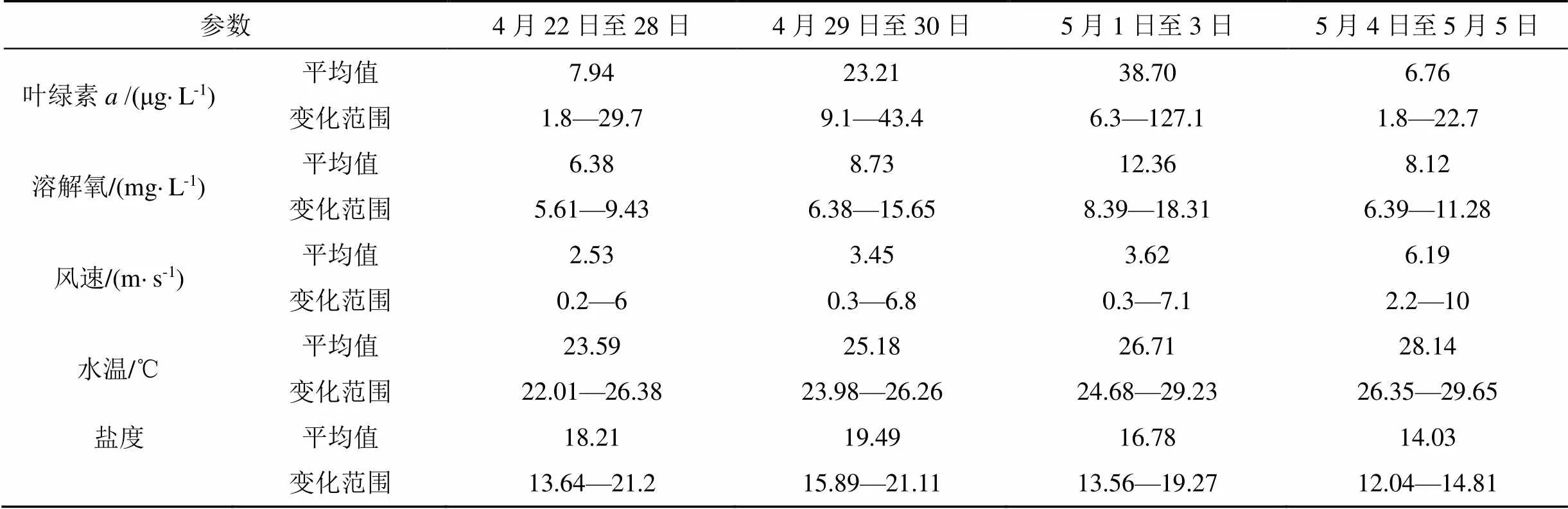
表1 赤潮各阶段浮标主要参数平均值及变化范围

图2 2020年4月22日至5月5日深圳湾浮标叶绿素a、溶解氧变化
Figure 2 Concentrations of chlorophylland dissolved oxygen in Shenzhen Bay during Apr. 22th and May. 5th

图3 2020年4月22日至5月5日深圳湾浮标水温、盐度变化
Figure 3 Variations of water temperature and salinity in Shenzhen Bay during Apr. 22th and May.5th
3 讨论
3.1 本次赤潮生消原因分析
赤潮发生是海洋中多种环境因素综合作用所致, 春季由于水温升高至20 ℃以上, 为赤潮高发期, 且深圳湾海域水体交换较差, 营养盐浓度整体较高, 具备暴发赤潮的基础条件。以下主要结合本次赤潮的水文气象因子和营养盐变化, 对赤潮生消原因进行分析。

图4 2020年4月22日至5月5日深圳湾浮标风速变化
Figure 4 Wind speed variations in Shenzhen Bay during Apr. 22th and May. 5th

图5 2020年4月22日至5月5日深圳湾硝酸盐、活性磷酸盐日均值变化
Figure 5 Daily average variations of nitrate and phosphate concentration in Shenzhen Bay during Apr. 22th and May. 5th
(1) 从第2.2部分数据分析中可以发现, 赤潮发生前水温约为22 ℃, 并持续缓慢升高, 至中肋骨条藻赤潮发生期水温升高至26 ℃。研究表明, 中肋骨条藻是一种广温广盐性藻类, 但其最适增殖温度为24—28 ℃, 在其适温范围内, 水温升高有利于中肋骨条藻的快速增殖[15]。赤潮异弯藻的适温范围同样较广, 25 ℃是其最适生长温度, 但在10—30 ℃之间均能正常生长[16–17]。5月3日, 赤潮优势种转变为赤潮异弯藻, 当日平均水温为27.35 ℃, 在赤潮异弯藻正常生长温度范围内。相关性分析结果表明, 叶绿素与水温、溶解氧呈显著正相关关系(表2), 溶解氧与叶绿素a显著正相关, 与赤潮期间浮游植物光合作用过程中释放大量氧气有关, 因此, 水温可能是本次赤潮的主要调控因素。
(2)由于本次赤潮原因种均可以适应大幅度的盐度变化, 实际上中肋骨条藻更喜低盐[18], 故而盐度下降本身对本次赤潮生消影响不大, 但盐度降低表明陆源输入增加。4月30日之前, 盐度每日呈现周期性变化, 主要为潮汐影响所致; 4月30日开始盐度整体呈下降趋势, 表明持续有陆源淡水输入, 而根据5月3日现场调查数据, 当日赤潮中心区氨氮高达2.42 mg·L-1, 推测为近期陆源污染物大量排入湾内所致。前期陆源污染输入导致的营养盐增加可能对赤潮生物生长起到了一定的促进作用, 而陆源污染的持续输入, 可能导致海域悬浮物增加、透明度下降, 进而影响赤潮生物的光合作用, 这也可能是5月4日赤潮快速消亡的原因之一。

表2 水温、盐度、溶解氧、风速与叶绿素a的相关性
注:**. 表示<0.01。
(3)赤潮发生前活性磷酸盐大幅升高可能是引发中肋骨条藻大规模增殖的诱因。研究显示, 中肋骨条藻属于营养型浮游植物, 氮磷营养盐的添加会极大地促进藻细胞的增殖[19]。根据浮标监测数据, 4月26日至28日硝酸盐和活性磷酸盐浓度升高一倍左右, 尤其是活性磷酸盐, 其在4月22日浓度较低, 低于0.03 mg·L-1, 为贫营养状态, 之后开始缓慢增加, 至4月26日日均值达0.05 mg·L-1, 达到富营养状态, 之后的继续升高为中肋骨条藻快速增殖提供了较为充足的营养基础。由于赤潮发生前浮标氨氮数据异常, 无法判定无机氮整体水平, 但硝酸盐日均值均在0.4 mg·L-1以上, 已经达到富营养的状态, 结合第(2)点中陆源污染输入, 表明海域无机氮较为充足, 不存在N限制, 硝酸盐的升高对赤潮发生起到了促进作用, 但并非直接诱因。
3.2 从本次赤潮优势种变化分析海域长期赤潮生物演变
根据深圳湾赤潮历史记录[11–14], 上世纪80、90年代赤潮生物主要为甲藻, 2000年之后演变为硅藻占优势, 而2005年开始, 甲藻及其他种类引发赤潮次数有所升高, 硅藻藻华开始减少(表3)。赤潮生物的演变与环境因子变化密切相关, 本次赤潮中优势种及营养盐变化, 是海域长期环境变化的结果, 可为海域赤潮生物演变的原因提供一些数据支撑。
从现场5月2日和5月3日的监测数据得知, 赤潮前期优势种为中肋骨条藻, 后期优势种转变为赤潮异弯藻。根据中肋骨条藻的高速增殖特性[20–22]及赤潮前期磷酸盐快速降低, 也可确认本次赤潮生物经历了以硅藻为主到以针胞藻为主的变化。由于中肋骨条藻生长较快, 其藻华通常可以快速暴发, 故而在富营养化严重的海域, 其经常作为优势种首先暴发赤潮, 同时由于生长速率较快, 中肋骨条藻等小型硅藻对N、P、Si的营养需求均较高[23–24], 在消耗掉一定比例的营养盐后, 导致赤潮后期优势种转变为赤潮异弯藻。而4月28日至5月1日活性磷酸盐持续大幅降低可能是中肋骨条藻增殖逐渐加快大量消耗所致, 由于海域以无机磷为主[6], 活性磷酸盐下降至0.03 mg·L-1之后, 其增殖受到严重限制; 而前期生长较慢的赤潮异弯藻则有多种营养策略(利用有机营养盐、混合营养等)[25–26], 并可以通过化感作用抑制中肋骨条藻生长[27], 故而其在低营养盐的条件下也可以保持正常的增殖速度。
深圳湾海域营养盐浓度、比例和成分的变化可能导致了赤潮生物的演变, 体现在本次赤潮中导致了优势种的变化, 体现在长时间周期中, 则导致了海域赤潮生物的演变。深圳湾上世纪80年代至2005年前后赤潮生物从甲藻为主逐步演变为硅藻为主, 与深圳湾海域营养盐浓度持续升高有关, 研究显示80年代至2005年前后, 深圳湾营养盐为波动升高的趋势[9,28–29], 这与深圳的飞速发展和人口快速增长密切相关, 而营养盐充足的海域硅藻更容易成为优势种而引发赤潮。2005年开始, 营养盐则整体为下降趋势[5–8], 部分年份为磷中等限制潜在性富营养状态[9]。有研究表明, 近几十年来中国近海氮输入量不断增加, 而磷输入量不断减少, 磷限制趋势日益严重[30], 临近深圳湾的珠江口海域也是如此[31]。深圳湾海域磷酸盐虽整体较高, 但近年来氮磷比持续升高[9], 相对来说磷成为限制因子, 本次赤潮中也体现出了这一点。营养盐限制的环境可能有利于甲藻、针胞藻等采取K竞争策略的藻类[21,32], 除此之外, 营养盐限制的条件下化感作用更加明显[33–36], 例如, 锥状斯氏藻、海洋原甲藻、赤潮异弯藻均能释放出化感物质, 并对中肋骨条藻生长产生抑制作用。

表3 1980—2019年深圳湾赤潮生物引发赤潮次数统计
3.3 深圳湾海域赤潮预警关键因子分析
影响赤潮的主要因素包括水温、风力、流场、降雨、透明度(影响表层浮游植物光合作用)、营养盐等; 深圳湾湾内由于海流较弱[37], 且除冬季部分时间水温较低以外, 其他大部分时间水温均适宜藻类增殖, 故应重点关注降雨、光照和营养盐三个因素。降雨对赤潮具有双重作用, 营养盐较低的海域, 降雨后导致的陆源营养盐输入常常是赤潮暴发的诱因, 而降雨也会导致赤潮消散, 对深圳湾海域而言, 第一种情况较少发生, 由于海域营养盐较高, 降雨的稀释作用反而会导致营养盐降低, 海域丰水期营养盐相对较低[5–6, 10]即为印证, 因此深圳湾海域只需关注降雨对赤潮的抑制作用。由于陆源污染输入对海域透明度的影响, 以及海域水深较浅, 潮流的冲刷作用也会导致水体垂直混合加剧, 进而影响表层透明度, 这些均会影响浮游植物对光的吸收, 是影响深圳湾赤潮的一项关键因素, 而随着深圳湾污染治理的加强, 海域透明度整体升高可能会导致赤潮增加。深圳湾海域氮较为充足, 磷则可能成为限制因素, 故而成为深圳湾赤潮预警的另一项关键指标, 在其他因素均适宜的条件下, 如果同时监测到磷酸盐和叶绿素大幅升高, 则海域发生赤潮的几率极高, 在后续的赤潮预警和监测中可以进行持续验证。
4 结论
(1)本次深圳湾赤潮初期第一优势种为中肋骨条藻, 后期转变为赤潮异弯藻; 水温可能是本次赤潮的主要调控因素, 活性磷酸盐大幅升高可能是本次赤潮暴发的主要诱因, 陆源输入导致的水体悬浮物增加可能是导致赤潮快速消亡的原因。
(2)深圳湾海域赤潮生物近十几年来硅藻藻华减少、甲藻及其他藻类赤潮增多, 可能是由于海域氮磷比升高、磷成为限制因子所致。
(3)随着深圳湾污染治理工作的推进, 海域透明度升高可能会导致赤潮频次增加, 深圳湾海域赤潮预警时可以关注透明度、磷酸盐, 重点关注磷酸盐的变化。

[2] 胡嘉东, 秦华鹏. 深圳河湾水系生态需水的污水资源化[J]. 水资源保护, 2008, 24(3): 20–23.
[3] 刘宁, 吕锐锋. 深圳河湾水污染水环境治理[M]. 北京:中国水利水电出版社, 2006: 1–30.
[4] 李威, 邝璐, 刘宇航, 等. 深圳湾海域水环境治理现状及展望[J]. 中国给水排水, 2016, 32(18): 29–31.
[5] 李绪录, 张军晓, 史华明, 等. 深圳湾及邻近沿岸水域总溶解氮的分布、组成和来源及氮形态的转化[J]. 环境科学学报, 2014, 34(8): 2027–2034.
[6] 张军晓, 李绪录, 肖志建. 深圳湾及邻近水域总溶解磷的来源和时空分布[J]. 中国环境科学, 2015, 35(3): 871–878.
[7] 深圳市海洋渔业局. 深圳市海洋环境状况公报[R]. 深圳: 深圳市海洋渔业局, 2018: 8–11.
[8] 香港特别行政区环境保护署. 香港海水水质报告[R]. 香港: 香港特别行政区环境保护署, 2018: 21–23.
[9] 桓清柳, 庞仁松, 周秋伶, 等. 深圳近岸海域氮、磷营养盐变化趋势及其与赤潮发生的关系[J]. 海洋环境科学, 2016, 35(6): 908–914.
[10] 张静, 张瑜斌, 周凯, 等. 深圳湾海域营养盐的时空分布及潜在性富营养化程度评价[J]. 生态环境学报, 2010, 19(2): 253–261.
[11] 赵东至等. 中国典型海域赤潮灾害发生规律[M]. 北京:海洋出版社, 2010: 269–273.
[12] 广东省海洋与渔业局. 广东省海洋环境质量公报(2009, 2010) [EB/OL]. http://gdee.gd.gov.cn/hjzkgb/index_2.html.
[13] 广东省海洋与渔业局. 广东省海洋环境状况公报(2011, 2012, 2013, 2014, 2015, 2016, 2017) [EB/OL]. http://gdee. gd.gov.cn/hjzkgb/index_2.html .
[14] 广东省生态环境厅. 广东省生态环境状况公报(2018, 2019)[EB/OL].http://gdee.gd.gov.cn/hjzkgb/ index_2.html.
[15] 霍文毅, 俞志明, 邹景忠, 等. 胶州湾中肋骨条藻赤潮与环境因子的关系[J]. 海洋与湖沼, 2001, 32(3): 311–318.
[16] 颜天, 周名江, 钱培元. 赤潮异弯藻的生长特性[J]. 海洋与湖沼, 2001, 33(2): 209–214.
[17] 王燕, 宋洪军, 李艳, 等. 温度对赤潮异弯藻生长速率及细胞体积和生化组成影响的研究[J]. 海洋与湖沼, 2015, 45(1): 41–46.
[18] 李金涛, 赵卫红, 杨登峰, 等. 长江口海水盐度和悬浮体对中肋骨条藻生长的影响[J]. 海洋科学, 2005, 29(1): 34–37.
[19] 王金花, 唐洪杰, 杨茹君, 等. 氮磷营养盐对中肋骨条藻生长及硝酸还原酶活性的影响[J]. 海洋科学, 2008, 32(12): 64–68.
[20] 陈炳章, 王宗灵, 朱明远, 等. 温度、盐度对具齿原甲藻生长的影响及其与中肋骨条藻的比较[J]. 海洋科学进展, 2005, 23(1): 60–64.
[21] 葛蔚, 汪芳, 柴超. 氮和磷浓度对中肋骨条藻和锥状斯氏藻种间竞争的影响[J]. 植物生态学报, 2012, 36(7): 697–704.
[22] 孙科, 丘仲锋, 何宜军, 等. 东海原甲藻与中肋骨条藻的种间竞争数值模拟[J]. 生态学报, 2014, 32(23): 6898– 6909.
[23] RIEGMAN R. Nutrient-related selection mechanisms in marine phytoplankton communities and the impact of eutrophication on the planktonic food web[J]. Water Science and Technology, 1995, 32(4): 63–75.
[24] GLIBERT P M, BURKHOLDER J M. Harmful algal blooms and eutrophication: “strategies” for nutrient uptake and growth outside the Redfield comfort zone[J]. Chinese Journal of Oceanology and Limnology, 2011, 29(4): 724–738.
[25] KUDELA R M, LANE J Q, COCHLAN W P. The potential role of anthropogenically derived nitrogen in the growth of harmful algae in California, USA[J]. Harmful Algae, 2008, 8(1), doi: 10.1016/j.hal.2008.08.019.
[26] HERNDON J, COCHLAN W P. Nitrogen utilization by the raphidophyte: Growth and uptake kinetics in laboratory cultures[J]. Harmful Algae, 2007, 6(2): 260–270.
[27] HONJO T. Overview on bloom dynamics and physio- logical ecology of[M]∥SMAYDA T J, SHIMIZU Y. Toxic Phytoplankton bloom in the sea. Amsterdam: Elsevier Science Publishers, 1993: 33–41.
[28] 孙金水, WAI O W , 王伟, 等. 深圳湾海域氮磷营养盐变化及富营养化特征[J]. 北京大学学报(自然科学版), 2010, 46(6): 960–964.
[29] 王越兴. 深圳湾水环境质量及变化趋势分析[J]. 环境科学导刊, 2011, 30(3): 94–96.
[30] 金杰, 刘素美. 海洋浮游植物对磷的响应研究进展[J]. 地球科学进展, 2013, 28(2): 253–261.
[31] YIN Kedong, HARRISON P J, BROOM M, et al. Ratio of nitrogen to phosphorus in the Pearl River and effects on the estuarine coastal waters: Nutrient management strategy in Hong Kong[J]. Physics and Chemistry of the Earth Parts A/B/C, 2011, 36(9/11): 411–419.
[32] 吕颂辉, 李英. 我国东海4种赤潮藻的细胞氮磷营养储存能力对比[J]. 过程工程学报, 2006, 6(3): 439–444.
[33] JI Xiaoqing, HAN Xiaotian, ZHEN Li, et al. Allelopathic interactions betweenandorin laboratory Cultures[J]. Chinese Journal of Oceanology and Limnology, 2011, 29 (4): 840–848.
[34] FLYNN K, FRANCO J M, FERNÁNDEZ P, et al. Changes in toxin content,biomass and pigments of the dinoflagellateduring nitrogen refeeding and growth into nitrogen and phosphorus stress[J]. Marine Ecology Progress Series, 1994, 111: 99–109.
[35] GRANÉLI E, JOHANSSON N. Increase in the production of allelopathic substances bycells grown under N- or P-deficient conditions[J]. Harmful Algae, 2003, 2(2): 135–145.
[36] YAN Jiaying, LIU Jingya, CAI Yu, et al. Allelopathic effects and mechanisms ofisolated from the Pearl River Estuary[J]. Journal of Applied Phycology, 2019, 31: 2957–2967.
[37] 张静, 孙省利, 林建国, 等. 深圳湾海域环境容量及污染总量控制研究——I.潮汐、潮流数值模拟[J]. 海洋通报, 2010, 29(1): 22–28.
Analysis on the key factors for the population evolution and early warning of harmful algal blooms based on an algal bloom in Shenzhen bay, the South China Sea
LI Li1, MA Fangfang2, ZHAI Xiaohui1, YANG Weisi1, YE Penghao1,LIU Yue1,*
1. Marine Development Research and Promotion Center of Shenzhen, Shenzhen 518067, China 2. Research Institute for Environmental Innovation (Suzhou) Tsinghua, Suzhou 215163, China
A harmful algae bloom was recorded in Shenzhen Bay, the South China Sea, in May 2020. The causative specie wasin the first beginning, then shifted to. The data from the water quality buoy in the area showed that concentrations of nitrate and phosphate increased significantly before the outbreak of the bloom. During the bloom, the concentration of chlorophyllreached its maximum value to 127.1 μg·L-1on May 2, accompanied by a continuously rising temperature and a decreasing salinity. In the process of the bloom disintegration, water temperatures kept increasing to as high as 28 ℃, whileas the salinity exhibited a continuous decrease. Analytic results indicated that temperature might be the dominant factor for the HAB.The rapid increase of phosphate imput might be the causative factor for thebloom, whileas the increases of suspended matters from riverine input promoted the rapid decline of the bloom. The shift of causative species from diatom to raphidophyte during the bloom was speculated to the consumption of large amount of phosphate during the HAB. The results from a long term data analysis showed that HAB causative species shift from diatoms to dinoflagellates and other taxas in the last decadewas due to continuously increase of N/P ratio. Phosphorus is a limited nutrient in the area. Authors suggest that monitoring of phosphate is of the first importance for the early warning of HABs in Shenzhen Bay.
Shenzhen Bay; phosphate; harmful algae bloom;;
李丽, 马方方, 翟晓辉, 等. 深圳湾海域赤潮生物演变及赤潮预警关键因子分析[J]. 生态科学, 2022, 41(3): 82–89.
LI Li, MA Fangfang, ZHAI Xiaohui, et al. Analysis on the key factors for the population evolution and early warning of harmful algal blooms based on an algal bloom in Shenzhen bay, the South China Sea[J]. Ecological Science, 2022, 41(3): 82–89.
10.14108/j.cnki.1008-8873.2022.03.009
X55
A
1008-8873(2022)03-082-08
2021-04-25;
2021-07-03
国家自然科学基金项目(41606176)
李丽(1983—), 女, 河南信阳人, 博士, 助理研究员, 海洋生态及资源监测, E-mail: wuyoulily@126.com
刘悦(1965—), 女, 高级工程师, 海洋生态及资源监测, E-mail: liuyue@pnr.sz.gov.cn
