基于网络药理学的双氢杨梅树皮素抗金黄色葡萄球菌活性和作用机制研究
2022-05-14邓浩健曾春晖陈益清韦海宏张文涛
邓浩健,曾春晖,陈益清,王 溢,吴 光,韦海宏,张文涛,杨 柯
(广西中医药大学药学院,广西南宁 530200)
由于抗生素的广泛使用,金黄色葡萄球菌(Staphylococcus aureus,SA)的耐药性逐渐增强,研究发现,耐甲氧西林金黄色葡萄球菌(Methicillin-sensitiveS.aurues,MRSA)对β-内酰胺类、β-内酰胺酶抑制剂、第三代喹诺酮类等抗菌药物的耐药率均大于50%[1]。生物被膜是细菌为逃避药物对其杀灭和适应环境变化的一种特殊膜样物[2−3],国内外临床实践和研究结果表明,SA产生生物被膜,既可以保护细菌不受抗生素作用,导致SA耐药[4−5],又可以降低机体的免疫功能和细胞吞噬功能,从而逃避宿主免疫,致使感染难以治愈[6−7]。因此,寻找能够控制和治疗SA生物被膜感染的药物成为当前研究的热点[8]。
藤茶(Ampelopsis grossedentata(Hand-Mazz)W.T.Wang),是广西一种资源丰富的野生壮药,2013年被国家卫计委批准为新资源食品[9],其主要成分为黄酮类化合物,其中双氢杨梅树皮素(Ampelopsin, APS)又称二氢杨梅素(Dihydromyricetin,DMY)含量最高,具有抗菌消炎、增强免疫的药理作用[10],但目前对APS的抗菌活性作用机制研究甚少。本课题组前期已完成藤茶提取物及APS初步抗菌机制研究,结果表明APS对MRSA、标准SA等临床常见致病菌均有极高的抗菌活性,且优于阳性对照药盐酸黄连素[11]。此外,课题组研究结果还表明,藤茶提取物总黄酮可通过降低细菌表面疏水性,减弱其黏附性,增加细菌通透性使细菌形态发生改变,并通过抑制细菌脱氢酶活性发挥抗菌作用[12];细菌耐药性诱导实验表明,APS不易诱导标准SA产生耐药[13]。
本研究将在前期基础上,通过体外抗菌活性的考察,并结合网络药理学构建“化合物-靶点-靶点互作”网络,寻找APS潜在的抗菌靶点,探究其抗菌作用特点及机制,为后续实验提供理论依据。
1 材料与仪器
1.1 材料与仪器
MSSA ATCC 25923(标准不产膜菌)、MRSA ATCC 6538(标准产膜菌株) 广东省微生物菌种保藏中心,受试菌株分别由广西医科大学第一附属医院、广西中医学院第一附属医院、广西中医学院第二附属医院和广西壮族自治区人民医院检验科临床分离提供,其中,MSSA-4(不产膜敏感金黄色葡萄球菌)、MRSA-6(不产膜耐药金黄色葡萄球菌)、MSSA-11(产膜敏感金黄色葡萄球菌)、MRSA-12(产膜耐药金黄色葡萄球菌)作为本次实验的受试菌进行后续研究;双氢杨梅树皮素(APS) 由广西中医药大学中药化学教研室提供,系从广西藤茶茎叶中分离提取,纯度≥98%,为灰白色粉末;青霉素钠、苯唑西林钠、头孢西丁钠、亚胺培南西司他丁钠 中国食品药品鉴定研究院;水解酪蛋白(MH)琼脂、MH肉汤培养基 北京陆桥技术有限责任公司;胰蛋白胨大豆肉汤 广东环凯微生物科技有限公司。
DNP-9082型电热恒温培养箱 上海精宏实验设备有限公司;Spectramax M5型酶标仪 美国MD公司;HVZ-50型灭菌器 日本Hira Yama公司。
1.2 实验方法
1.2.1 体外抑菌实验
1.2.1.1 实验用药物配制 称取一定量的APS及四种抗生素,用无菌生理盐水配制,0.22 μm针式过滤器过滤除菌即分别为药物初始浓度,用倍比稀释法将各药配制成所需浓度,详见表1~表4。

表1 各药物对MSSA-4作用的浓度(μg/mL)Table 1 Concentration of the effect of each drug on MSSA-4 (μg/mL)

表4 各药物对MRSA-12作用的浓度(μg/mL)Table 4 Concentration of the effect of each drug on MRSA-12 (μg/mL)

表2 各药物对MSSA-11作用的浓度(μg/mL)Table 2 Concentration of the effect of each drug on MSSA-11 (μg/mL)

表3 各药物对MRSA-6作用的浓度(μg/mL)Table 3 Concentration of the effect of each drug on MRSA-6 (μg/mL)
1.2.1.2 受试菌菌液制备 挑取受试菌菌落1~2个,接种于培养液中,35℃振荡培养过夜,次日收集菌液,1500 r/min离心5 min,弃去上清液,用无菌生理盐水校正浓度至0.5麦氏比浊标准,即得1×106CFU/mL。
1.2.1.3 APS及四种β-内酰胺类抗生素对受试菌MIC的测定 采用连续稀释法[14],向96孔板各测定孔先加入100 μL无菌新鲜的MH肉汤,后取药的最高浓度100 μL与第一孔培养基混合,反复吸放8次,吹打均匀,然后从混合液中取出100 μL至第二孔,如此反复直至第八孔,即第八个药物浓度,每个药物均设8个浓度,同时设置对照组。药物加好后,分别向各孔内加入100 μL相应受试菌菌液,35℃恒温培养18 h后每孔加入1%四氮唑(TTC)5 μL,继续培养4 h后观察各孔颜色变化,有细菌生长孔呈红色,以不显红色孔的最低药物浓度为MIC。
1.3 网络药理学预测APS潜在作用靶点及抗菌作用机制
1.3.1 APS结构获取及潜在作用靶点的垂钓 在PubChem数据库(http://pubchem.ncbi.nlm.nih.gov/)检索关键词“Dihydroquercetin”获得APS的化学结构式及其结构文件(sdf格式);使用ChemDraw 3D绘制出APS相应的三维结构,使用MM2力场优化后保存为mol2格式文件并上传至PharmMapper服务器(http://lilab-ecust.cn/pharmmapper/)进行APS的靶点预测分析,其中物种设置为人类,其他参数默认[15]。
1.3.2 抗菌靶点预测、关键蛋白靶点互作(proteinprotein interaction,PPI)网络构建及分析 以“Antibacterial”作为检索词输入GeneCards数据库(https://www.genecards.org/),检索抗菌相关的基因靶点。将APS作用靶点与抗菌靶点取交集,将其导入STRING平台(https://string-db.org/),设置物种为人,Interaction score≥0.4,构建PPI网络,导出节点信息文件,为下步构建网络图做准备。
1.3.3 “化合物-靶点-靶点互作”网络的构建与分析 在得到化合物结果及靶点信息的基础上,采用Cytoscape 3.7.1软件进行拓扑属性分析,利用插件“Network Analysis”的功能进行分析,度值是反映一个节点在网络中重要性的指标,选取拓扑参数度值高于平均数的靶标作为关键靶标,以明确APS抗菌靶点之间的相互作用。
1.3.4 KEGG代谢通路和GO生物过程 利用Metascape平台(https://metascape.org/)对筛选出的交集靶点进行GO生物功能富集分析和KEGG代谢通路富集分析,基因组中的所有基因作为富集背景。收集P<0.01(P值根据累积超几何分布计算)、最小计数为3、富集因子>1.5(富集因子指观察到的计数与偶然预期计数之间的比率),并根据其相似性进行分组。在对丰富项进行层次聚类时,采用Kappa评分作为相似度度量,相似度大于0.3的子树被视为一个聚类,选择聚类中统计意义最大的项来表示聚类。利用微生信网络平台(http://www.bioinformatics.com.cn/),将筛选出的-lgP值降序前10作“GO富集分析柱状图”,-lgP值降序前15作“KEGG通路富集分析气泡图”。
1.4 数据处理
采用SPSS 19.0软件进行一元多因素方差分析,采用F检验,P<0.05为差异具有统计学意义。
2 结果与分析
2.1 体外抑菌实验结果
2.1.1 APS及β-内酰胺类抗生素对受试菌MIC的测定结果 APS对受试菌的MIC为62.50 μg/mL和125.00 μg/mL,β-内酰胺类抗生素对受试菌的MIC在0.0125~400 μg/mL之间,进一步分析发现,APS对细菌是否存在生物被膜、细菌为敏感或耐药菌的MIC值差别不大,而这些因素却对β-内酰胺类抗生素有较大影响,尤其是当两因素叠加时,生物被膜阳性耐药菌MIC甚至为生物被膜阴性敏感菌的4000倍,说明APS可能通过影响细菌生物被膜的形成而发挥较好的抗菌作用,而四种β-内酰胺类抗生素对产膜菌的敏感性低于不产膜菌,说明耐药性和生物被膜会降低细菌对四种β-内酰胺类抗生素的敏感性,结果见表5、表6。

表5 APS及四种β-内酰胺类抗生素对受试菌MIC的测定Table 5 Determination of APS and four β-lactam antibiotics on the MIC of tested bacteria

表6 APS及4种 β-内酰胺类抗生素对产膜/不产膜受试菌MIC的比值Table 6 MIC ratios of APS and four β-lactam antibiotics on membrane-producing/non-membrane-producing subjects
2.1.2 细菌耐药性和生物被膜对药物MIC的交互效应 多因素方差分析结果表明,APS对生物被膜影响的P<0.05,耐药性的P=0.883>0.05,说明APS对受试菌的生物被膜影响显著,且不受细菌耐药性的影响,说明无论细菌敏感或耐药APS均可通过影响生物被膜而发挥较好的抗菌作用,见图1A。四种β-内酰胺类抗生素对生物被膜的P=0.467>0.05,耐药性的P=0.004<0.05(表7、表8),说明β-内酰胺类抗生素对生物被膜无影响,且极易受到细菌耐药性的影响,此外生物被膜的产生导致细菌对四种β-内酰胺类抗生素受试菌的敏感性降低,见图1B。

表7 APS主体间效应检验结果Table 7 Results of the APS between-subjects effect test

表8 β-内酰胺类抗生素主体间效应检验结果Table 8 Results of inter subjects effect test for β-lactam antibiotics
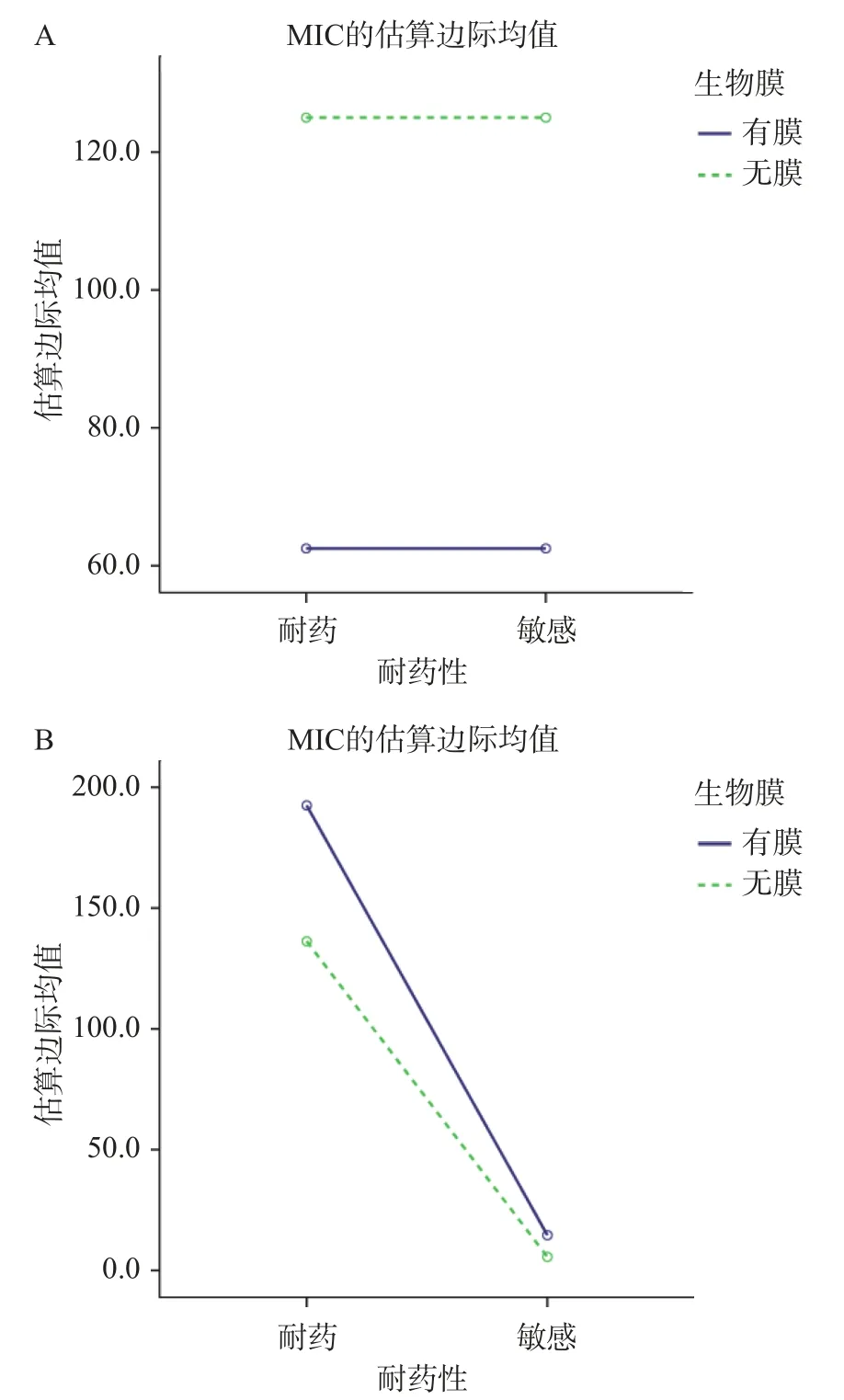
图1 耐药性与生物被膜的交互效应分析结果图Fig.1 Results of the interaction effect analysis between drug resistance and biofilm
2.2 网络药理学预测结果
2.2.1 APS的靶点预测及抗菌相关靶点的预测结果 经PharmMapper服务器对APS进行潜在靶点预测,得到排名前300的靶标,其中已验证的靶标284个。经GeneCards数据库检索“Anti-bacterial”,共找到1824个抗菌基因。将284个APS靶基因与1824个抗菌相关基因取交集,获得APS-抗菌共同靶点123个,见图2。
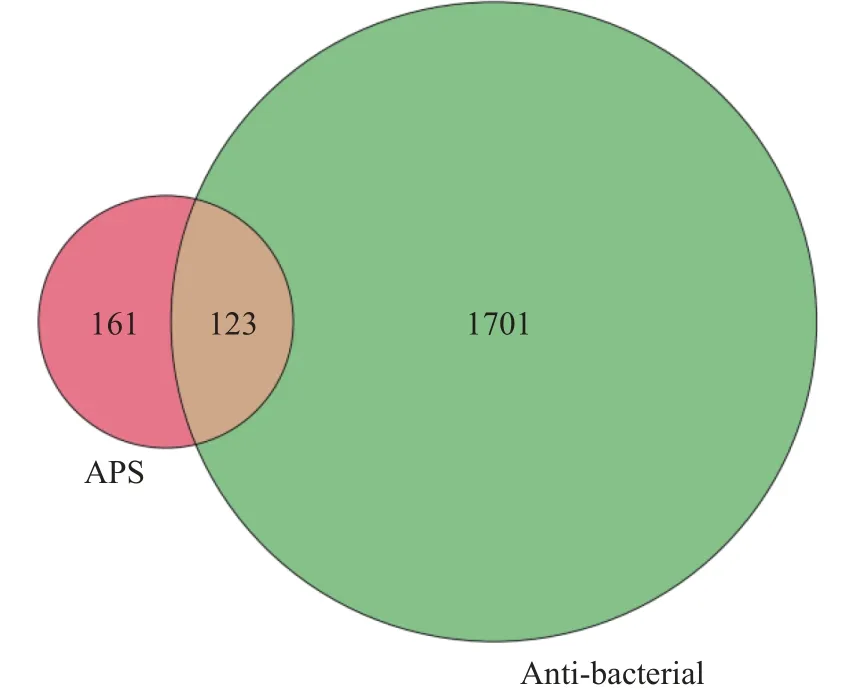
图2 APS作用靶点与抗菌相关靶点的韦恩图Fig.2 Venn diagram of APS targets and antibacterial related targets
2.2.2 交集靶点PPI结果 将123个交集靶点导入STRING平台,映射得到的PPI网络中包含121个节点(2个靶点未参与PPI网络构建)和1157条相互作用连线,根据网络拓扑学参数,共筛选出43个度值超过平均值的关键靶点,用于构建PPI网络图,其平均度值为23.5,平均介数为0.748,517条线代表了蛋白之间的相互作用,基因与邻接基因连线数目越多,说明在网络中的作用越大,是网络核心基因的可能性越大,很可能是APS发挥抗菌作用的关键靶点,见图3。

图3 APS潜在抗菌靶点的PPI网络图Fig.3 PPI network diagram of potential antibacterial targets of APS
2.2.3 “化合物-靶点-靶点互作”网络图构建结果 筛选出43个度值超过平均值的关键靶点,黄色节点表示藤茶的有效成分APS,绿色节点代表交集靶点基因;图中节点的度值越大,形状越大,深绿色节点代表度值均值以上的重要基因,其中degree值前十个靶点为ALB(degree=79)、AKT1(degree=77)、MMP9(degree=62)、MAPK1(degree=60)、CASP3(degree=57)、IGF1(degree=57)、MAPK8(degree=56)、HRAS(degree=48)、BCL2L1(degree=43)、ESR1(degree=43),提示这些靶点在APS的抗菌机制中发挥重要作用,见图4。
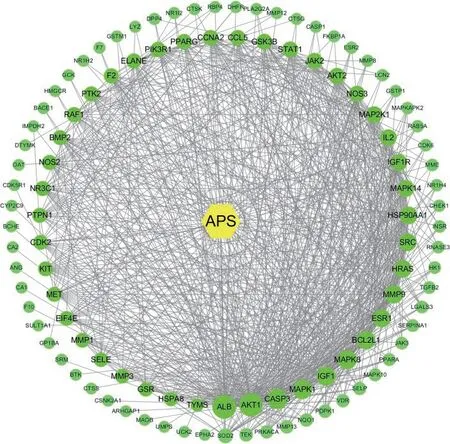
图4 “化合物-靶点-靶点互作”网络图Fig.4 "Compound-target-target interaction"network diagram
2.2.4 GO生物功能和KEGG代谢通路富集分析结果 抗菌交集靶点借助Metascape平台进行分析,GO富集分析各筛选出前十条,其中APS抗菌主要涉及的生物学过程(Biological process)有:对肽的反应(response to peptide)、对细菌的反应(response to bacterium)、细胞粘附调节(regulation of cell adhesion)等;细胞组分(Cellular component)有:胞质泡腔(胞质泡腔)、膜筏(membrane raft)、细胞外基质(extracellular matrix)等;分子功能(Molecular function)有:激酶活性(kinase activity)、脂质结合(lipid binding)、蛋白质结构域特异性结合(protein domain specific binding)等;KEGG通路前15条富集分析结果显示,APS抗菌的关键基因靶点涉及到的通路有:黏附连接(adherens junction)、药物代谢(drug metabolism)、氨基糖和核苷酸糖代谢(amino sugar and nucleotide sugar metabolism),见图5~图7、表9。

表9 APS抗菌靶点相关通路分析Table 9 Analysis of APS antibacterial target related pathways
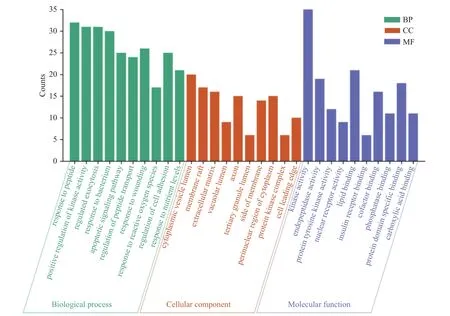
图5 GO功能分析图Fig.5 GO function analysis chart
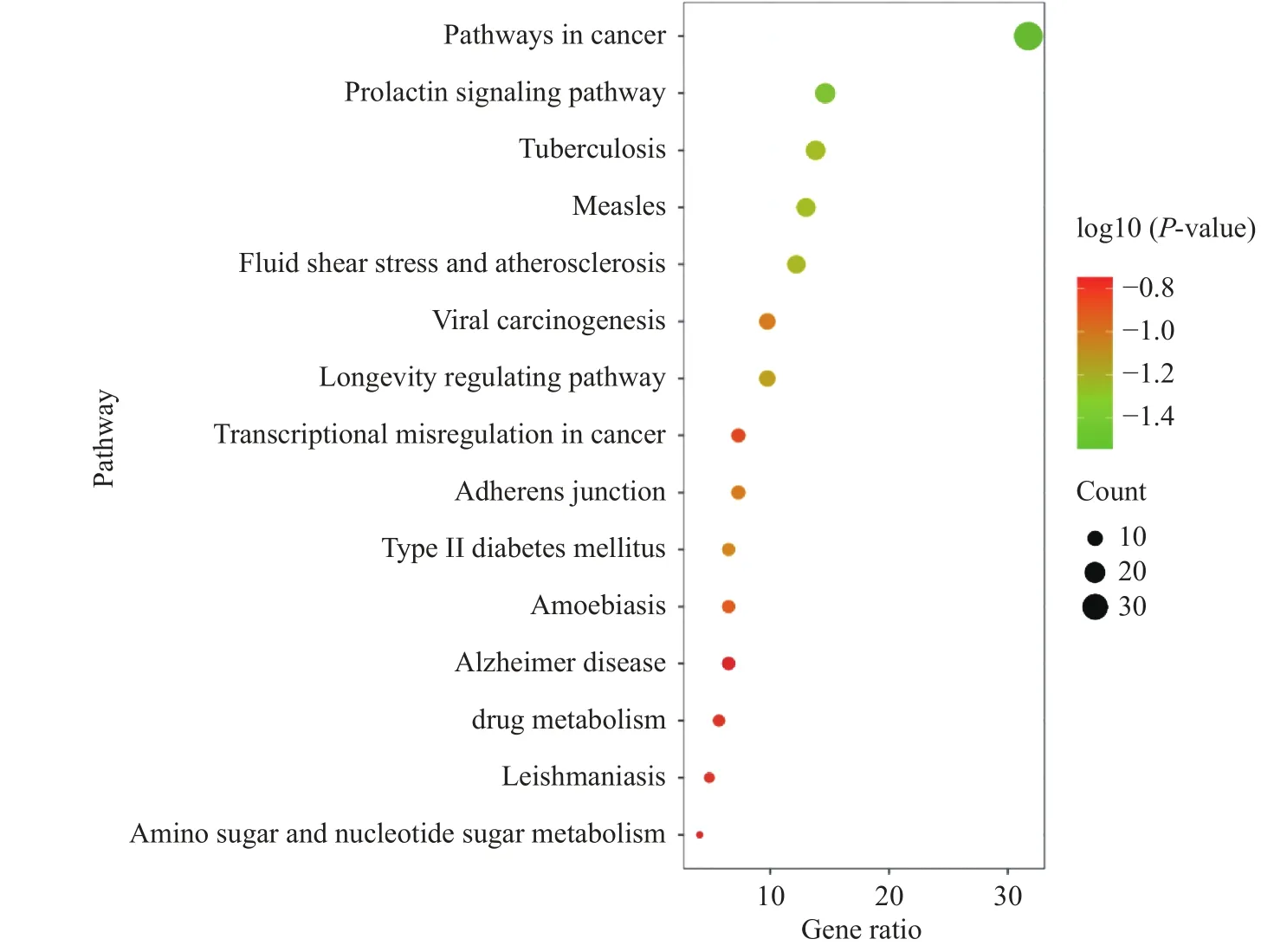
图6 KEGG富集分析气泡图Fig.6 KEGG enrichment analysis bubble chart
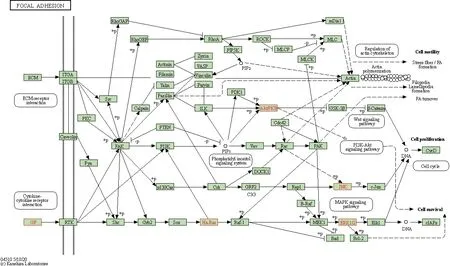
图7 前10个关键靶点在局灶黏附通路上的标注图Fig.7 Annotated map of the first 10 key targets on the focal adhesion pathway
3 讨论与结论
根据2018年中国CHINET细菌耐药性监测,在22147株金黄色葡萄球菌中,甲氧西林耐药株的检出率为34.0%,其中88.6%甲氧西林耐药株对多种抗生素的耐药率明显高于甲氧西林敏感株,且临床分离菌对常见抗菌药物的耐药率仍呈增长趋势[16],而生物被膜的屏障作用使得抗菌药物难以渗透其中杀灭深内层细菌,这也是临床细菌耐药性产生的重要原因[17]。
本研究探索在生物被膜与耐药性两因素作用下,APS对比四种β-内酰胺类抗生素对细菌MIC的抗菌特点和潜在机制。通过体外抗菌实验发现APS可能通过影响细菌的生物被膜而发挥抗菌作用,为探究APS如何对生物被膜进行调控及潜在抗菌作用靶点和作用机制,课题组采用网络药理学方法进行预测,为后续的实验研究方向提供参考。
体外抗菌实验显示,通过APS及四种β-内酰胺类抗生素对细菌MIC的测定发现,细菌耐药性及生物被膜不会影响APS的抗菌作用,而β-内酰胺类抗生素易受到细菌耐药性及生物被膜的影响,使得细菌对其敏感性降低,可见APS的抑菌机制不同于常规的化学抗生素药物,并不易受细菌耐药性及生物被膜的影响,有较好的发展前景。目前,细菌对抗生素耐药现状严峻,尤其对青霉素钠耐药率高达94%[1],β-内酰胺类抗生素不能影响生物被膜形成,根据APS可影响生物被膜而抗菌的作用特点,课题组接下来将进一步探究其对生物被膜的影响及机制,利用APS破坏生物被膜从而提高或恢复细菌对β-内酰胺类抗生素的敏感性。
网络药理学的结果显示,ALB、AKT1、CASP3、MAPK1、IGF1、MAPK8、BCL2L1、ESR1、MMP9、HRAS为APS抗菌的重要靶点。其中,ALB作为载体蛋白,抗菌药物与其结合后,药物的质变转化被显著修饰[18],此外ALB还可削弱细菌与金属蛋白的结合能力,尤其是限制细菌对铁的利用,从而抑制细菌生长[19];AKT1是与AKT激酶紧密相关的丝氨酸蛋白激酶可催化蛋白磷酸化,在调节细菌的细胞过程中起核心作用[20];CASP3参与半胱氨酸蛋白酶的激活级联,负责细胞凋亡的执行,还参与细胞黏附过程[21];MAPK1、MAPK8在MAPK / ERK级联中起重要通过调节转录、翻译、细胞骨架重排来介导多种生物学功能,例如细胞生长、黏附、存活和分化[22];MMP9在细胞外基质的局部蛋白水解和白细胞迁移中起重要作用,可作为细菌感染的保护性分子,防止巨噬细胞通过非蛋白水解作用迁移到感染部位[23]。
通过GO和KEGG通路富集分析,发现这些关键靶点具有一定相关性,是一个交互复杂的网络而非独立起作用,且主要集中在细胞质膜、黏附、代谢等方面,说明APS可能通过作用于菌体表面的蛋白,影响蛋白质的合成、黏附过程、干扰其代谢等,从而发挥抗菌作用,而这些过程与细菌生物被膜的形成息息相关。研究表明,APS与SA细胞膜的膜脂和蛋白质相互作用,使得膜流动性明显降低、膜蛋白构象发生变化,破坏细胞膜完整性,还可与其DNA相结合达到杀菌作用[24]。Xiong等[25]进一步研究APS对SA的作用机制,发现APS可引起SA细胞膜渗透性的变化。此外,通过干扰局灶黏附通路中FAK与衔接蛋白β1的结合,可阻止细菌在宿主表面的定植和迁移,从而抑制细菌感染[26],而具有较好网络度的蛋白靶点AKT1、MAPK1、IGF1、MAPK8、HRAS均富集在该通路上(见图7),说明APS可通过干扰细菌的定植和迁移而影响生物被膜的形成,从而起到抗菌作用。
APS属黄酮类成分,研究表明,由于黄酮类成分具有特殊的苯环结构而有较好的抗菌活性[27],该机制之一即为抑制胞质膜功能[28],与关键蛋白靶点功能、GO富集分析结果一致,证明了本次网络药理学预测结果的可靠性;此外,前10个关键靶点有半数均富集在局灶黏附通路上,而细菌生物被膜形成的第一步就是黏附于接触表面[29−30],体外抗菌实验亦说明APS通过影响生物被膜而发挥作用的抗菌特点,因此本文推测,APS可能通过影响细菌的黏附能力以及生物被膜的结构、形成过程,从而呈现良好的抗菌效果。后期本课题组将深入研究APS对金黄色葡萄球菌生物被膜形成的影响及机制,对本次网络药理学预测结果进行进一步验证。
