基于外周血免疫学特征的鼻咽癌初诊远处转移风险评估模型构建
2022-05-14陈思皓何淑娅邵世龙何姗珊王东生杨牧张石川
陈思皓 何淑娅 邵世龙 何姗珊 王东生 杨牧 张石川
鼻咽癌起源于鼻咽黏膜,是上皮肿瘤中较为少见的与Epstein-Barr(EB)病毒感染相关的恶性肿瘤,东南亚地区与中国华南地区是高发区[1]。放疗联合化疗作为目前鼻咽癌的一线治疗方案,能有效控制其进展,无转移患者5年生存率可达80%以上[2]。但初诊时4%~10%、治疗随访期间10%~15%的鼻咽癌患者发生远端器官转移[3],生存时间仅为9~20个月[4]。如何对这部分患者进行早期诊断,拓宽治疗窗口,从机制上厘清鼻咽癌演进的异质性,是目前本领域临床诊疗探索所面临的主要挑战。
EB病毒感染是鼻咽癌发生的重要因素之一。通过与EB病毒感染的正常人群比对发现,BALF2_CCT等病毒亚型不仅具有较高的扩散率与致突变率进而导致鼻咽癌的发生[5],同时其慢性感染还能改变宿主免疫系统,尤其是T淋巴细胞亚群与功能,从而导致宿主免疫背景发生特异性改变[6]。另外,由于鼻咽部存在大量淋巴循环以及复杂的次级免疫结构,鼻咽癌的发生和进展往往伴随大量的免疫细胞浸润。而这部分浸润免疫细胞通过咽淋巴环和引流淋巴结游离至循环系统,改变外周免疫细胞亚群数量以及比例,可能形成特殊的免疫特征。
本研究以初诊且接受流式细胞检测的鼻咽癌患者为研究对象,纳入治疗前免疫细胞亚群及计数、中性粒细胞与淋巴细胞比例(neutrophil-to-lymphocyte ratio,NLR)、淋巴细胞与单核细胞比例(lymphocyteto-monocyte ratio,LMR)、血小板与淋巴细胞比例(platelet-to-lymphocyte ratio,PLR)以及乳酸脱氢酶(lactate dehydrogenase,LDH)、预后营养指数(prognostic nutritional index,PNI)、血浆EB病毒载量、临床分期等既往报道的预后因素[7-9],对远处转移风险进行多维度评估,尝试建立以临床可及检查手段为基础的初诊远处转移风险评估模型,辅助此部分患者早期诊断,为临床创造提前干预的窗口。
1 材料与方法
1.1 临床资料
回顾性收集2019年1月至2021年6月于四川省肿瘤医院确诊并接受外周血淋巴细胞亚群分析的初诊鼻咽癌患者231例。本研究获得本院医学伦理委员会的批准(审批号:SCCHEC-02-2019-10)。
1.2 方法
1.2.1 纳入标准 1)于本院病理确诊且未接受任何治疗的鼻咽癌患者,肿瘤细胞原位杂交EBER(+);2)KPS评分≥70分;3)有完整的初始临床病例资料;4)无免疫系统相关疾病且既往未经免疫治疗;5)无活动期急慢性传染性疾病;6)未进行任何抗肿瘤治疗。
1.2.2 外周血免疫学指标和临床特征收集 包括患者性别、年龄、吸烟史、饮酒史、血浆EBV DNA拷贝数、血常规指标(中性粒数目、淋巴细胞数目、单核细胞数目、血小板数目)、生化指标(LDH、白蛋白)、外周血淋巴细胞亚群百分比及绝对值[CD3+T细胞、CD3+CD4+T细胞、CD3+CD8+T细胞、CD19+B细胞、CD(16+56)+NK细胞],计算NLR、LMR、PLR以及PNI指数。
1.2.3 远处转移诊断标准 入组患者根据美国癌症联合会(AJCC)第8版进行重新分期,根据初诊是否存在远处转移分为转移组和非转移组,进行临床和免疫指标与转移的关联性分析。远处转移诊断标准:肝转移的诊断标准为组织活检证实,或超声、CT、MRI任何两项,或PET/CT一项影像学提示转移;骨转移为活检病理证实,或骨扫描、核磁、CT任意两项,或PET/CT一项提示转移;肺转移为活检病理证实,或PET/CT一项,或胸部CT需由两位高年资影像医师一致考虑为转移。
1.2.4 远处转移分层标准 本研究根据患者转移负荷严重程度分为轻度转移和重度转移,分别检验风险预测模型的有效性。轻度转移定义为单个器官转移,且所有转移灶直径之和<3 cm;重度转移定义为多器官转移或所有病灶直径之和≥3 cm。
1.3 统计学方法
采用SPSS 26.0软件进行单因素及多因素分析,列线图模型构建及性能检验使用R 4.1.1软件和RMS程序包,图形绘制采用GraphPad Prism 8.0软件。所有检验均为双尾检验,以P<0.05为差异具有统计学意义。
采用受试者工作特征曲线(ROC曲线)中的曲线下面积及最佳约登指数确定各连续变量资料的截断值,以此分为高值组和低值组。计数资料采用百分数表示,用χ² Test或Fisher′s Exact Test进行单因素分析。将单因素分析中P<0.05的指标进一步纳入多元Logistic逐步回归法分析,从而确定初诊远处转移患者的独立相关因素。基于多因素分析筛选出的指标构建可视化列线图预测模型。使用Bootstrap重抽样法对列线图预测模型进行内部验证,重复取样次数1 000次。采用一致性指数(C-index)、ROC曲线下面积(AUC)、临床决策曲线(DCA)以及临床影响曲线(CIC)进一步分析列线图性能,并使用Calibration校正曲线来描述列线图的符合度。根据模型预测概率分为高、中、低危三组,验证各分期患者危险分组的分布情况。
2 结果
2.1 患者的临床特征
本研究共纳入231初诊鼻咽癌患者,其中男性163例,女性68例,男女比例为2.4∶1,中位年龄50.5(18~71)岁。血浆EBV DNA拷贝数阳性标准为400拷贝/mL,其中<400拷贝/mL为141例(61.1%),≥400拷贝/mL为90例(38.9%)。根据治疗前各项辅助检查明确已发生远处转移患者48例,未发生远处转移患者183例。48例转移患者中,骨转移20例,肺转移9例,肝转移6例,骨转移合并肺转移6例,骨转移合并肝转移4例,肝转移合并肺转移3例(表1)。
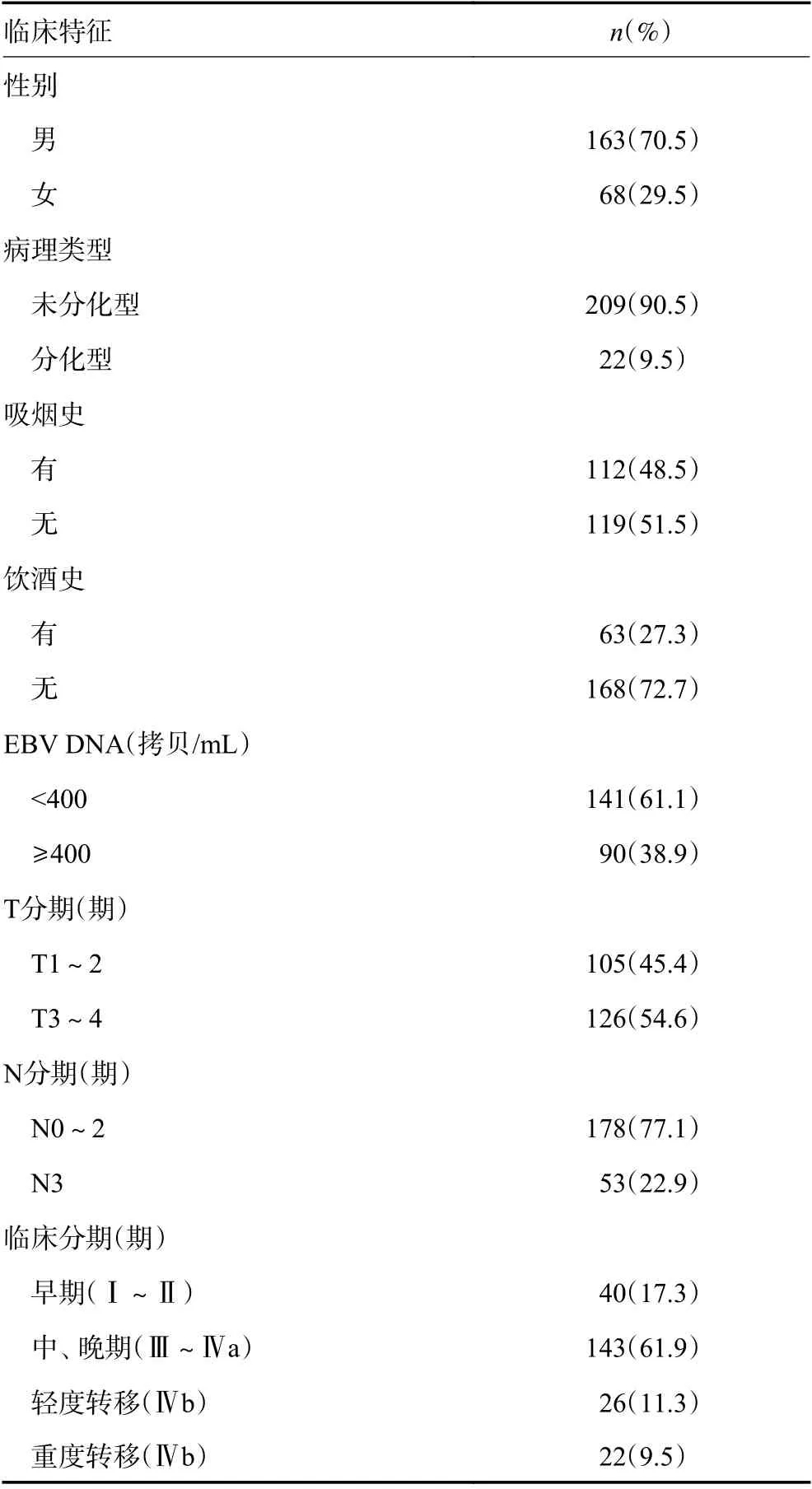
表1 231初诊鼻咽癌患者的临床特征
2.2 转移发生风险的单因素及多因素分析
单因素分析表明,EBV DNA拷贝数、N分期、CD4/CD8比值、B细胞百分比、NK细胞百分比、CD4+T细胞绝对数、B细胞绝对数、NK细胞绝对数、LDH、NLR、PNI以及LMR与初诊远处转移患者有关(均P<0.05,表2)。由于CD4/CD8比值是由CD4与CD8简单运算得出,存在显著的共线性,故仅将CD4/CD8比值纳入多因素分析。多因素Logistic回归分析最终筛选出N分期、CD4/CD8比值、NK细胞绝对数、LDH以及PNI是初诊远处转移患者的独立相关因素(均P<0.05,表3)。
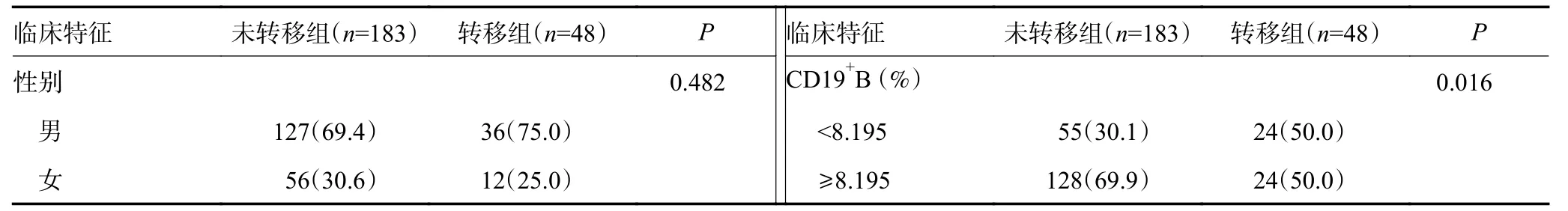
表2 两组患者临床及免疫学特征比较
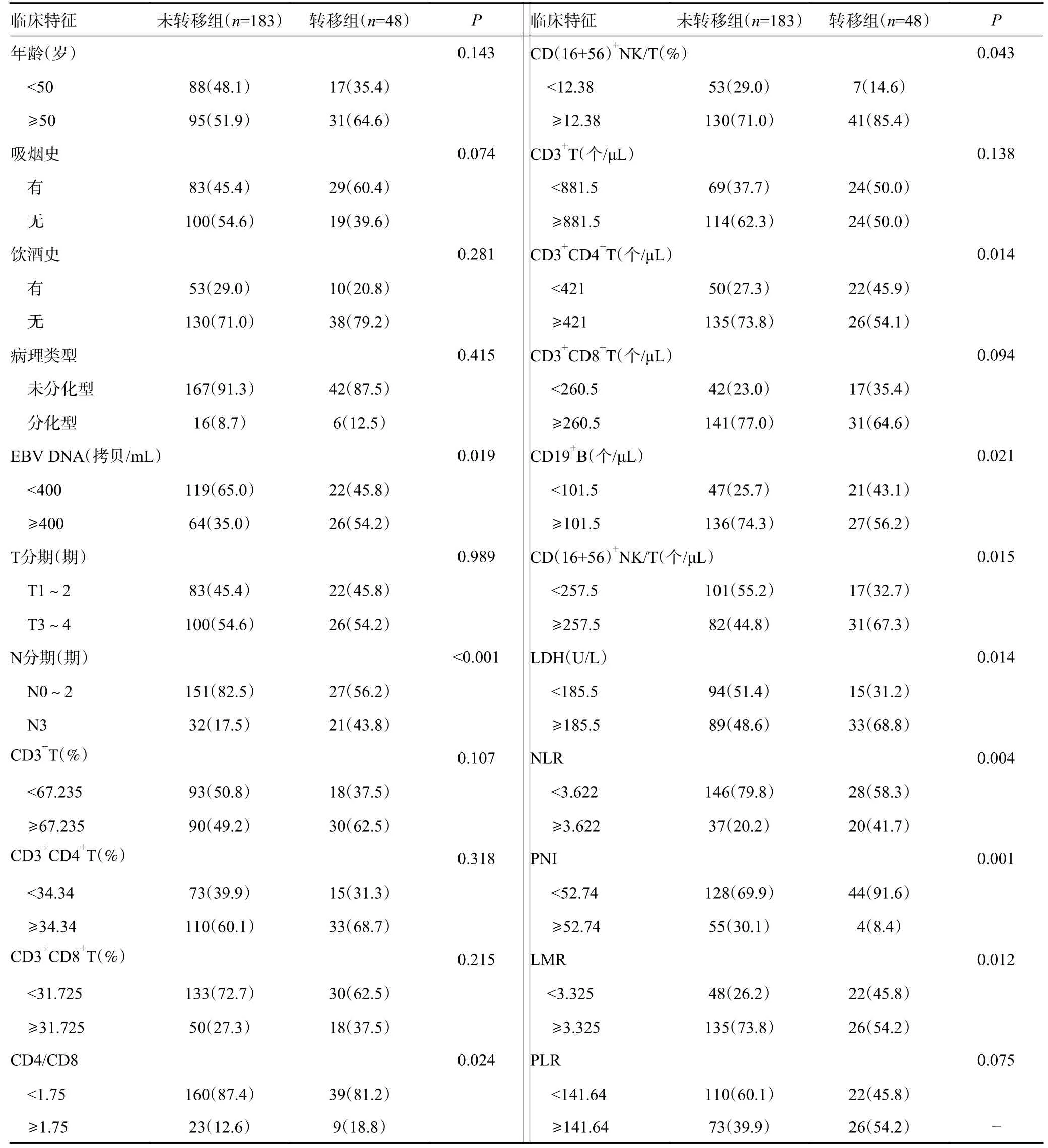
表2 两组患者临床及免疫学特征比较 (续表2)
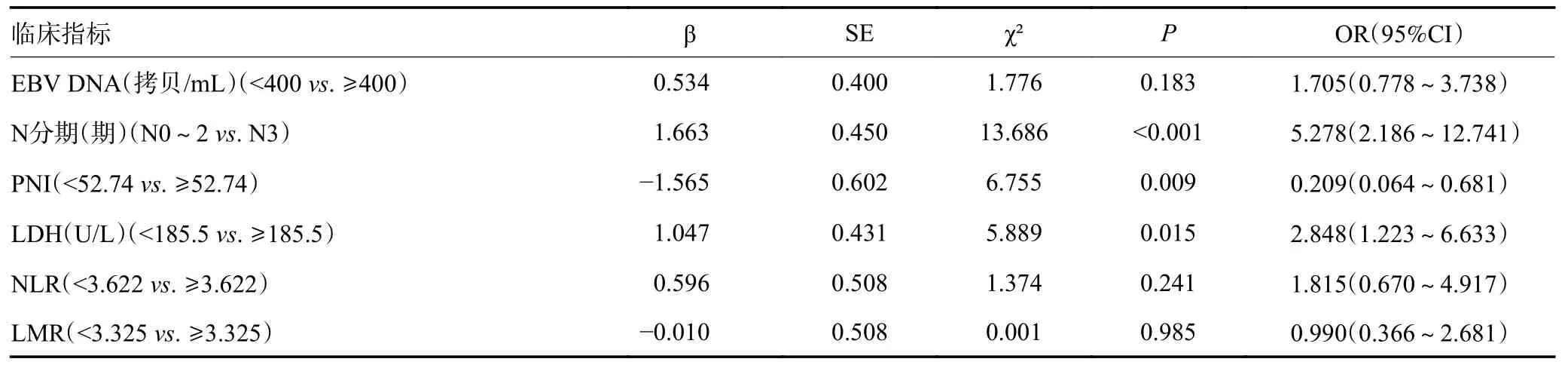
表3 初诊远处转移患者的多因素Logistics分析
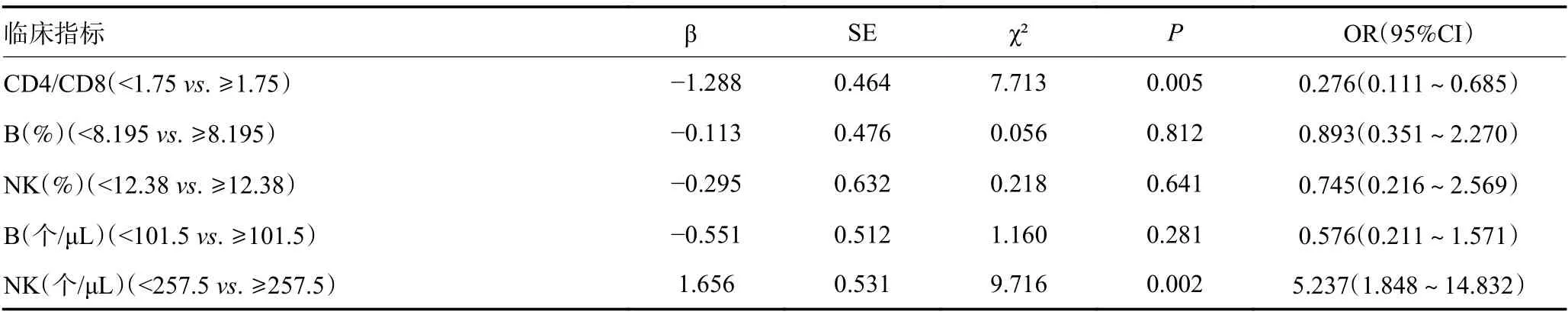
表3 初诊远处转移患者的多因素Logistics分析 (续表3)
2.3 远处转移风险评估模型的建立及评价
根据多因素筛选结果建立预测模型,并以可视化列线图展示(图1)。通过Bootstrap法重抽样1 000次,对列线图进行内部验证得到C-index为0.826。ROC曲线分析表明AUC值为0.826,模型的总体准确度较高(图2B)。Calibration校正曲线显示列线图预测的概率与实际概率基本一致(图2A),提示建立的列线图模型可以以较高的敏感度和准确度区分转移组与非转移组患者。在临床适用性方面,DCA曲线表明当风险度>20%时,模型存在显著的临床净获益度(图2C)。CIC曲线则进一步表明,该模型在风险度>20%后预测转移概率与实际转移概率具有良好的一致性(图2D)。

图1 预测初诊鼻咽癌患者远处转移的列线图模型
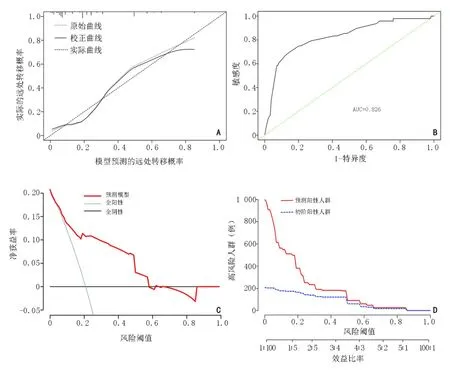
图2 预测模型的多维度验证
2.4 风险评估模型对轻度转移患者识别能力的初步验证
根据Nomogram得分,将患者分为以下组别:低风险组(转移发生概率<30%,得分<260分)、中风险组(转移发生概率30%~50%,得分260~307分)以及高风险组(转移发生概率>50%,得分>307分)。进一步分析在早期无转移患者、中、晚期无转移患者、轻度转移患者及重度转移患者群体中,以上3种风险患者所占比例。结果显示,早期无转移患者中、高风险比例为0,中、晚期无转移患者分别为7.7%、4.9%,而转移组中高风险构成显著高于无转移组。尤为重要的是,轻度转移患者和中、晚期无转移患者比较,在全身肿瘤负荷相当的情况下,中、高风险分别占到总体的50.0%和30.8%,证明模型可以有效地辅助鉴别隐匿性的转移患者(表4)。

表4 各分期患者的转移风险分布情况分析 n(%)
3 讨论
鼻咽癌远处转移的精确预测能有效地辅助临床决策,创造早期干预空间,提高患者生存率和生存质量。N分期[8]和EB病毒拷贝数[9]是目前临床较为确切的预测指标。但后者由于不同临床中心EBV-DNA定量检测标准不同,且鼻咽癌非高发地区阳性检出率较低等[10]客观原因存在一定应用局限性。综合临床特征、免疫、代谢以及分子病理等因素的综合评估体系可能较单一因素更为准确可靠。本研究回顾性分析大样本鼻咽癌患者数据,尝试将外周血免疫学特征纳入多因素预测模型,最终筛选出以下与远处转移相关的免疫及临床独立高风险因素:N3期、CD4/CD8比值<1.75、NK细胞数目≥257.5个/μL、LDH≥185.5 U/L以及PNI<52.74。据此建立的预测模型能较好地预测初诊远处转移患者,尤为重要的是,对早期以及隐匿性转移识别体现了较高的敏感度和特异度,具有较大的临床应用价值。
随着近年来肿瘤免疫相关研究的深入,越来越多的证据表明肿瘤患者宿主免疫细胞亚群变化特征与肿瘤的发生发展以及预后呈显著相关。如Thommen等[11-12]研究发现持续慢性病毒感染和肿瘤患者体内效应T细胞逐渐耗竭和失能,或是感染未控及肿瘤进展的重要因素之一。Nicholson等[13]研究也表明,细胞因子蛋白质抑制剂(SOCS)负性调控IL-15,从而抑制了NK细胞的发育和激活,最终导致肿瘤细胞免疫逃逸的发生。此外,有研究表明治疗后发生转移的鼻咽癌患者与未转移患者相比,外周血CD8+T淋巴细胞出现显著下降,且T细胞受体β链(TCRB)的多样性显著降低[14]。然而,目前关于初诊远处转移患者宿主免疫背景的研究仍较为缺乏。本研究创新性地纳入外周血免疫细胞亚群数量及比例,通过更为精确的单平台流式细胞术对淋巴细胞亚群数目及比例进行联合检测[15],有助于从免疫学角度进一步厘清初诊远处转移发生的部分机制。
本研究的局限性主要在于病例筛选可能存在偏倚。由于为回顾性研究,患者在治疗前是否接受外周血免疫细胞亚群检测取决于接诊医生,同时转移与非转移患者之间样本数量相差较大,两者均可能导致抽样误差,影响结果的客观性。此外,所有病例均来自单中心、非高发区,缺乏有广泛意义的外部验证队列;模型评估为高风险,但尚未远处转移证据的患者需要持续观察,对其预测能力可能具有更重要的临床意义。
综上所述,本研究揭示了初诊远处转移鼻咽癌患者的宿主免疫背景的特征性变化,并利用外周血免疫学相关指标,结合其他临床因素,建立了初诊鼻咽癌患者远处转移风险的预测模型。模型在临床分期、影像学等辅助检查之外,提供另一种识别早期转移的工具。研究纳入的预后指标除流式检查以外均为临床常规检查项目,而流式细胞术检测外周血免疫细胞亚群已在国内医院广泛开展,模型的经济性和临床可及性均有利于推广。该模型的运用和进一步完善可能有助于各中心提高早期或隐匿性转移患者的检出率,对提高此部分患者的生存率有重要意义。
