垂体促甲状腺激素腺瘤中SSTR表达谱及全数字切片自动图像分析的探索性研究
2022-05-14崔杰李晓欧幸兵张明肖雨王文泽
崔杰 李晓欧 幸兵 张明 肖雨 王文泽
垂体腺瘤是一组显示较高分化的神经内分泌肿瘤,约占颅内肿瘤的15%。而垂体促甲状腺激素(thyroid stimulating hormone,TSH)腺瘤是一种罕见的功能性垂体腺瘤,发病率不足0.01%oo/年,在垂体腺瘤中占比<2%,是导致继发性甲状腺功能亢进症的主要原因[1]。临床特征主要是血清游离甲状腺激素水平升高、血清TSH水平不被抑制并伴有不同程度甲亢和甲状腺肿表现,也可因肿瘤占位效应而出现视野缺损和头痛等症状。多数垂体TSH腺瘤为良性,但可表现局部侵袭,术中见肿瘤多质地韧,手术切除标本肉眼观察为纤维性质地的较韧肿物。手术是首选治疗方式。近年来随着对该病认识的提高以及激素检测和影像技术的普及,垂体TSH腺瘤的诊断率明显提升[2]。
垂体TSH腺瘤的分子机制尚未明确。生长抑素可以抑制多种器官中内分泌和外分泌细胞的分泌和增殖活性,其靶标分子是跨细胞膜的特异性生长抑素受体(somatostatin receptor,SSTR)。SSTR包括5个不同亚型(SSTR1~SSTR5),在不同神经内分泌肿瘤中有不同程度的表达。多项研究表明SSTR的表达与神经内分泌肿瘤的药物治疗反应相关。TSH腺瘤表达SSTR,是术前准备以及术后未缓解患者进行药物治疗的分子基础。目前在不同亚型的垂体腺瘤中关于SSTR表达谱的研究成为一大热点和焦点[3-5]。但由于该病罕见,关于TSH腺瘤中各型SSTR表达的研究较少[6-7],特别是关于各型SSTR在组织中的原位定位研究更为缺乏。
免疫组织化学是一种原位显示组织中特定蛋白表达水平的半定量研究,具有分辨目标蛋白定位(细胞膜、细胞质及细胞核)的优势。近年随着数字病理和图像智能化分析等技术的发展,基于数字化图像的全切片图像分析技术蓬勃发展,特别是在Her2等定位于细胞膜的抗体和Ki-67等定位于细胞核的抗体的免疫组织化学图像分析方面获得显著进展,成为应用在辅助诊断和科研方面的新工具[8-9]。
本研究在垂体TSH腺瘤病例组中利用免疫组织化学方法研究各型SSTR的表达情况,应用全数字切片自动图像分析技术与常规人工判读进行对比研究,为后续利用全数字切片自动分析技术对病例进行辅助诊断奠定理论及实践基础。
1 材料与方法
1.1 临床资料
收集2013年1月至2019年12月北京协和医院手术治疗且经病理确诊的垂体TSH腺瘤石蜡包埋组织样本及相应临床病理资料。入组标准:1)临床资料完整,符合TSH腺瘤的临床表现及实验室检查指标;2)术前未行放疗等辅助治疗;3)由3位有经验的病理医师确认,参照2017版世界卫生组织(WHO)内分泌肿瘤分类标准,结合形态学、免疫组织化学及临床病史等综合评估符合TSH垂体腺瘤;4)有足够的存档组织用于免疫组织化学检测。最终入组37例患者。
1.2 方法
1.2.1 免疫组织化学染色 组织标本均经常规中性福尔马林固定、脱水、石蜡包埋后进行4 μm厚切片。一抗分别采用SSTR1(购自德国Antibodies-online,小鼠单抗,ABIN2476549)、SSTR2 (购自英国ABCAM公司,兔单抗,ab134152)、SSTR4(购自德国Antibodies-online公司,小鼠单抗,ABIN2476551)和SSTR5(购自英国ABCAM公司,兔单抗,ab109495)。抗原修复方法方面SSTR1、SSTR4和SSTR5均采用酶消化法,SSTR2采用高压热修复法。抗体滴度SSTR1和SSTR2采 用1∶100稀 释,SSTR4和SSTR5采用1∶200稀释,常温湿盒孵育2 h后选用相应二抗孵育1 h。最后利用DAB显色,苏木素复染。各步骤间均严格采用PBS冲洗。过程中设置相应的阴性和阳性对照。
SSTR3较为特殊,先后分别采用了4种不同抗体,分别为Antibodies-online公司的小鼠单抗(ABIN247 6550)和ABCAM公司的3种兔多克隆抗体(ab28680、ab227601和ab198851),在6例不同垂体腺瘤及3例胰腺组织中试验了不同抗原修复方法(酶消化、微波及高压热修复)、不同的抗体滴度(1∶50至1∶500)以及不同的孵育时间(1~48 h)的不同组合。
1.2.2 人工判读评分及全数字切片自动化图像分析 各型SSTR染色均以细胞膜显示棕褐色标记为阳性,参照文献标准[7],按照着色强度和比例不同区分为阴性(无着色或<10%细胞膜着色,0分)、弱(≥10%细胞膜的弱而不完整着色,1分)、中(≥10%细胞膜的中等或局部细胞膜完整着色,2分)和强(≥10%细胞膜的强而完整着色,3分),见图1。全部病例由3位有资质的病理医师共同评估形成一致意见。
全部免疫组织化学染色切片由NanoZoomer S360数字切片扫描设备(C13220-01,购自日本滨松公司)按照明场、×40、单层、自动对焦扫描成数字化切片,分别导入 Aperio ImageScope 12.3.2.801 3图像分析软件,参照软件说明及相关文献,自动识别待分析组织切片区域,利用膜抗体Her2 评分参数、辅以人工微调校准(按照图1中各个评分图定标)后进行全数字切片自动化图像分析,评分结果自动输出。
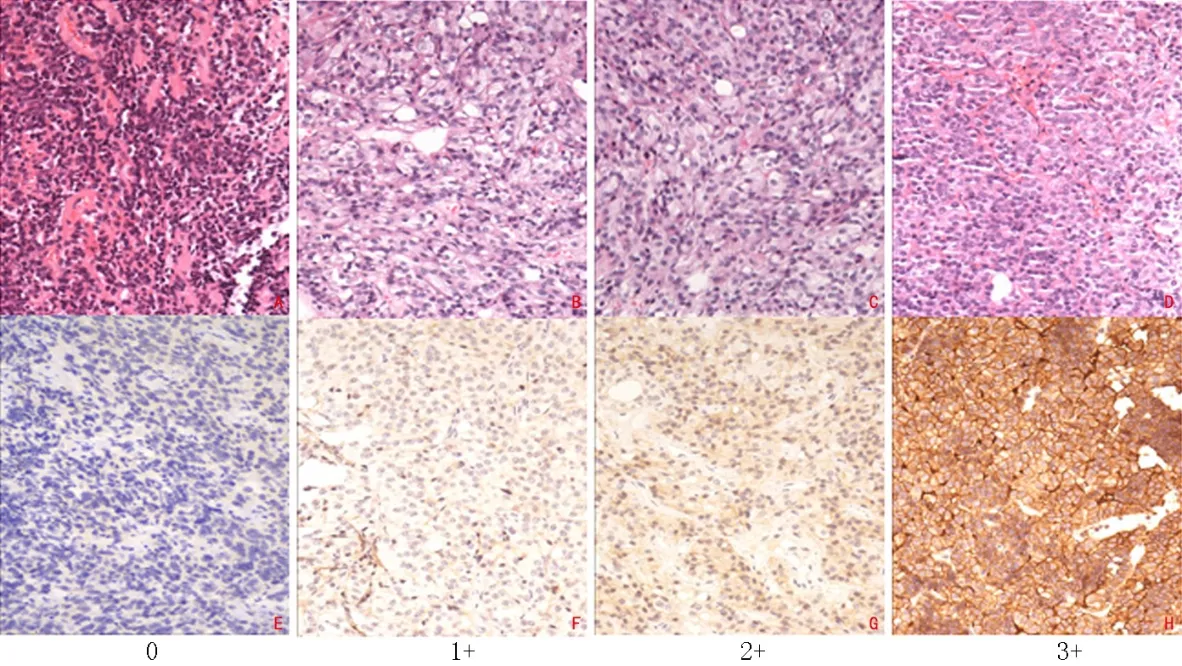
图1 SSTR2免疫组织化学0~3分染色图像
1.3 统计学分析
采用SPSS 23.0软件进行统计学分析。采用x2检验,比较各型SSTR不同评分分值占比的差异,以P<0.05为差异具有统计学意义。采用Spearman 等级相关分析,分析不同SSTR亚型之间的相关性,以及各型SSTR表达与性别、年龄、肿瘤大小、Ki-67指数以及侵袭的相关性。人工判读与软件图像自动分析的一致性评价采用组内相关系数(intraclass correlation coefficient,ICC)评价,ICC>0.6为一致性好。
2 结果
2.1 临床病理特征
入组37例患者,其中男性19例,女性18例;平均年龄43.3岁,中位年龄45岁。肿瘤平均最大径1.6(0.8~4.9)cm。Ki-67指数1%为83.8%(31/37),Ki-67指数2%为5例,Ki-67指数5%为1例。全部病例中有8例(21.6%)发现局部侵袭。
2.2 各型SSTR表达分析
SSTR3采用了4种不同抗体、在6例不同垂体腺瘤及3例胰腺组织中尝试了多种试验条件组合,均未能成功显色,所以未进行结果分析,但在文中后续部分进行讨论。
除SSTR3之外,另外4型SSTR均出现较高程度的细胞膜定位表达(表1,图1),两种评价方法均显示评分多为2分和3分,其中3分占比均超过50.0%(人工评分中3分占比最高,SSTR1、SSTR2、SSTR4和SSTR5的占比分别为59.5%、78.4%、64.9%和56.8%)。两种评价方法中占比最低的均是0分组(部分0分病例局部有非特异性的细胞质着色),其中全切片自动图像分析法在各型中0分组占比均为0(图2)。人工评价相比图像自动分析显示在评分两端(0分组和3分组)占比更高。无论何种评分方法,不同亚型之间是否高表达无显著性差异(P<0.05)。
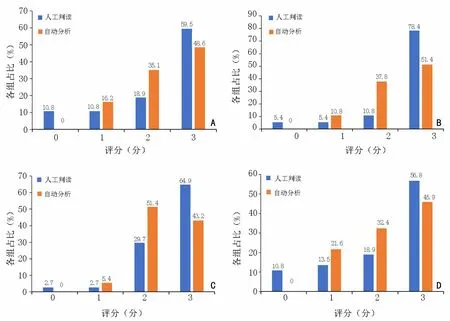
图2 人工判读和自动图像分析的SSTR1、SSTR2、SSTR4和SSTR5结果
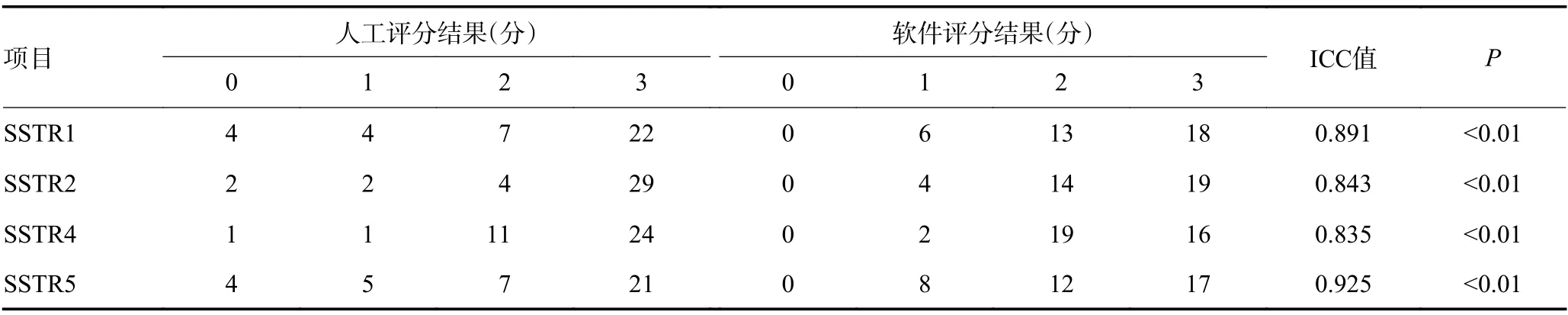
表1 37例TSH腺瘤各型SSTR评分汇总对比
采用Spearman法分析不同SSTR亚型之间的相关性表明,无论人工判读还是软件图像自动分析评分,SSTR1和SSTR2之间呈显著相关性(人工r=0.420,P=0.010;软件r=0.338,P=0.040),其余相互之间无明显相关性。
2.3 各型SSTR表达与性别、年龄、肿瘤大小、Ki-67指数以及侵袭的相关性
Spearman 相关分析结果表明,两种评分方法中仅SSTR1表达与侵袭呈负相关(人工r=-0.417,P=0.010;软件r=-0.406,P=0.013),而各型SSTR的表达与性别、年龄、肿瘤大小以及Ki-67指数均无明显相关性。
2.4 人工判读与自动化图像分析的一致性评价
除SSTR3之外,各型SSTR人工判读与图像自动分析的一致性采用ICC法评价,假定不存在交互效应的情况下,ICC值分别为0.891(SSTR1)、0.843(SSTR2)、0.835(SSTR4)和0.925(SSTR5),显示均具有较好的一致性,其中SSTR5一致性最好。各型SSTR评分结果汇总及统计对比见表1。
3 讨论
近年关于垂体腺瘤中SSTR表达谱的研究成为一大热点,多数是基于RT-PCR和蛋白免疫印迹的方法[3,5,10-11],采用免疫组织化学方法在垂体腺瘤组织中原位显示各型SSTR表达情况的研究较少,TSH腺瘤较罕见,关于TSH腺瘤中SSTR表达的研究更加缺乏,仅有为数不多的小规模病例研究[6-7,12],已发表的国内外文献中规模最大的研究仅纳入16例病例。本研究成功纳入37例病例,是数量较多的关于TSH腺瘤的研究。
本研究结果证实SSTR1、SSTR2、SSTR4和SSTR5在TSH腺瘤细胞膜上均有较高程度的表达,两种评分方法中3分占比均超过50.0%(人工评分中3分占比最高,SSTR1、SSTR2、SSTR4和SSTR5的占比分别为59.5%、78.4%、64.9%和56.8%)。当然,在垂体腺瘤中并非简单的“SSTR表达越高,使用相关药物效果越好”。其中涉及SSTR的复杂的病理生理作用机制,尚需深入详尽的转化医学研究[3]。相关性分析表明仅SSTR1的表达与TSH腺瘤的侵袭呈负相关(人工r=-0.417,P=0.010;软件r=-0.406,P=0.013),各型SSTR的表达与性别、年龄、肿瘤大小以及Ki-67指数均无明显相关性。本研究结果与之前关于其他类型垂体腺瘤的多数研究以及仅有的数篇关于TSH腺瘤的报道基本相符[1,5-7,12],提示以上4型SSTR,特别是SSTR1,可能在TSH腺瘤的发生、侵袭以及药物治疗反应中可能起重要作用。本研究中这几个SSTR亚型均选用新近商品化的单克隆抗体,具有相对更高的特异性。
本研究结果与之前文献报道最大的差异在于未能发现SSTR3的阳性表达,尽管本课题组先后使用了4种不同SSTR3抗体、在6例不同垂体腺瘤中尝试了多种实验条件组合,其原因可能是多方面的:1)有报道功能性垂体腺瘤中主要表达SSTR2和SSTR5,而SSTR3主要在垂体无功能腺瘤中表达[13]。因而可能在功能性腺瘤中SSTR3表达水平较低、低于免疫组织化学方法的检测下限。功能性垂体腺瘤也各有特点[14],可能TSH腺瘤具有相对独特的SSTR表达谱。2)之前关于TSH腺瘤中SSTR3表达的研究中,Herguido等[10]的研究证实TSH腺瘤中SSTR3 mRNA表达低,虽然该研究中描述使用免疫组织化学的方法证实6例TSH腺瘤中均有SSTR3表达,但其使用的抗体(ab137026[Abcam])说明书中明确表示仅适用于流式和免疫印迹法,并不适用于其所采用的的石蜡包埋组织。Korner等[15]的对比研究也证实,目前商品化的SSTR3抗体尚未具备足够特异性。垂体腺瘤中SSTR3的表达有待于更深入严谨的研究,特别是多层面(mRNA和蛋白)、多种方法(PCR、WB以及IHC)的系统化确证。
基于数字化全切片的图像自动分析技术是近来依赖于最新的人工智能自动化图像分析方法发展的新技术[8-9]。本研究将其首次应用于垂体腺瘤研究,结果显示,经过微调参数后,全数字切片自动化图像分析技术在TSH腺瘤的SSTR免疫组织化学表达评估中取得了与病理医师相当的评估效果,各型SSTR的ICC值分别为0.891(SSTR1)、0.843(SSTR2)、0.835(SSTR4)和0.925(SSTR5),显示均与人工评分具有较好的一致性。该技术的应用可提供重复性更好的免疫组织化学评估方法,有助于减少病理医师简单重复的图像评估工作[8-9]。
本研究尚有局限性:1)使用的是存档石蜡包埋组织样本,相对于新鲜组织具有不可逆的、伴随组织处理过程的继发改变。2)能够应用于石蜡包埋组织的稳定技术相对较少,检测其中mRNA的方法目前均要求短期固定标本,对于多年存档标本的检测效果均较差[16],导致本研究中仅采用了免疫组织化学的方法。3)图像自动分析技术仍在飞速发展,目前仍有一定局限性[8-9],如对非特异着色(细胞膜以外的着色)识别稍差,可能是其评分中无0分的原因;另外其对强染色时相邻不同细胞的细胞膜的区分度有待提高,这可能也是其高分(3分)组占比较低的潜在原因。上述问题的解决亟需图像分析算法方面有针对性的加强。
综上所述,本研究证实垂体TSH腺瘤肿瘤组织中SSTR1、SSTR2、SSTR4和SSTR5均有较高水平表达,利用基于数字化全切片的图像自动分析技术可获得与病理医师人工判读相当的评估效果。SSTR表达谱研究结果能否应用于临床涉及很多因素,包括表达的SSTR是否有缺陷、相应的分子背景以及细胞骨架蛋白和分子通路是否受到影响等,尚需要深入全面的系统研究[17],特别是详尽的表达谱研究结合细化的组织病理分型、药物反应和长期疗效的对比研究。
