短链脂肪酸抗癌机制研究进展*
2022-05-14杨荣张彤心钱莉
杨荣 张彤心 钱莉
肠道细菌及其代谢产物与癌症之间的联系是近年的研究热点,短链脂肪酸(short-chain fatty acid,SCFA)是结肠细菌酵解膳食纤维所得到的代谢产物,已有研究发现其在结直肠癌中发挥明显的抗癌效果。新近研究表明其在膀胱癌、乳腺癌、胃癌、肝癌、肺癌、胰腺癌和前列腺癌等多种肠道外癌症中均具有潜在的抗癌效应[1]。鉴于SCFA主要在结肠产生,之后可经过门静脉到达肝脏及全身[2],而乳腺癌与肠道菌群失调的联系是新兴的研究领域[3]。因而,本综述以结直肠癌、肝癌、乳腺癌为例,系统阐述SCFA促进癌细胞凋亡及周期阻滞、抑制癌细胞转移的具体机制,以及其对免疫细胞的调控作用。
1 SCFA的代谢过程
1.1 SCFA的生成
短链脂肪酸是一种由2~6个碳原子组成的脂类物质,包括醋酸盐、丙酸盐和丁酸盐等,其主要由肠道微生物酵解膳食纤维产生[4]。在机体的众多器官中,肠道内有着最大、最多样化的微生物群。膳食纤维不能被上消化道的消化酶消化,但能被结肠细菌酵解,如拟杆菌属、双歧杆菌属可以通过乙酰辅酶A途径酵解膳食纤维生成醋酸盐;拟杆菌属、韦永氏球菌属可以通过琥珀酸途径酵解膳食纤维生成丙酸盐;粪球菌属可以通过磷酸转丁酸酶/丁酸激酶途径酵解膳食纤维产生丁酸盐[5]。
1.2 SCFA的吸收
SCFA在结肠腔中产生后,由于醋酸盐、丙酸盐和丁酸盐的pKa值分别为 4.76、4.87 和4.82,因此在肠道环境中,SCFA很少通过简单扩散和低亲和力的转运机制进入结肠上皮,主要通过底物转运蛋白转运的方式进入结肠上皮,如通过单羧酸转运蛋白1介导的中等亲和力转运或钠偶联单羧酸转运蛋白1介导的高亲和力转运机制进入结肠上皮[6]。研究表明,SCFA在结肠吸收最多并随肠道的解剖走行而降低。因此,SCFA在盲肠和近端结肠中浓度最高,而在远端结肠中浓度下降[5],此与左、右半结肠癌发病率不同,有一定的相关性。部分SCFA在肠道中被完全消耗,剩余部分可经门静脉到达全身发挥作用[2]。
2 SCFA抗癌机制
SCFA可以被癌细胞表面的G蛋白偶联受体(G protein-coupled receptor,GPCR)特异性识别。此外,由于SCFA分子量较小,所以SCFA还可以进入癌细胞的细胞核内,抑制组蛋白去乙酰化酶(histone deacetylase,HDAC)的活性,进而上调组蛋白乙酰化及巴豆酰化,发挥直接抗癌作用。SCFA还可以通过调节免疫细胞发挥间接抗癌作用(图1):肠道细菌酵解膳食纤维后产生SCFA,其不仅可以作用于肠道,还能经门静脉系统到达肝脏及全身发挥抗癌作用;SCFA被癌细胞表面的GPCR特异性识别后,通过增加TNF-α的分泌、上调Fas-L的表达、降低Bcl-2的表达、下调CDK及Cyclin活性、抑制MAPK/ERK通路,从而发挥促进癌细胞凋亡、周期阻滞及抑制癌细胞转移的作用。SCFA进入癌细胞核内,通过抑制HDAC,进而增加TNF-α的分泌、上调Fas-L的表达,降低氧消耗或乳酸代谢;下调Cyclin活性、上调CDK抑制剂p21基因的表达;抑制Akt/ERK通路,从而发挥促进癌细胞凋亡、周期阻滞和抑制癌细胞转移的作用。SCFA可以增强B细胞分泌IgA以及IgG的能力、增强T细胞分泌IFN-γ的能力、增强癌细胞表面MICA/B表达,进而增加NK细胞的识别能力、增强巨噬细胞产生ROS的能力。
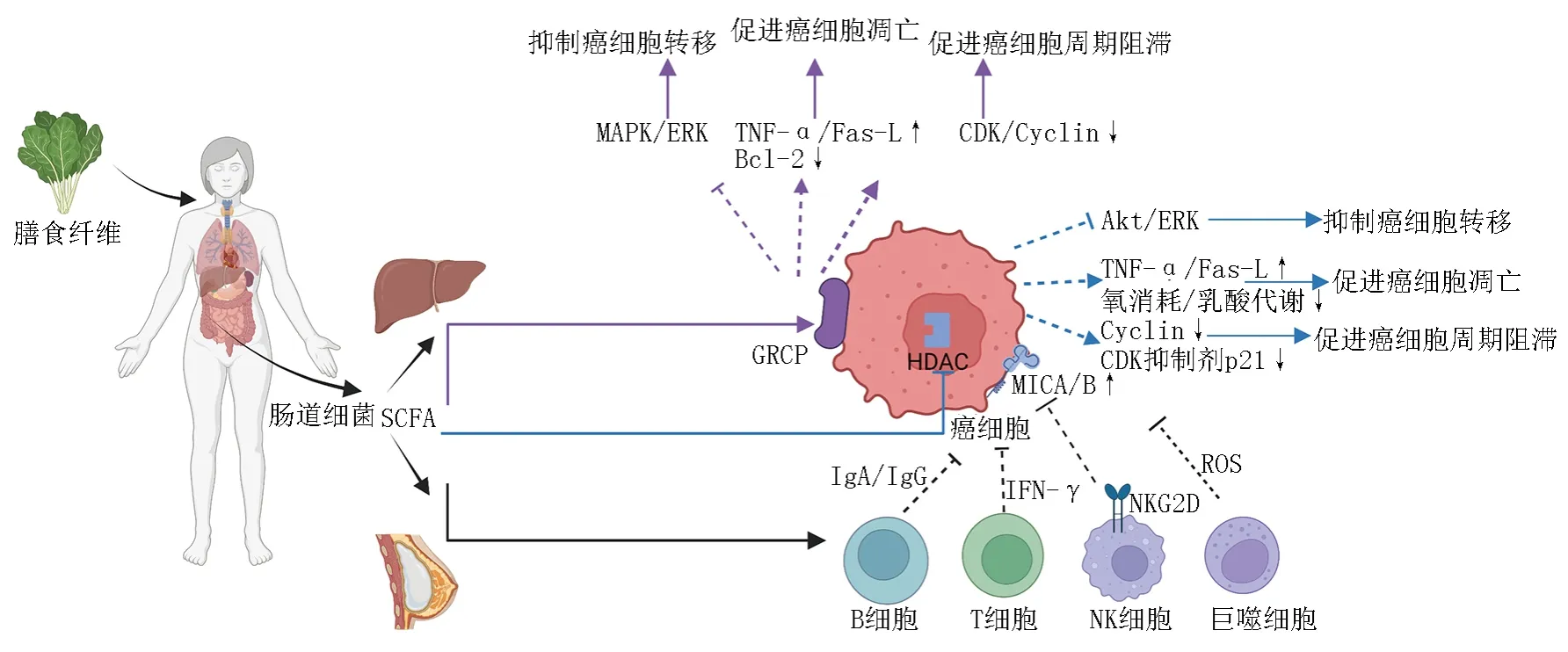
图1 SCFA抗癌机制
2.1 作用于GPCR
SCFA可以被癌细胞表面的GPCR特异性识别,进而激活下游的信号通路,促进癌细胞的凋亡、诱导癌细胞周期阻滞,减弱癌细胞的转移和侵袭能力。已知的SCFA受体包括GPR41、GPR43以及GPR109A。醋酸盐、丙酸盐、丁酸盐均可作为GPR41、GPR43的激动剂,丁酸盐同时可作为GPR109A的激动剂[7]。
2.1.1 促进癌细胞凋亡 SCFA作用于癌细胞表面的GPCR后可以通过死亡受体凋亡途径以及线粒体凋亡途径诱导癌细胞凋亡。
死亡受体凋亡途径主要由TNF家族以及Fas家族介导。有研究发现,在肝癌细胞中,丙酸盐激活GPR41后可增加TNF-α的分泌,从而诱导肝癌HepG2细胞凋亡[8]。SCFA作用于GPR109A后还可以升高促凋亡基因Fas-L的表达[9],进而促进癌细胞凋亡。
线粒体凋亡途径主要受线粒体外膜的Bcl-2家族调控,Bcl-2家族中的Bcl-2基因可以通过阻断细胞色素c释放等途径,发挥抗凋亡作用。有研究表明在捷克队列中,乙酸和丙酸水平不足与结直肠癌风险增加有关[10],并且在结直肠癌细胞中,SCFA激活GPR43后可以增加含caspase-3/6/7/8的切割,降低Bcl-2的表达[5]。已知NF-κB可以激活抗凋亡基因Bcl-2,而SCFA已被证明可以通过激活 GPR43-β-arrestin 2 介导的替代信号通路,抑制NF-κB的核转位,进而促进癌细胞的凋亡[11]。
2.1.2 诱导癌细胞周期阻滞 细胞周期分为G0/G1、S、G2及M期,主要受细胞周期蛋白(cyclin)以及细胞周期蛋白依赖性激酶 (cyclin-dependent protein kinase,CDK)调控,CDK与cyclin结合后推动细胞周期的进行。有研究表明,SCFA激活GPR43后降低CDK1、CDK2、cyclin D3的表达并以p53非依赖性的方式增加CDK抑制因子p21的表达,导致癌细胞周期阻滞[5]。此外,SCFA作用于癌细胞表面的GPR109A后,可以下调cyclin D1、cyclin B1等周期蛋白以及CDK1的表达,从而诱导癌细胞周期阻滞[5,9]。
2.1.3 减弱癌细胞的转移和侵袭能力 已知上皮-间充质转化与癌症转移密切相关,其特征包括E-钙黏蛋白表达缺失以及细胞骨架重排[12]。在乳腺癌细胞系MDA-MB-231和MDA-MB-436中,SCFA通过作用于癌细胞表面的GPR43,调节大肿瘤抑制基因1蛋白,进而促进Yes-相关蛋白1磷酸化,使癌细胞E-钙黏蛋白表达量升高、应力纤维含量明显降低[13]。在乳腺癌细胞系MDA-MB-231中,SCFA还可以通过激活GPR41,抑制MAPK/ERK通路,减少癌细胞中应力纤维的含量。这些均提示SCFA可能具有抑制乳腺癌细胞的转移及侵袭能力[12-13]。此外,丁酸盐在体外作用于人结直肠癌细胞系RKO后,通过激活GPR41抑制MAPK/ERK2信号通路,以剂量依赖性方式抑制RKO细胞迁移[6]。
2.2 上调组蛋白乙酰化水平
已有研究表明,SCFA可以通过抑制HDAC,上调组蛋白乙酰化水平,产生转录和开放活性更高的染色质,进而促进细胞凋亡和细胞周期阻滞的特定基因的转录[4]。
SCFA通过抑制HDAC,诱导癌细胞的凋亡。在肝癌HepG2细胞中,丙酸盐通过抑制HDAC,增加TNF-α 的分泌,从而诱导HepG2细胞凋亡[8]。此外,在乳腺癌细胞系MCF-7中,丁酸盐通过抑制HDAC上调Fas水平,以不依赖p53的方式增强Fas触发的死亡受体凋亡途径[14]。已知氧气和乳酸均能被癌细胞利用,而SCFA可以参与调节癌细胞系的能量代谢,如丁酸钠可以通过抑制HDAC诱导乳腺癌细胞系的氧消耗或抑制乳酸代谢[14],进而促进乳腺癌细胞的凋亡。
SCFA通过抑制HDAC,诱导癌细胞周期阻滞。有研究表明,丁酸盐可以通过抑制HDAC8降低JAK2/STAT信号通路的活性,进而使得cyclin D1的活性降低,促进癌细胞周期阻滞。此外在乳腺癌细胞系中,丁酸盐还可发挥HDAC抑制活性使CDK抑制剂p21基因表达上调,从而诱导癌细胞周期阻滞[14]。
SCFA通过抑制HDAC,发挥抑制癌细胞转移的作用。蛋白激酶B(Akt)和ERK信号通路参与调节细胞骨架,激活后可以增强癌细胞的运动和侵袭能力。有研究发现,在体外人结直肠癌细胞系HCT116、HT29、LOVO和HCT8中,加入丁酸盐可以阻断HDAC3活性使Akt/ERK信号通路失活,使癌细胞的运动能力下降,提示丁酸盐可以阻碍结直肠癌细胞的转移和侵袭[15]。此外,miR-31可以通过介导肌动蛋白细胞骨架细胞的重塑减弱癌细胞的转移和侵袭能力。有研究表明,在MDA-MB-231中加入丁酸盐后可以阻断HDAC2活性使miR-31表达上调[16],并且在MDA-MB-231中,利用5-氮杂-2′-脱氧胞苷增强miR-31表达后,Transwell实验发现乳腺癌细胞的迁移和侵袭能力减弱[17],提示丁酸盐可抑制乳腺癌转移。
2.3 上调组蛋白巴豆酰化水平
SCFA可能通过上调组蛋白巴豆酰化发挥一定的抗癌作用。组蛋白巴豆酰化是一种新发现的表观遗传修饰,具有较强的调节基因表达的能力[18]。有研究发现,SCFA可以通过抑制HDAC活性,促进人结肠癌细胞系HCT116和C57BL/6小鼠小肠类器官培养物中的组蛋白巴豆酰化,并且组蛋白巴豆酰化与细胞停滞于G2~M期有关[19]。此外,有研究表明组蛋白巴豆酰化水平升高会抑制内吞相关基因和促生长基因的表达[20],进而抑制癌细胞摄取能量及生长。此外,有研究发现在肝癌细胞系Huh-7移植小鼠中,敲低HDAC或添加HDAC抑制剂后可以上调巴豆酰化水平;提高组蛋白巴豆酰化后,Transwell实验发现肝癌细胞迁移能力减弱。此外,将Huh-7细胞皮下注射至裸鼠的侧腹区域并给小鼠腹腔注射HDAC抑制剂曲古抑菌素(TSA),24天后称取小鼠肿瘤重量,发现与未给予TSA的荷瘤小鼠相比,小鼠肿瘤重量较低,提示上调组蛋白巴豆酰化后可能抑制肝癌细胞的进展[21]。
2.4 SCFA通过调节免疫细胞间接发挥抗癌效应
SCFA可以通过调节固有免疫细胞及特异性免疫细胞功能塑造局部肠道和全身免疫环境,从而发挥抗癌作用。
2.4.1 增强固有免疫细胞的功能 固有免疫细胞包括巨噬细胞、自然杀伤(natural killer,NK)细胞等,SCFA可能具有参与固有免疫系统的重塑、增强固有免疫系统的抗癌作用。
SCFA可以增强巨噬细胞的抗癌效应。活性氧(reactive oxygen species,ROS)是巨噬细胞发挥吞噬和杀伤作用的主要介质。有研究表明,丁酸盐处理的巨噬细胞糖酵解代谢途径减少、戊糖磷酸代谢途径增多,这可能有助于还原型烟酰胺腺嘌呤二核苷酸磷 酶(nicotinamide adenine dinucleotide phosphate,NADPH)的产生,进而促进NADPH氧化酶依赖性ROS产生,诱导癌细胞凋亡[22]。M1型巨噬细胞主要发挥抗癌效应,而M2型巨噬细胞有利于癌症进展。有研究表明,SCFA可通过SCFA-GPR43-RhoA-YAP轴,增加p53水平,抑制M1型巨噬细胞向M2型巨噬细胞极化[11]。另外有研究发现,SCFA能够诱导分离的脂肪组织中的M2型巨噬细胞分泌TNF-α[23],诱导癌细胞凋亡。
SCFA可以增强NK细胞的抗癌效应。NK细胞2族成员D受体(natural killer group 2 member D,NKG2D)表达于NK细胞表面[24]。NKG2D通过与其配体MHC I链相关分子A和B家族(MHC class I chain-related molecule A/B,MICA/B)接触,激活NK细胞的细胞毒性,通过释放穿孔素、颗粒酶等途径杀伤癌细胞,还能增强T细胞的共刺激信号,发挥NK细胞的抗原提呈作用[25]。有研究发现,癌细胞表面MICA/B的表达水平下降,不利于NKG2D识别,而丙酸盐诱导的乙酰化可以上调癌细胞表面MICA/B的表达[24],从而增强NK细胞对癌细胞的识别作用。
2.4.2 增强特异性免疫细胞的功能 SCFA能够增强B细胞的抗癌作用。B细胞主要通过分泌抗体,进而以抗体依赖性细胞毒作用、吞噬作用和补体激活途径发挥抗癌效应[26]。早期研究发现,食用膳食纤维可以增加动物体内的抗体水平,恢复体液免疫[27],提示SCFA可以通过不依赖SCFA受体的途径促进B细胞分化为能够产生抗体的细胞;此外,乙酸盐还可以通过作用于GPR43受体,促进B细胞分化,增加IgA、IgG的分泌水平,进而发挥抗癌效应。
SCFA能够增强CD4+T细胞的抗癌作用。抗原识别后,CD4+T细胞主要通过分泌细胞因子激活其他抗癌细胞的功能。有研究表明SCFA可以增强效应CD4+T细胞的功能[28],且在非稳态条件下,丁酸盐能够增强CD4+T细胞分泌γ-干扰素(interferon-γ,IFN-γ)的能力;IFN-γ能够提高NK细胞、巨噬细胞的活性,还可以直接诱导癌细胞凋亡等发挥抗癌效应[29]。
SCFA能够增强CD8+T细胞的抗癌作用。CD8+T细胞在抗肿瘤免疫中起着核心作用,可以通过释放颗粒酶、穿孔素、组织蛋白酶 C或者Fas-FasL途径直接杀伤带有致敏抗原的癌细胞[30]。有研究表明SCFA受体GPR43的缺失,会促进CD8+T细胞的耗竭,进而促进结直肠癌的发生[31]。也有研究发现醋酸盐可以激活低反应性的CD8+T细胞,增加IFN-γ的分泌[32]。此外,丁酸盐可以增强活化 CD8+T细胞的记忆潜力,醋酸盐可以增强记忆CD8+T细胞分泌IFN-γ的能力[32],发挥抗癌作用。
SCFA可以通过上调抗PD-1的疗效,间接增强特异性免疫。近年来,抗PD-1/PD-L1免疫疗法成为一种有前途的治疗癌症的方法[33],此疗法可以抑制肿瘤免疫逃逸、增加T细胞的功能,已在多种癌症中发挥显著作用。但由于恶性肿瘤的异质性,有的患者疗效不佳[34]。有研究表明采用结直肠癌患者肠道菌群培养的荷瘤小鼠在摄入可溶性膳食纤维果胶后,小鼠体内丁酸含量升高;与单独使用抗PD-1疗法的荷瘤小鼠相比,抗PD-1单抗与果胶联合使用时显示疗效显著增强[35]。此外,与单独使用抗PD-1的黑色素瘤患者相比,高浓度SCFA与抗PD-1单抗联合治疗的患者无进展生存期延长[36]。肾细胞癌患者在摄入能够产生丙酸盐和醋酸盐的新菌种Akkermansia muciniphila后,抗PD-1疗效也有所增加[37]。
3 结语与展望
SCFA是肠道微生物酵解膳食纤维所得到的脂类物质,可以通过调节饮食或给予细菌等途径调节体内水平。在精准医疗时代,如何精确有效地操纵群落属性是一个重要的研究目标。研究并开发微生物导向食品、采用新辅助化疗方案,从而有选择性地增加有益人体的肠道微生物丰度和SCFA水平具有良好的应用前景。越来越多的研究发现SCFA在多种癌症中发挥重要作用,鉴于其抗癌作用以及安全可靠、能够调控等特性,有望通过制定合理规范的饮食指南、给予有益菌群或粪便移植等方法,达到治疗或缓解癌症的效果。值得注意的是,虽然SCFA具有潜在的抗癌效果,但是关于SCFA在肠道外发挥作用的研究比较有限,肠道微生物群与肠外癌症的联系是一个新兴的研究领域,随着多组学尤其是代谢组学的使用,相信可以快速证明肠道微生物群和多种癌症之间更精确的联系,并将这些发现引入临床实践。
