治疗前外周血炎性标志物对EGFR突变阳性晚期非小细胞肺癌患者的预后价值研究*
2022-05-14许静马希雅高红军杨绍兴秦海峰王红梁伟林刘晓晴
许静 马希雅 高红军 杨绍兴 秦海峰 王红 梁伟林 刘晓晴
据最新统计数据显示,乳腺癌发病率首次超越肺癌成为全球发病率最高的癌种,但肺癌仍是癌症相关死亡的最主要原因[1]。随着医学诊疗技术的发展,晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)的治疗策略发生了巨大变化。研究表明,与标准化疗相比,一线酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)治疗EGFR突变阳性晚期NSCLC的应答率和无进展生存期(progression-free survival,PFS)增加了1倍[2],但最终均不可避免出现获得性耐药[3]。目前基于组织或血液的分子标志物检测可确定最有可能从靶向治疗中获益的患者,但在实际临床工作中,许多患者无法提供足够的肿瘤组织进行基因检测,血液基因检测也容易出现假阴性的结果。所以进一步探索与靶向治疗疗效相关的生物标志物仍有重要意义。
炎症是肿瘤微环境的重要特征,与各种类型肿瘤的不良预后有关。中性粒细胞、淋巴细胞、血小板等血液学炎症参数可以反映肿瘤的免疫状态,对肿瘤的预后有重要的预测价值。有研究评估了一些血细胞计数指标的价值,包括中性粒细胞与淋巴细胞计数比值(neutrophil-to-lymphocyte ratio,NLR)、血小板与淋巴细胞计数比值(platelet-to-lymphocyte ratio,PLR)、淋巴细胞与单核细胞计数比值(lymphocyte-to-monocyte ratio,LMR)、系统免疫炎症指数(systemic immune-inflammation index,SII)等,并证明这些炎性标志物在不同的肿瘤中具有预测作用,包括NSCLC[4],但是这些炎性标志物在肺癌预后中的意义仍存在争议。本研究回顾性探讨NLR、PLR、SII及LMR与接受靶向治疗的EGFR突变阳性晚期NSCLC患者疗效的相关性。
1 材料与方法
1.1 临床资料
选取2015年1月至2018年10月在中国人民解放军总医院第五医学中心接受治疗的EGFR突变阳性晚期NSCLC住院患者。纳入标准:1)经组织病理学确诊为NSCLC;2)年龄≥18岁;3)分子鉴定EGFR激活突变(外显子19的碱基对缺失或外显子21的点突变);4)完整的影像学数据,如CT和MRI数据,用于肿瘤分期;5)肿瘤分期包括不可手术切除的Ⅲb~Ⅳ期患者;6)美国东部肿瘤协作组(ECOG)评分≤2分;7)在治疗前1周内确定的建立NLR、PLR、SII和LMR的实验室完整血常规结果;8)预计生存期超过3个月;9)签署治疗知情同意并接受后续随访。排除标准:1)合并其他肿瘤;2)合并其他急性炎症反应;3)合并其他系统性血液或免疫性疾病;4)曾长期接受激素治疗;5)合并乙型肝炎或丙型肝炎病毒感染。本研究共纳入符合入组标准患者142例。
1.2 方法
采集并记录患者确诊时的临床资料,包括年龄、性别、吸烟史、ECOG评分、肿瘤分期、病理类型、基因突变检测情况等。患者肿瘤治疗资料,包括治疗方案、治疗2个周期后疗效评价,治疗期间的影像学资料,治疗前1周内的中性粒细胞、淋巴细胞、单核细胞及血小板计数。通过医院就诊记录以及电话随访获取患者的生存状态,中位随访时间32个月,末次随访时间为2021年10月。
肿瘤分期基于国际肺癌研究协会发布的第8版分期标准。根据实体瘤反应评价标准(RECIST)1.1版对治疗效果进行评价,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。本研究对PFS和总生存期(overall survival,OS)进行观察。PFS定义为从接受治疗开始至疾病进展或死亡的时间,OS定义为从初次治疗开始至死亡或随访终点时间。
1.3 统计学分析
采用SPSS 26.0软件和GraphPad Prism 9.0软件进行统计学分析和科研绘图。以NLR、PLR、SII和LMR为检验变量,以随访的最终生存状态为状态变量,绘制受试者工作特征(receiver operating characteristic curve,ROC)曲线,计算曲线下面积(area under the curve,AUC),并以约登指数最大值确定NLR、PLR、SII和LMR预测疗效的最佳临界值,根据最佳临界值将患者分为NLR、PLR、SII、LMR高值组和低值组。应用Kaplan-Meier方法进行生存分析,Log-rank检验差异性;单因素和多因素Cox比例风险回归分析评价各变量的预后价值;计量资料采用非参数检验,计数资料采用χ2检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 临床特征
共142例患者入组,其中男性58例,女性84例;中位年龄为60(34~77)岁,其中年龄≤65岁111例(78.2%),>65岁31例(21.8%);ECOG PS 0~1分117例(82.4%);有吸烟史49例(34.5%),无吸烟史93例(65.5%);Ⅳ期139例(97.9%),Ⅲb期3例(2.1%);腺癌134例(94.4%),非腺癌8例(5.6%)。所有患者均接受了EGFR基因检测,其中19外显子缺失突变73例(51.4%),21外显子L858R突变69例(48.6%);远处转移数量≥2个69例(48.6%);脑转移51例,骨转移74例,肺内转移77例;初治114例(80.3%),接受二线治疗28例(19.7%);治疗方案中接受单一靶向治疗114例(80.3%),靶向联合抗血管生成治疗18例(12.7%),靶向联合化疗10例(7.0%);2个周期后疗效评价,无CR,PR 110例(77.5%),SD 28例(19.7%),PD 4例(2.8%)。
2.2 NLR、PLR、SII和LMR的ROC曲线相关参数
ROC曲线结果显示,142例患者中(死亡83例,生存59例),NLR、PLR、SII和LMR的AUC分别为0.781(95%CI:0.704~0.859,P<0.001)、0.715(95%CI:0.631~0.798,P<0.001)、0.774(95%CI:0.696~0.851,P<0.001)和0.675(95%CI:0.586~0.763,P<0.001),最佳临界值分别为2.60、167.32、687.39和3.13(图1)。
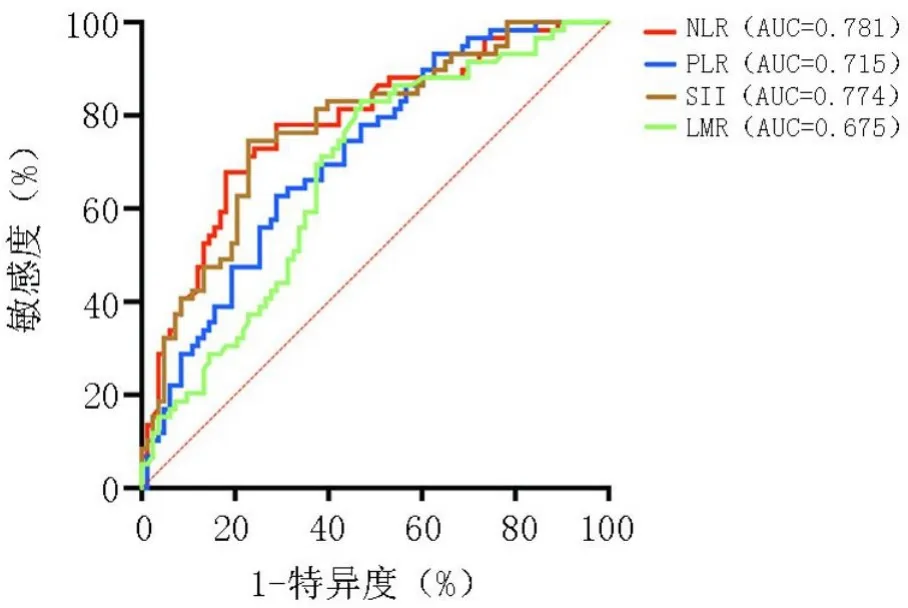
图1 NLR、PLR、SII和LMR的ROC曲线
2.3 治疗前炎性标志物与PFS及OS的关系
根据ROC曲线,NLR预测PFS和OS的最佳临界值为2.60,AUC值为0.781。根据最佳临界值将患者分为两组,低NLR组(NLR<2.60)55例,高NLR组(NLR≥2.60)87例。治疗前低NLR组中位无进展生存期(median progression-free survival,mPFS)及中位总生存期(median overall survival,mOS)较高NLR组延长,低NLR组mPFS为18.0个月(95%CI:14.775~21.225),显著高于高NLR组的12.0个月(95%CI:9.914~14.086,P<0.001);低NLR组mOS为41.0个月(95%CI:36.477~45.523),较高NLR组mOS为25.0个月(95%CI:21.953~28.047)延长(P<0.001,图2A,2B)。
PLR预测PFS和OS的最佳临界值为167.32,AUC值为0.715。根据最佳临界值将患者分为两组,低PLR组(PLR<167.32)61例,高PLR组(PLR≥167.32)81例。治疗前低PLR组mPFS和mOS较高PLR组延长,低PLR组mPFS为16.0个月(95%CI:13.920~18.080),显著高于高PLR组的12.0个月(95%CI:10.236~13.764,P=0.002);低PLR组mOS为41.0个月(95%CI:29.358~52.642),较高PLR组mOS为27.0个月(95%CI:23.636~30.364)延长(P<0.001,图2C,2D)。
SII预测PFS和OS的最佳临界值为687.39,AUC值为0.774。根据最佳临界值将患者分为两组,低SII组(SII<687.39)63例,高SII组(SII≥687.39)79例。治疗前低SII组mPFS和mOS较高SII组延长,低SII组mPFS为18.0个月(95%CI:16.067~19.933),显著高于高SII组的10.0个月(95%CI:8.166~11.834,P<0.001);低SII组mOS为46.0个月(95%CI:37.150~54.850),较高SII组mOS为25.0个 月(95%CI:22.387~27.613)延 长(P<0.001,图2E,2F)。
LMR预测PFS和OS的最佳临界值为3.13,AUC值为0.675。根据最佳临界值将患者分为两组,低LMR组(LMR<3.13)54例,高LMR组(LMR≥3.13)88例。治疗前低LMR组的mPFS和mOS较高LMR组缩短,低LMR组mPFS为12.0个月(95%CI:9.841~14.159),低于高LMR组的16.0个月(95%CI:14.035~17.965,P=0.001);高LMR组mOS为39.0个月(95%CI:30.520~47.480),较低LMR组的26.0个月(95%CI:22.399~29.601)显著延长(P<0.001,图2G,2H)。
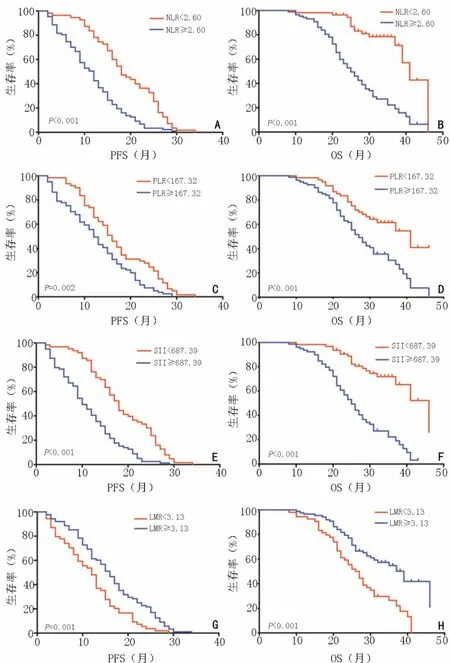
图2 Kaplan-Meier生存分析曲线
2.4 治疗前炎性标志物与患者临床特征的相关性分析
根据4种炎性标志物的最佳临界值分别将患者分为高值组和低值组。单因素分析显示,远处转移数量≥2个(P=0.020)、既往接受过一线治疗(P=0.036)与NLR≥2.60呈正相关;女性(P<0.001)、无吸烟史(P=0.021)和一线治疗(P=0.006)与LMR≥3.13呈正相关。PLR和SII与远处转移数量及治疗线数无显著相关性(P>0.05)。治疗前NLR、PLR、SII和LMR水平与年龄、ECOG评分、EGFR突变类型和远处转移部位均无显著相关性( P>0.05)。
2.5 单因素和多因素COX回归分析
应用Cox回归模型对PFS和OS进行单因素和多因素分析,纳入因素包括年龄、性别、吸烟史、病理类型、基因突变状态、肿瘤分期、远处转移数量及部位、治疗前NLR、PLR、SII和LMR水平等。单因素分析中发现治疗前NLR<2.60、PLR<167.32、SII<687.39和LMR≥3.13与较长的PFS和OS相关(均P<0.05),远处转移数量和骨转移与PFS相关(均 P<0.05);性别、骨转移与OS相关(均 P<0.05)。多因素分析结果表明,治疗前低水平NLR、PLR、SII和高水平LMR与较长的PFS和OS独立相关,骨转移是较差OS的独立影响因素(均 P<0.05,表1,2)。
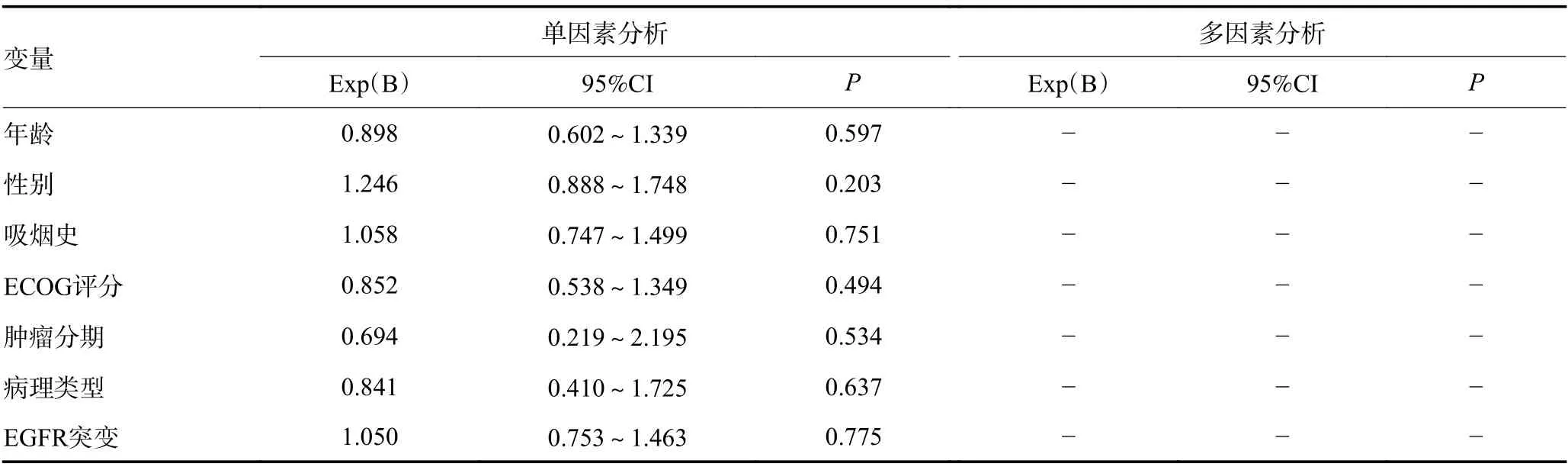
表1 PFS的单因素及多因素Cox回归分析
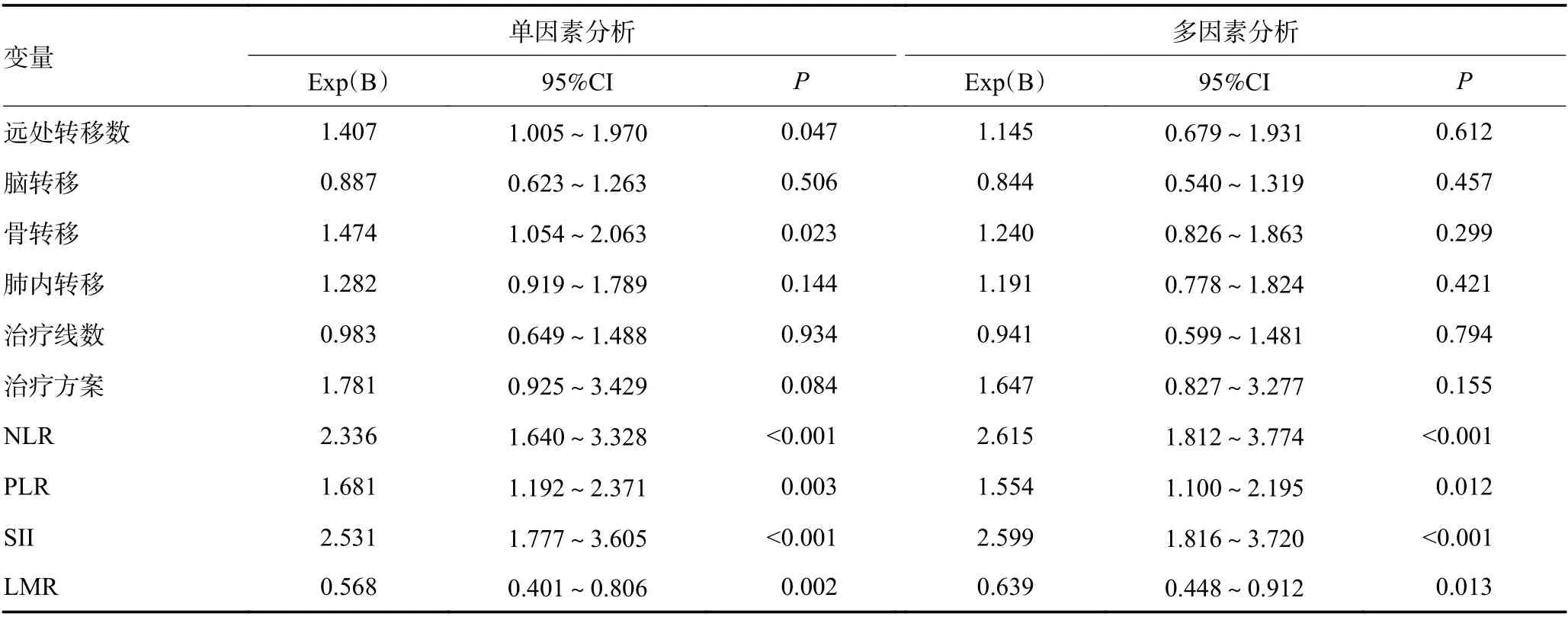
表1 PFS的单因素及多因素Cox回归分析 (续表1)
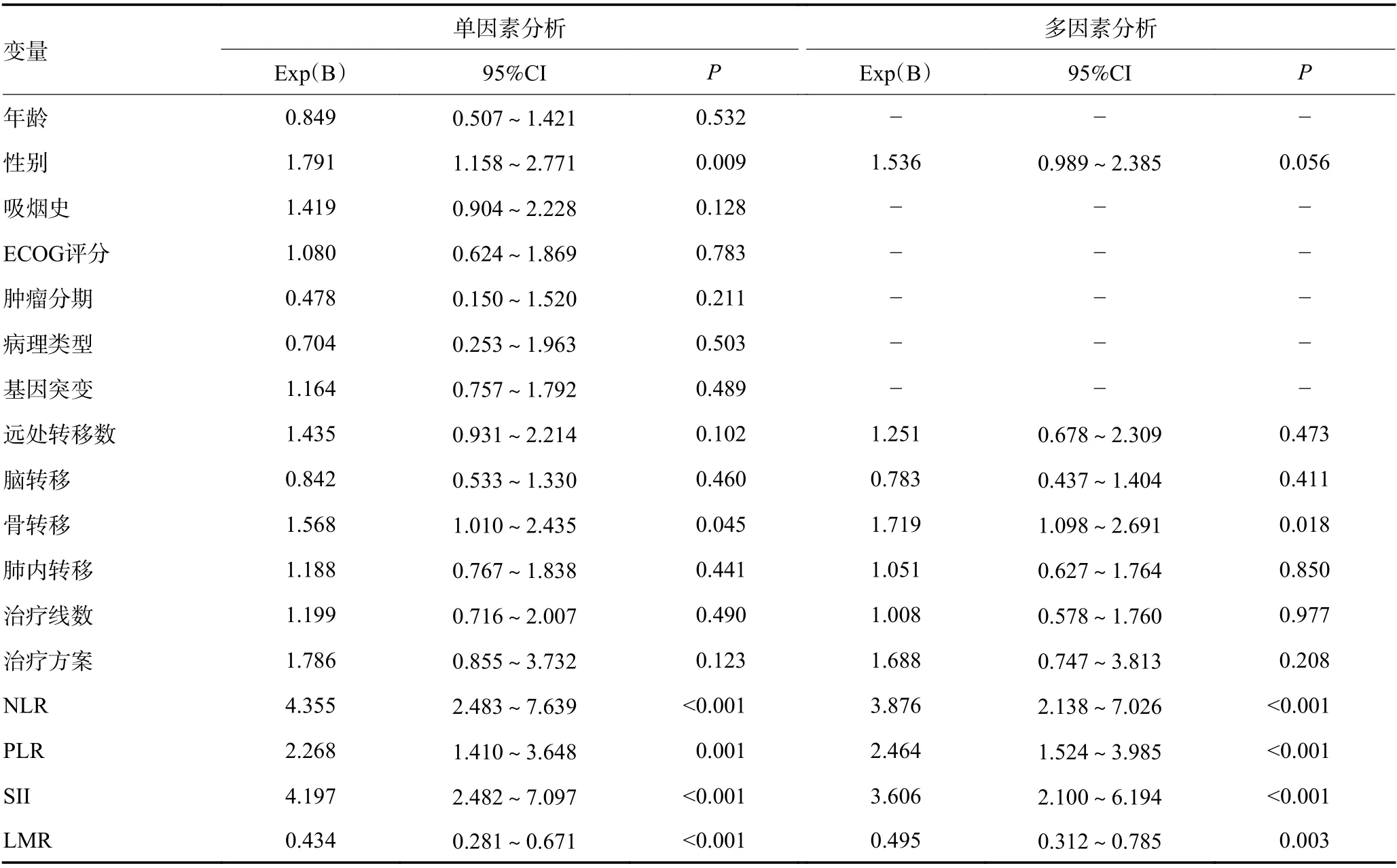
表2 OS的单因素及多因素Cox回归分析
3 讨论
靶向治疗已成为EGFR突变阳性晚期NSCLC的重要治疗策略。本研究发现治疗前NLR、PLR、SII和LMR水平与接受靶向治疗的晚期NSCLC患者的预后显著相关,相比于脑转移和肺内转移,骨转移患者的预后更差。既往已有研究NLR、PLR和LMR在内的炎性标志物对多种恶性肿瘤的预后价值[5-7]。在肺癌领域也有部分报道,但主要集中于接受化疗、放疗和免疫治疗的患者,关于炎性标志物对接受靶向治疗的EGFR突变阳性晚期NSCLC预后价值的研究较少,且结论不统一。Lin等[8]的研究结果显示,在使用一线EGFR-TKI治疗的EGFR突变阳性晚期NSCLC患者中,治疗前高水平NLR与其预后不良有关,是PFS和OS的独立预后因素。相反,Sim等[9]提示治疗前NLR水平对接受一线化疗的EGFR突变阳性晚期NSCLC患者是一个显著的预后因素,但不是接受一线EGFR-TKI治疗患者的预后因素。有研究表明[10-11],基线低水平LMR与晚期NSCLC患者的不良预后显著相关。本研究进一步证实,治疗前NLR、PLR和LMR水平可能是EGFR突变阳性晚期NSCLC患者PFS和OS的独立影响因素。虽然NLR、PLR和LMR可以帮助评估靶向治疗的预后,但这3项指标仅整合了2种细胞类型。SII是一种新的外周血中性粒细胞、淋巴细胞和血小板计数的综合检测方法,与晚期NSCLC的预后密切相关。本研究结果证实,在接受靶向治疗的EGFR突变阳性晚期NSCLC患者中,基线低SII者有更长的PFS和OS。
肺癌的发生和发展是一个多因素复杂的过程。近年有研究发现肿瘤相关炎症不仅可能促发肿瘤,还可能通过影响肿瘤细胞的增殖、促进血管生成和诱导放化疗抵抗等,在肿瘤的发生发展中发挥重要作用[12]。中性粒细胞、淋巴细胞、单核细胞和血小板是肿瘤炎症反应中的相关细胞,中性粒细胞通过分泌细胞因子和趋化因子[13]抑制细胞毒性免疫细胞,从而抑制宿主对癌症的免疫应答。尽管淋巴细胞减少与患者不良预后之间的关系尚不完全清楚,但有研究报道免疫反应的强弱与淋巴细胞的数量呈正比[14]。此外,有研究证明血小板可能参与肿瘤细胞的增殖侵袭、血管生成和肿瘤免疫逃逸等多个环节[15]。NLR、PLR和LMR反映了宿主免疫应答和癌症进展,这可能解释NLR、PLR和LMR作为潜在预测因子的作用。但关于炎性标志物对肿瘤预后和治疗疗效的影响仍存在许多问题,如尚未建立统一的界值,炎性标志物动态变化对治疗疗效的影响,通过干预外周血炎性标志物能否改善患者生存等,上述问题均有待于大样本前瞻性研究进行解答。
综上所述,本研究表明治疗前外周血NLR、PLR、SII升高和LMR降低是EGFR突变阳性晚期NSCLC患者不良预后的独立影响因素。本研究是一项单中心回顾性研究,在进展后接受后线治疗的患者中,干预措施复杂,存在一定的混杂因素,尚未对干预措施详细分类进行更全面的分析。未来仍需通过前瞻性、多中心研究以及更加细化的干预措施验证本研究结论。尽管如此,同时与分子基因检测相比,NLR、PLR、SII和LMR具有检测简单、成本低等优点,在临床实践过程中,结合其他临床特征可更好地评估肺癌患者的预后。
