基于微针途径的艰难梭菌类毒素A经皮免疫效应研究
2022-05-14何菁荣代文秀王月颖傅思武
何菁荣 张 祎 代文秀 王月颖 傅思武
西北民族大学医学部,甘肃兰州 730030
艰难梭菌为革兰氏阳性厌氧芽孢杆菌,通常定植于人体肠道,是抗生素相关性腹泻的主要病原菌之一。当肠道微生态被破坏,艰难梭菌乘机大量繁殖产毒,导致艰难梭菌感染,其致病毒素以A 毒素(TcdA)和B 毒素(TcdB)为主,故目前艰难梭菌感染的预防及疫苗研究以TcdA、TcdB 为主要候选抗原[1-2]。面对国内外艰难梭菌感染的新特点和国内潜在爆发流行的趋势,积极研究基于艰难梭菌毒素A 疫苗并探索其最佳疫苗免疫途径,可以从根本上预防艰难梭菌感染的发生,有效阻止耐药菌株的扩散[3-4]。目前常用的免疫方式有腹腔注射、口服免疫、黏膜免疫[5-6]等,微针作为一种新型经皮免疫方式,通过在皮肤造出大量微细管道,使抗原活性成分快速渗入,有效地克服皮肤角质层屏障作用;不仅避免了口服给药带来的胃肠道副作用及肝脏的“首过效应”,且减弱了注射免疫的痛感及针刺恐惧症的限制,具有精准、快速,安全等特点[7-9]。本研究通过比较微针免疫与腹腔注射给药两种途径的免疫效果,探讨基于微针途径的艰难梭菌类毒素A 疫苗的黏膜免疫效应。
1 对象与方法
1.1 实验动物
SPF 级BALB/c 小鼠,雌性18~22 g,6 周龄,购自中国农业科学院兰州兽医研究所实验动物中心,本研究已经西北民族大学实验动物伦理委员会审核通过。于室温22~26℃,湿度适宜,无菌环境喂养。
1.2 主要仪器与试剂
BHI 培养基(美国BBL 公司);DEAE-Toyopearl 650M(日本东洋曹达株式会社);三溴乙醇(SIGMA,T48402-25 g);酶标仪(美国BIO-RAD680);96 孔ELISA板、1 ml 无菌注射器、HRP-兔抗鼠(兰州生物制品研究所);微针(YMR30,0.3 mm,540 Needle);ABTS 底物、PBST 封闭液、甲醛、37℃培养箱(西北民族大学中心实验室)。
1.3 实验分组及处理
1.3.1 艰难梭菌类毒素A 疫苗制备 参考傅思武等[10]介绍的方法制备纯化艰难梭菌A 毒素后,加入终浓度0.4%的甲醛,放入37℃培养箱,脱毒10~14 d。细胞毒检测合格后,经透析,测定蛋白浓度,即得到艰难梭菌类毒素A 疫苗。
1.3.2 疫苗免疫 适应喂养1 周后,将24 只BALB/c 小鼠采用随机数字表法将其分为对照组与观察组,每组各12 只(每组免疫剂量均为10 μg/ml)。观察组将小鼠背部3~5 cm2面积进行脱毛,次日用三溴乙醇麻醉(400 mg/kg)消毒后,利用微针按照垂直和水平方向分别滚动5 次,滴加抗原待吸收后将小鼠放回饲养盒,观察。对照组注射抗原后将小鼠放回饲养盒,随时观察。
两组小鼠皆使用艰难梭菌类毒素A 分别于处理第0、7、14、28、42 天共分5 次进行免疫。
1.4 观察指标及检测方法
1.4.1 粪便IgA 及血清中特异性IgG 的效价检测 于处理第7、14、28、42 天前,小鼠尾部取血分离得血清;小鼠粪便样品用5 倍体积的NS 稀释。使用间接酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法测定效价,方法如下:以纯化的艰难梭菌A毒素包被ELISA 板,用含10%BSA 的PBST 封闭,小鼠血清为一抗,HRP-兔抗鼠免疫球蛋白G(immunoglobulin G,IgG)为二抗,ABTS 底物显色后测定OD450值。
1.4.2 艰难梭菌产毒株攻毒实验 末次免疫后第7 天,对已经免疫的BALB/c 小鼠使用艰难梭菌产毒株VPI10463(1×108CFU/ml)灌胃,进行人工感染,单只隔离观察并统计动物发病及死亡情况,再将艰难梭菌感染2 d 后的小鼠处死,取盲肠中段用4%多聚甲醛固定,石蜡包埋、切片、HE 常规染色,光镜下观察盲肠组织结构。
1.5 统计学方法
使用SPSS 19.0 统计学软件处理数据,计量资料先进行正态性检验和方差齐性检验,满足正态性且两组方差齐的资料采用均数±标准差(±s)表示,采用重复测量方差分析主效应、时间效应和交互效应,组间两两比较采用LSD-t检验,组内不同时间采用配对样本t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组小鼠血清特异性IgG 测定结果的比较
整体分析发现:两组小鼠血清抗体IgG 效价的组间比较,差异无统计学意义(P>0.05),但两组小鼠血清抗体IgG 效价的时间、交互作用比较,差异有统计学意义(P<0.05),提示随着免疫次数的增加,两组小鼠血清抗体IgG 效价皆逐步增高。进一步进行两两比较,组间比较:两组处理第7、14、42 天的血清抗体IgG 效价比较,差异无统计学意义(P>0.05);观察组处理第28 天的血清抗体IgG 效价低于对照组,差异有统计学意义(P<0.05)。组内比较:两组处理第14、28、42 天的血清抗体IgG 效价分别高于本组处理第7天,处理第42 天的血清抗体IgG 效价均高于本组处理第14、28 天,差异有统计学意义(P<0.05);观察组处理第28 天的血清抗体IgG 效价与本组处理第14 天比较,差异无统计学意义(P>0.05);对照组处理第28 天的血清抗体IgG 效价高于本组处理第14 天,差异有统计学意义(P<0.05)(表1)。
表1 两组小鼠血清IgG 效价的比较(±s)

表1 两组小鼠血清IgG 效价的比较(±s)
注 IgG:免疫球蛋白G
时间观察组(n=12)对照组(n=12)t 值P 值处理第7 天处理第14 天处理第28 天处理第42 天F 时间,P 时间F 组间,P 组间F 交互,P 交互0.189±0.063 0.705±0.221 0.781±0.074 0.873±0.150 0.243±0.154 0.634±0.152 0.858±0.081 0.964±0.093 0.930 0.992 3.664 1.915 0.372 0.343 0.004 0.082 166.027,<0.001 0.825,0.383 3.910,0.017 t 处理第14 天与处理第7 天比较值P 处理第14 天与处理第7 天比较值t 处理第28 天与处理第7 天比较值P 处理第28 天与处理第7 天比较值t 处理第42 天与处理第7 天比较值P 处理第42 天与处理第7 天比较值t 处理第28 天与处理第14 天比较值P 处理第28 天与处理第14 天比较值t 处理第42 天与处理第14 天比较值P 处理第42 天与处理第14 天比较值t 处理第42 天与处理第28 天比较值P 处理第42 天与处理第28 天比较值10.025<0.001 24.001<0.001 20.682<0.001 1.344 0.206 5.321<0.001 2.782 0.018 6.387<0.001 13.58<0.001 15.929<0.001 4.490 0.001 7.745<0.001 4.526 0.001
2.2 两组小鼠粪便IgA 测定结果的比较
整体分析发现:两组小鼠粪便免疫球蛋白A(immunoglobulin A,IgA)效价的时间、组间、交互作用比较,差异均有统计学意义(P<0.05),提示两组小鼠粪便中IgA 效价随着免疫次数的增加而逐步增高,观察组的免疫效果优于对照组。进一步进行两两比较,组间比较:两组处理第7 天的粪便IgA 效价比较,差异无统计学意义(P>0.05);观察组处理第14、28、42 天的粪便IgA 效价高于对照组,差异有统计学意义(P<0.05)。组内比较:两组处理第42 天的粪便IgA 效价高于本组处理第7、14、28 天,差异有统计学意义(P<0.05);观察组处理第14、28 天的粪便IgA 效价高于本组处理第7 天,差异有统计学意义(P<0.05);对照组处理第14、28 天的粪便IgA 效价与本组处理第7天比较,差异无统计学意义(P>0.05);两组处理第28 天的粪便IgA 效价与本组处理第14 天比较,差异均无统计学意义(P>0.05)(表2)。
表2 两组小鼠粪便IgA 效价的比较(±s)
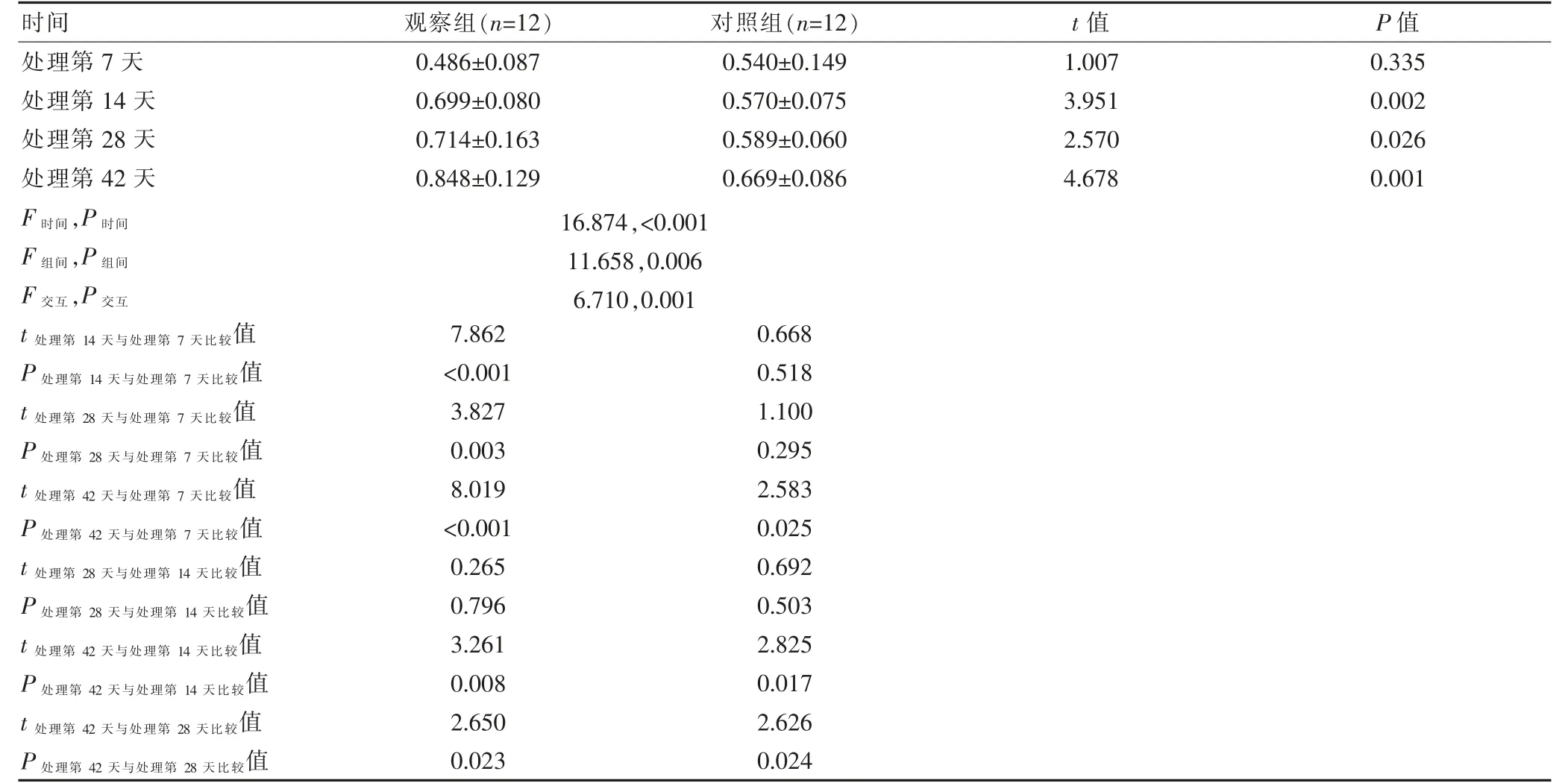
表2 两组小鼠粪便IgA 效价的比较(±s)
注 IgG:免疫球蛋白A
时间观察组(n=12)对照组(n=12)t 值P 值处理第7 天处理第14 天处理第28 天处理第42 天F 时间,P 时间F 组间,P 组间F 交互,P 交互0.486±0.087 0.699±0.080 0.714±0.163 0.848±0.129 0.540±0.149 0.570±0.075 0.589±0.060 0.669±0.086 1.007 3.951 2.570 4.678 0.335 0.002 0.026 0.001 16.874,<0.001 11.658,0.006 6.710,0.001 t 处理第14 天与处理第7 天比较值P 处理第14 天与处理第7 天比较值t 处理第28 天与处理第7 天比较值P 处理第28 天与处理第7 天比较值t 处理第42 天与处理第7 天比较值P 处理第42 天与处理第7 天比较值t 处理第28 天与处理第14 天比较值P 处理第28 天与处理第14 天比较值t 处理第42 天与处理第14 天比较值P 处理第42 天与处理第14 天比较值t 处理第42 天与处理第28 天比较值P 处理第42 天与处理第28 天比较值7.862<0.001 3.827 0.003 8.019<0.001 0.265 0.796 3.261 0.008 2.650 0.023 0.668 0.518 1.100 0.295 2.583 0.025 0.692 0.503 2.825 0.017 2.626 0.024
2.3 组织病理学特点
艰难梭菌产毒株攻毒后,两组小鼠均受到不同程度的保护,小鼠全部存活。处死小鼠后,小鼠盲肠病理切片结果显示:未经免疫的小鼠攻毒后,表现为小鼠黏膜上皮溃疡、伴有充血、水肿、大量粒细胞浸润的黏膜炎症(图1,封四);对照组与观察组小鼠的肠黏膜损伤程度轻微,上皮结构较完整,仅表现为轻度炎症(图2、3,封四)。



3 讨论
3.1 艰难梭菌感染治疗现状
目前,临床上主要采用万古霉素、甲硝唑、非达霉素等抗生素进行艰难梭菌感染治疗,但仍有15%~35%的复发率[11]。其他的防治措施有:益生菌治疗[12]、粪菌移植[13]、手术治疗等。进行临床试验的治疗药物及生物制剂有:毒素吸附剂Tolevamer、免疫球蛋白、单克隆抗体、艰难梭菌疫苗[14]等。然而,由于高致病菌株的出现和菌株耐药的增加,加上目前尚无安全合格的疫苗,艰难梭菌感染性疾病的防治仍是一个非常棘手的难题。本研究针对TcdA 制备出艰难梭菌类毒素A 疫苗免疫小鼠后,以艰难梭菌感染各疫苗组,小鼠无死亡现象,说明CDI 疫苗可有效预防艰难梭菌感染[15-16];同时研究微针免疫途径保护效果及可能存在的问题,结合小鼠免疫后血清学特异抗体IgG 效价、粪便中黏膜抗体粪便中IgA 效价、攻毒后小鼠组织学切片病理观察结果整体分析发现:对照组与观察组的血清特异抗体IgG 效价的时间、交互作用比较,差异有统计学意义(P<0.05),两组小鼠的血清特异抗体IgG效价组间比较,差异无统计学意义(P>0.05)。两组小鼠粪便中IgA 效价的时间、组间、交互作用比较,差异均有统计学意义(P<0.05);攻毒后小鼠无死亡现象,盲肠病理切片中两组小鼠仅表现为轻度的黏膜炎症。综合提示微针介导艰难梭菌类毒素疫苗进入机体后,可产生效果良好的黏膜免疫效果。
3.2 微针艰难梭菌类毒素A 疫苗的前景
针对耐药菌的控制,世界卫生组织(World Health Organization,WHO)认为只有疫苗的群体免疫才能减少这些广谱耐药菌的扩散[17]。且迄今为止,肠道细菌性疫苗的防治效果不甚理想,考虑到抗生素制剂本身的缺点,积极研制高效、安全的疫苗是控制肠道细菌感染的关键手段。目前研究中的疫苗有被动免疫疫苗、减毒疫苗、活菌疫苗、DNA 重组疫苗等,但尚无疫苗面市[18]。微针作为一种新型物理促渗技术,与传统注射免疫相比,能更为有效地将疫苗抗原投递给皮下的抗原递呈细胞网,使其产生黏膜免疫,同时黏膜免疫的产生可以有效地阻挡来自黏膜的细菌和病毒感染[19]。除此之外,微针在用药安全性及患者依从性上也具明显优势,在医药领域主要针对恶性肿瘤、糖尿病、免疫治疗、类风湿性关节炎等方面进行热点研究[20-21],然而现研发阶段中微针仅适用于短期内释放且高效的制剂,对于需长期缓慢释放的药物仍需重点探索。本实验初步测试了艰难梭菌类毒素A 疫苗微针经皮接种的黏膜免疫效果,为艰难梭菌类毒素人用疫苗的研制提供新的理论与技术参考。
综上所述,基于微针途径的艰难梭菌疫苗经皮免疫效应良好,提示微针可以用于蛋白类毒素疫苗黏膜免疫且具有较好免疫效果,今后将针对抗原通过微针介导进入黏膜后的分子免疫学机制进行更为深入的研究。
