基质栽培黄瓜根际细菌多样性及促生细菌的筛选
2022-05-14周方园高云霄赵晓燕张广志谢雪迎张新建
周方园,高云霄,赵晓燕,张广志,谢雪迎,张新建
(齐鲁工业大学(山东省科学院)生态研究所/山东省应用微生物重点实验室,山东 济南 250013)
作物根际微生物在植物的生长、营养吸收、病害防御等方面发挥着重要作用[1-4],尤其一些根际细菌类群,具有较高的固氮、解磷、解钾和产植物生长素活性[3]。近年来,在作物种植过程中大量使用化学肥料造成土壤氮磷过载和酸化、作物增产受阻,越来越多的科研工作者开始从根际微生物中挖掘、开发新的微生物资源,研发微生物肥料或者制剂来促进作物生长和产量提高[5,6]。作物根际微生物成为分离促生菌的重要来源。
促生菌主要从土壤栽培的健康作物根际分离筛选[7-10]。但随着现代农业的发展,种植技术不断更新换代,作物栽培介质也不再局限于土壤,各种人工合成的育苗栽培基质不断出现[11-13],作物的根际微生物类群也将随之发生改变。从土壤栽培作物根际分离到的促生菌在基质栽培条件下可能不能定殖发挥功能。因此,亟需从基质栽培的作物根际筛选新的促生微生物,为开发适应新栽培技术的菌肥或菌剂产品提供菌种资源。
黄瓜是我国大规模种植的重要蔬菜作物,经济效益巨大。目前受反季蔬菜价格优势的影响,日光温室黄瓜种植面积巨大[14-16],并且越来越多的农户选择使用无土基质种植[17,18],这既能够减少根部病害的发生,也有利于黄瓜根系延伸,提高肥料利用率,实现黄瓜增产。本研究从山东3地采集基质栽培的设施黄瓜根际样本,通过16S rRNA高通量测序技术测定黄瓜根际细菌的多样性,并分离鉴定根际细菌,通过固氮、解磷、产吲哚乙酸、产铁载体、产ACC脱氨酶活性筛选部分促生菌株;最后通过盆栽试验验证菌株的促生活性,以期为开发适应基质栽培黄瓜的菌剂和菌肥产品提供菌种资源,并为未来寻找新的促生菌资源提供支持。
1 材料与方法
1.1 主要试剂和仪器
1.1.1 试剂 10×磷酸盐缓冲液购自生工生物工程(上海)股份有限公司,用蒸馏水稀释10倍后灭菌备用;16SrRNA基因扩增引物和Taq聚合酶均购自生工生物工程(上海)股份有限公司;细菌DNA提取试剂盒购自Omega公司;植物基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;AxyPrepDNA凝胶回收试剂盒购自爱思进生物技术(杭州)有限公司。Salkowski显色剂:0.5 mol/L FeCl3与35%HClO4体积比按1∶50配制。分析纯吲哚乙酸购自国药集团。PVK无机磷培养基、阿须贝氏培养基、ADF培养基、改良CAS固体培养基、胰蛋白胨大豆肉汤培养基(TSB)购自北京酷来搏科技有限公司。金氏液体培养基按照Glickmann等[19]方法进行配制,加入1%琼脂制备固体培养基。栽培基质(淀粉树脂泡沫粒子25%、牛粪秸秆发酵物35%、草炭40%)购自山东商道生物科技股份有限公司。
引物序列:27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-TACGGYTACCTTGTTACGACTT-3′;799F:5′-AACMGGATTAGATACCCKG-3′,1193R:5′-ACGTCATCCCCACCTTCC-3′。
1.1.2 仪器 PCR仪购自Applied Biosystems公司。NanoDrop 2000微量紫外分光光度计购自赛默飞世尔科技(中国)有限公司。
1.2 黄瓜根际细菌的高通量测序
1.2.1 测序样本的制备 2021年1—3月在山东省寿光市(E118.715279°、N36.875423°;山东鲁寿农业集团有限公司生产的品种强生719)、兰陵县(E116.413384°、N39.910925°;山东鲁寿农业集团有限公司生产的品种绿蒂802)、济南市(E117.101818°、N36.584433°;寿光市旭冉农业科技有限公司生产的品种博盛99)的日光温室中部每棚采集2株共计6株健康黄瓜,2个样本相互间隔10 m以上。测序样本的制备参照Zhang等[20]的方法:采集后剪掉植株地上部分,抖落附着于根部的土壤,剪取部分主根、侧根以及不定根约10 g至灭菌50 mL离心管,每采集完一株,剪刀均用75%乙醇消毒并用灭菌水冲洗3次后再使用。采集完毕后,将装有样本的离心管置于冰盒内转运至实验室。随后,每个样品管内加入灭菌1×PBS缓冲液35 mL,置于摇床中180 r/min清洗20 min后,使用无菌滤纸吸干根表面水分,如此反复清洗3次,取0.2 g使用液氮充分研磨,用植物组织DNA提取试剂盒提取微生物总DNA,使用NanoDrop 2000微量紫外分光光度计对提取的DNA进行质量检验。
1.2.2 黄瓜根际细菌多样性高通量测序 使用特异引物799F和1193R扩增根际细菌16SrRNA的V5-V7区,PCR产物5′端添加barcode序列(上海美吉生物医药科技有限公司提供)。PCR反应体系(50μL):DNA模板5μL(10 ng),引物各1.5μL,2 mmol/L dNTPs 5μL,MgSO42μL,10×KOD Buffer 5μL,KOD Plus 1μL,ddH2O补足至50μL。PCR扩增程序:94℃2 min;94℃30 s,63℃30 s,68℃30 s,30个循环;68℃5 min。每个样品3次重复,将3次PCR产物混合用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒切胶回收PCR产物,送上海美吉生物医药科技有限公司进行建库测序,测序平台为Illumina Miseq PE250。
1.2.3 黄瓜根际细菌高通量测序数据分析 测序数据使用上海美吉生物医药科技有限公司的“生信云”平台(www.majorbio.com)进行分析。在云平台中,使用QIIME v.1.9.1(Quantitative Insights Into Microbial Ecology)软件包对测序数据进行质控检测和数据分析[21]。数据处理前,剔除测序数据中长度低于200 bp、含有模糊碱基以及引物的错配数在2个碱基以上的序列。筛选后的序列用USEARCH软件包中的UPARS按照97%相似性阈值对序列进行OTU聚类[22],选取丰度最高的序列作为该OTU的代表性序列并使用RDP classifier v.2.2进行分类学分析,使用SILVA数据库(http://www.arb-silva.de)将置信阈值设为70%进行分类学注释[23,24],统计不同分类水平下各个样本的OTU组成和reads数。由于测序平台和注释数据库的限制,本试验中部分序列不能注释到种,因此根据各序列信息使用FastTree 2.1.3在属水平构建物种组成的最大似然树,并统计在属水平上的reads数作为物种丰度。
1.3 黄瓜根际细菌的分离鉴定
准确称取1.2.1中清洗后的6份根系样本各0.2 g加入灭菌1×PBS缓冲液1 mL充分研磨,然后用1×PBS缓冲液10倍梯度稀释至10-8,每个浓度用移液枪移取50μL滴加到TSA平板上,立即用无菌三角形玻璃涂布棒涂布均匀,待菌液充分吸收后封口膜封口,倒置于28℃培养36 h后,选择颜色、大小、厚度、透明度和质地不同的菌落,在TSA培养基上用接种环采用三区划线法进行纯化和培养,得到菌株后反复划线3次得到纯菌株。根据菌落形态对菌株进行分组。
选取代表性菌株分别接种至装有2 mL TSB液体培养基的试管中,28℃、180 r/min培养12 h。之后转移1 mL菌液到2 mL离心管,13000 r/min离心2 min后收集菌体,使用细菌基因组提取试剂盒提取DNA,随后用27F和1492R对细菌16S rRNA基因进行扩增。PCR反应体系(25μL):DNA 1μL(20 ng),引物各0.5μL,2×TaqPCR Buffer 12.5μL,ddH2O 10.5μL。PCR扩增程序:95℃5 min;94℃30 s,52℃30 s,72℃90 s,35个循环;72℃10 min。PCR产物使用1.2%琼脂糖凝胶电泳进行检测,片段大小为1500 bp左右的样品送生工生物工程(上海)股份有限公司测序,平台为Roche 454。所得序列上传至GenBank,并与GenBank中亲缘关系较近的菌株进行序列比较,选取Anabaena affinis(AF247591)为外群,使用Mega X最大似然法构建系统发育树(bootstrap值设置为1000)进行细菌的鉴定。
1.4 黄瓜根际细菌中促生细菌的筛选
1.4.1 菌株固氮能力的测定 将分离到的菌株(每个种选一株,下同)用TSB过夜培养,5000 r/min离心5 min后收集菌体,用1×PBS缓冲液反复清洗3遍后制成菌悬液(约108cfu/mL),接种50μL菌悬液至阿须贝氏培养基(培养皿直径30 mm,下同)上,28℃黑暗条件下培养7 d,观察菌落的生长状况,根据菌落直径大小、菌苔厚度判断固氮能力。每个菌株3次重复。
1.4.2 菌株解无机磷能力测定 参照1.4.1制备菌悬液,接种50μL菌悬液至PVK无机磷培养基上,28℃黑暗条件下培养7 d,观察菌落的生长状况,根据菌落周围透明圈的大小判断解磷能力。每个菌株3次重复。
1.4.3 菌株分泌吲哚乙酸能力测定 参照1.4.1制备菌悬液,接种50μL菌悬液至金氏固体培养基中,37℃黑暗培养48 h后,清除平板表面的菌落后,取4 mL Salkowski显色剂滴加到平板上,25℃避光反应60 min,观察菌落周围是否有粉红色晕圈,晕圈越大、颜色越红表示产吲哚乙酸能力越强。每个菌株3次重复。
1.4.4 菌株产ACC脱氨酶活性测定 参照1.4.1制备菌悬液,接种50μL菌悬液至ADF培养基上,28℃黑暗条件下培养7 d,观察菌落的生长状况,能够在ADF培养基上生长的菌株即能够产ACC脱氨酶。菌株生长越快,产ACC脱氨酶活性越强。每个菌株3次重复。
1.4.5 菌株产铁载体能力的测定 参照1.4.1制备菌悬液,接种50μL菌悬液至CAS培养基平板上,28℃黑暗条件下培养7 d,菌落周围能够产生桔黄色晕圈的菌株即能够产铁载体。晕圈越大,产铁载体能力越强。每个菌株3次重复。
1.5 黄瓜根际促生细菌的盆栽验证
根据1.4试验结果,选取具有固氮、解磷、产吲哚乙酸、产铁载体或者产ACC脱氨酶活性的菌株于2021年5月中旬在山东省科学院生态研究所人工温室(温度25℃、光周期L∶D=16∶8、光照强度20000 lx)内开展盆栽试验,验证菌株对黄瓜幼苗的促生效果。用TSB培养基28℃、180 r/min培养24 h后收集菌体,用无菌水制备各菌株的菌悬液(108cfu/mL)。将灭菌(121℃高压蒸汽灭菌15 min,反复2次)后的栽培基质用灭菌水充分浸湿后填装于一次性纸杯内备用。黄瓜种子用稀释100倍的40%福尔马林溶液消毒30 min,无菌水反复冲洗3次,于浸湿的灭菌纱布28℃黑暗条件下催芽24 h,选取出芽整齐的种子每个纸杯点播1粒。前期平板活菌计数预试验表明,在日光温室条件下基质中萌芽的黄瓜种子表面约有107~109个细菌,因此,本试验中接种菌悬液1 mL(约108cfu)于纸杯内种子上,表面覆盖基质后于25℃、光周期L∶D=16∶8培养,出苗后每隔一天浇水10 mL,出苗7 d后测量株高、茎粗、地上和地下部分鲜重。株高:用直尺测量根到生长点的长度(cm);茎粗:用游标卡尺测量平行于子叶方向子叶下2 cm处(mm);地上、地下部鲜重采用万分之一电子天平称重(g);地上、地下部干重:将幼苗鲜样于烘箱105℃杀青15 min后,80℃烘干至恒重,然后用万分之一电子天平称重(g);壮苗指数=(茎粗/株高+地下干重/地上干重)×单株干重。以接种灭菌水为对照,每个菌株6次重复。
1.6 数据处理
使用Microsoft Excel 2019对数据进行整理,使用SPSS 24.0中单因素方差分析(Duncan’s检验)对数据进行统计分析,采用Sigmaplot 14.0和R 3.3.1作图。
2 结果与分析
2.1 基质栽培的黄瓜根际细菌多样性组成
高通量测序总共得到102159条reads,大部分长度为361~389 bp,平均长度375 bp。经注释后总共鉴定到64个OTU,分属于5门6纲16目23科50属。由图1可知,所有样品稀释曲线均趋于平缓,且样品α多样性指数中Coverage指数均大于98.5%,说明本试验测序数据充分,能够保证后续分析可靠性。
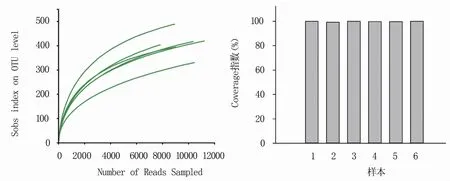
图1 6个黄瓜根际样本的测序稀释曲线和Coverage指数
如图2,在属水平上,丰度较高的属包括假苯基杆菌属(Phenylobacterium)、假单胞菌属(Pseud-omonas)、丛毛单胞菌科某属(u_Comamonadaceae)、食酸菌属(Acidovorax)、黄杆菌属(Flavobacterium)、黄单胞菌科某属(u_Xanthomonadaceae)、砂单胞菌属(Arenimonas)、新草螺菌属(Noviherbaspirillum)、嗜甲基菌属(Methylophilus)、类芽孢杆菌属(Paenibacillus)、芽孢杆菌属(Bacillus)、鞘氨醇单胞菌属(Sphingomonas)、根瘤杆菌属(Rhizobacter)、纤维弧菌属(Cellvibrio)、快生根瘤菌属(Rhizobium)、肠杆菌属(Enterobacter)、德沃斯氏菌属(Devosia)、嗜糖假单胞菌属(Pelomonas)、草酸杆菌科某属(u_Oxalobacteraceae)、甲基营养菌属(Methyloversatilis)、马赛菌属(Massilia)、玫瑰弯菌科某属(u_Roseiflexaceae),在整个根际细菌群落中所占比例分别为9.92%、8.62%、8.26%、6.07%、4.85%、4.56%、3.54%、3.51%、3.47%、2.83%、2.61%、2.58%、2.37%、2.11%、2.00%、1.74%、1.52%、1.35%、1.27%、1.11%、1.02%、1.01%。
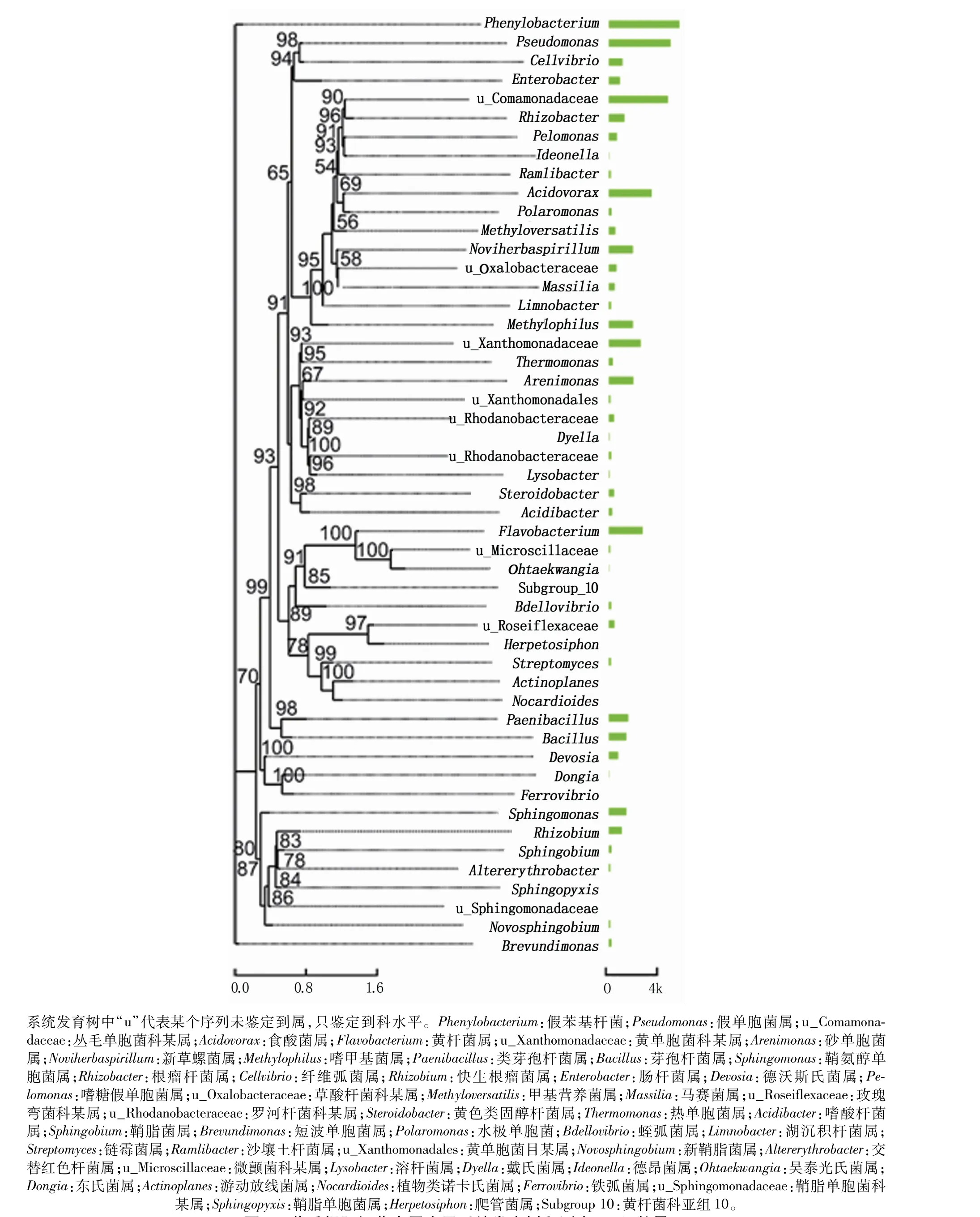
图2 黄瓜根际细菌中属水平系统发育树和测序reads数量
2.2 黄瓜根际细菌的分离鉴定结果
从黄瓜根际共分离到48株细菌,经16S rRNA鉴定属于26个种,分属于变形菌门(Proteobacteria,图3)、厚壁菌门(Firmicutes,图4a)、拟杆菌门(Bacteroidetes,图4b)和放线菌门(Actinobacteria,图4c)的13个属。26个种的细菌分别为枯草芽孢杆菌(B.subtilis)、根癌农杆菌(Agrobacterium tumefaciens)、产脲节杆菌(Paenarthrobacter ureafaciens)、嗜麦芽窄食单胞菌(Stenotrophomonas maltophilia)、台 湾金 黄杆 菌(Chryseobacterium taiwanense)、产吲哚金黄杆菌(C.indologenes)、链霉菌(Streptomycessp.)、农业生技所副芽孢杆菌(B.niabensis)、白色假芽孢杆菌(Falsibacillussp.)、环状芽孢杆菌(B.circulans)、嗜温鞘氨醇杆菌(Sphingobacterium thalpophilum)、海水芽孢杆菌(B.aquimaris)、黄杆菌的两个种(Flavobacteriumsp.D9,Flavobacteriumsp.A3、A9)、类产碱假单胞菌(P.pseudoalcaligenes)、德氏食酸菌(Acidovorax delafieldii)、产碱假单胞菌(P.alcaligenes)、曼多辛假单胞菌(P.mendocina)、金黄杆菌(Chryseobacterium sp.)、植物内芽孢杆菌(B.endophyticus)、蜡样芽孢杆菌(B.cereus)、水原假黄单胞菌(Pseudoxanthomonas suwonensis)、巨大芽孢杆菌(B.megaterium)、干酪棒杆菌(Corynebacterium casei)、常州鞘氨醇杆菌(S.changzhouense)、贝莱斯芽孢杆菌(B.velezensis)。

图3 分离自黄瓜根际样本细菌基于16SrRNA基因的系统发育分析

图4 厚壁菌门(a)、拟杆菌门(b)和放线菌门(c)的系统发育树
2.3 黄瓜根际促生细菌的筛选结果
如图5,在固氮菌筛选培养基上菌株D5几乎不生长,而菌株B3、D3、F5、B4能够正常生长,说明该4株细菌具有固氮活性,其中以菌株D3和F5的固氮活性较高(表1)。
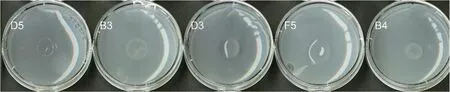
图5 黄瓜根际细菌中具有固氮活性的菌株
如图6,在PVK无机磷培养基上,菌株F4菌落周围无明显透明圈,而菌株A2、B3、C9菌落周围均产生明显透明圈,其中菌株A2和C9的解磷活性较高(表1)。
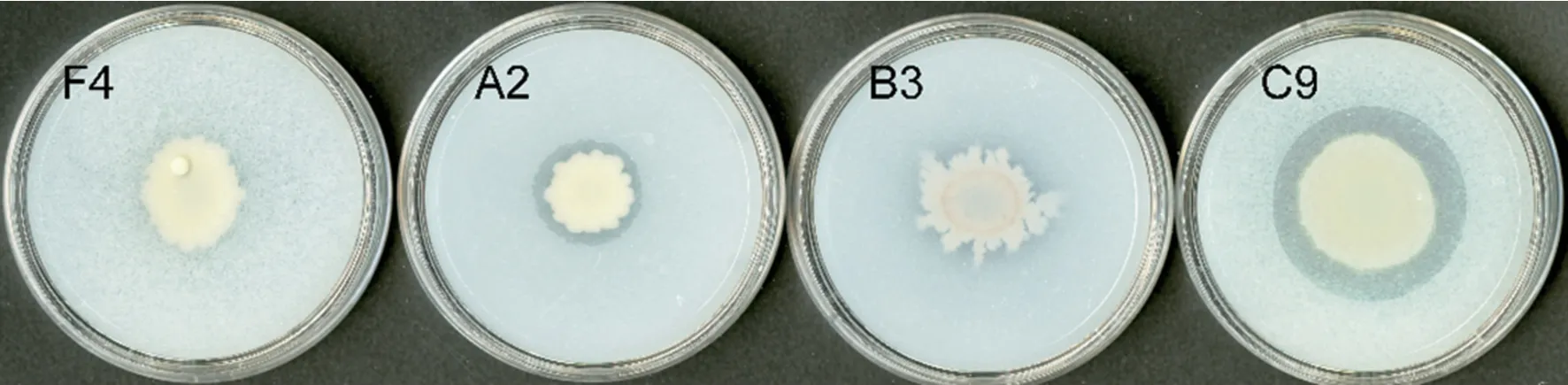
图6 黄瓜根际细菌中具有解无机磷活性的菌株
如图7,菌株B1在金氏培养基上生长后使用显色液无红色出现,说明菌株B1不产吲哚乙酸,而菌株B3、B5、E6平板在染色后出现粉红色晕圈,说明上述3菌株能够产生吲哚乙酸(表1)。
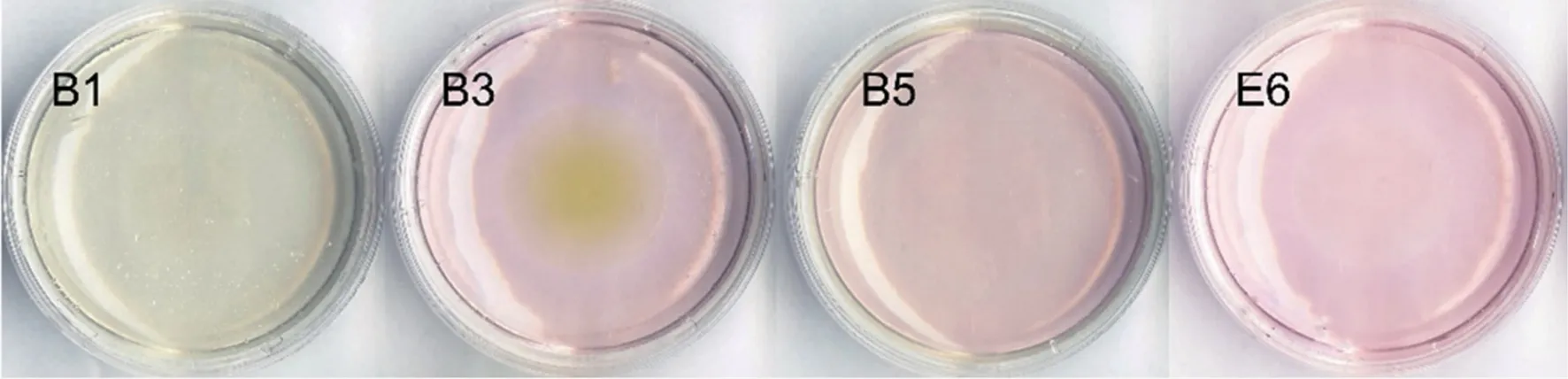
图7 黄瓜根际细菌中具有产吲哚乙酸活性的菌株
如图8,菌株B4在ADF培养基上几乎不能生长,而菌株E6、F4、A1、C4、E1、B1、B5、F5、D3能快速生长,说明上述菌株具有产ACC脱氨酶活性,其中以B5、F5、D3活性最高(表1)。
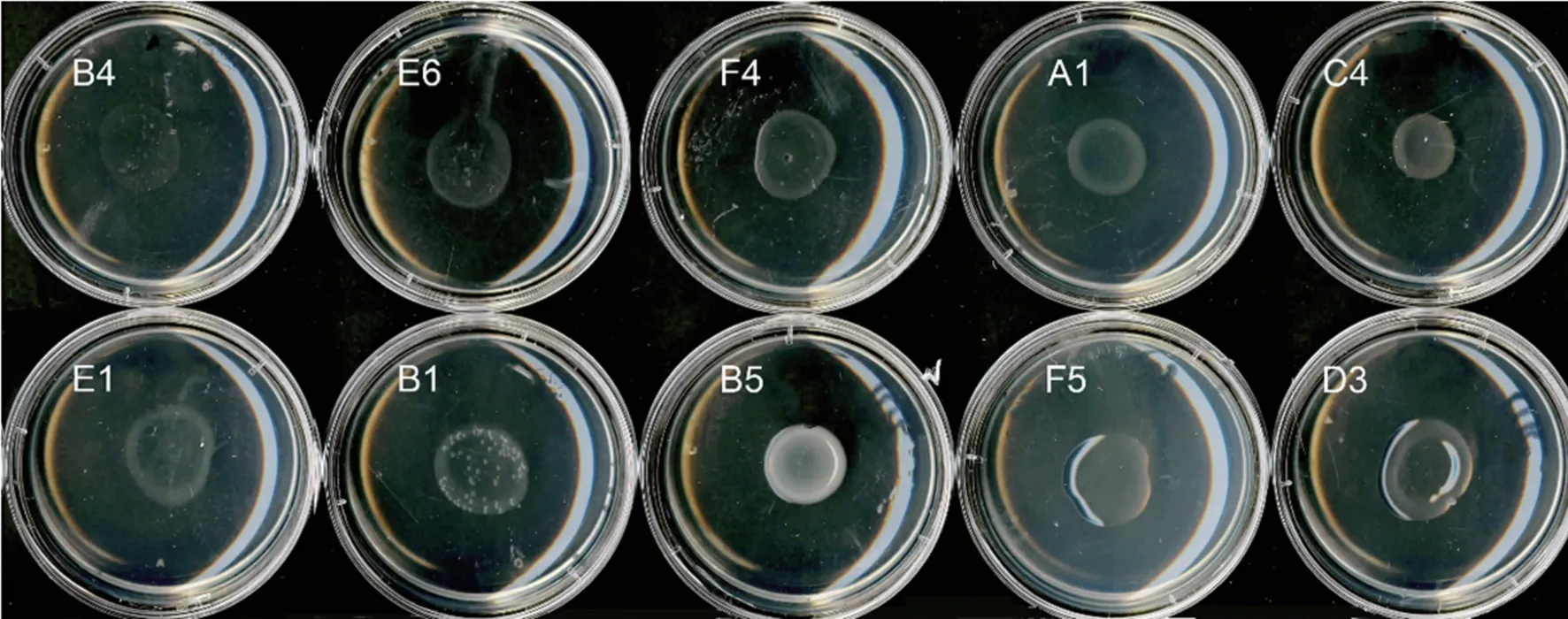
图8 黄瓜根际细菌中具有产ACC脱氨酶活性的菌株
如图9,菌株B10和F5在CAS培养基上未产生黄色晕圈,菌株F7、A1、E6、B4、C9、D3、A5、D10菌落周围均产生明显黄色晕圈,说明上述菌株具有产铁载体活性,其中以F7、A1、E6、B4、D10产铁载体活性较强(表1)。
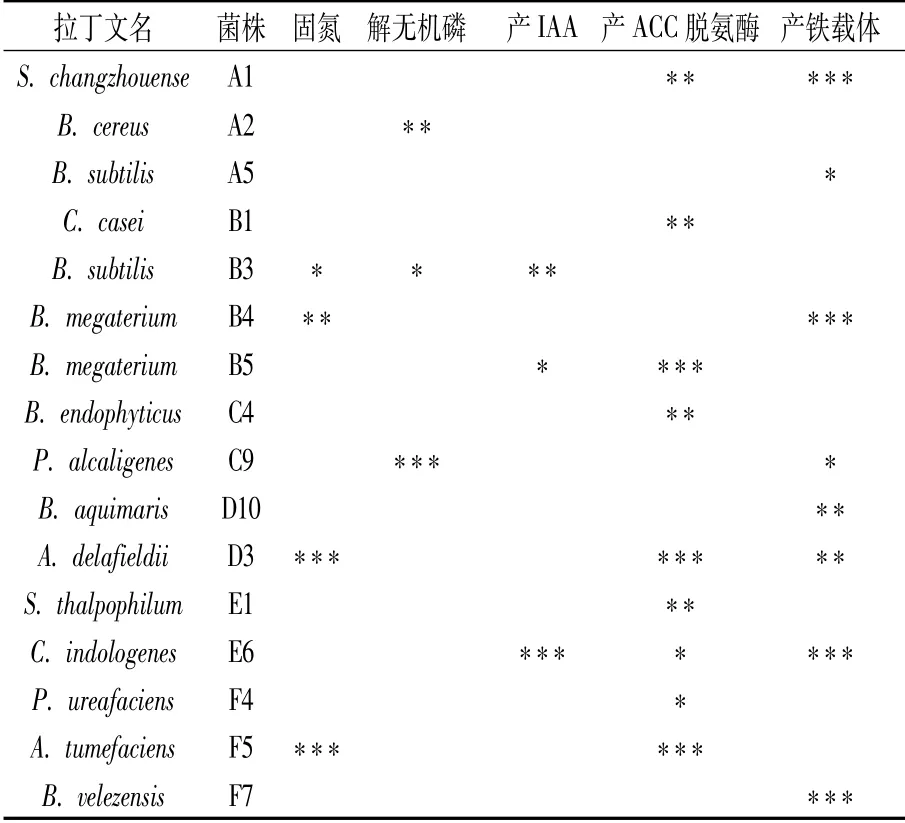
表1 黄瓜根际细菌中的促生菌株
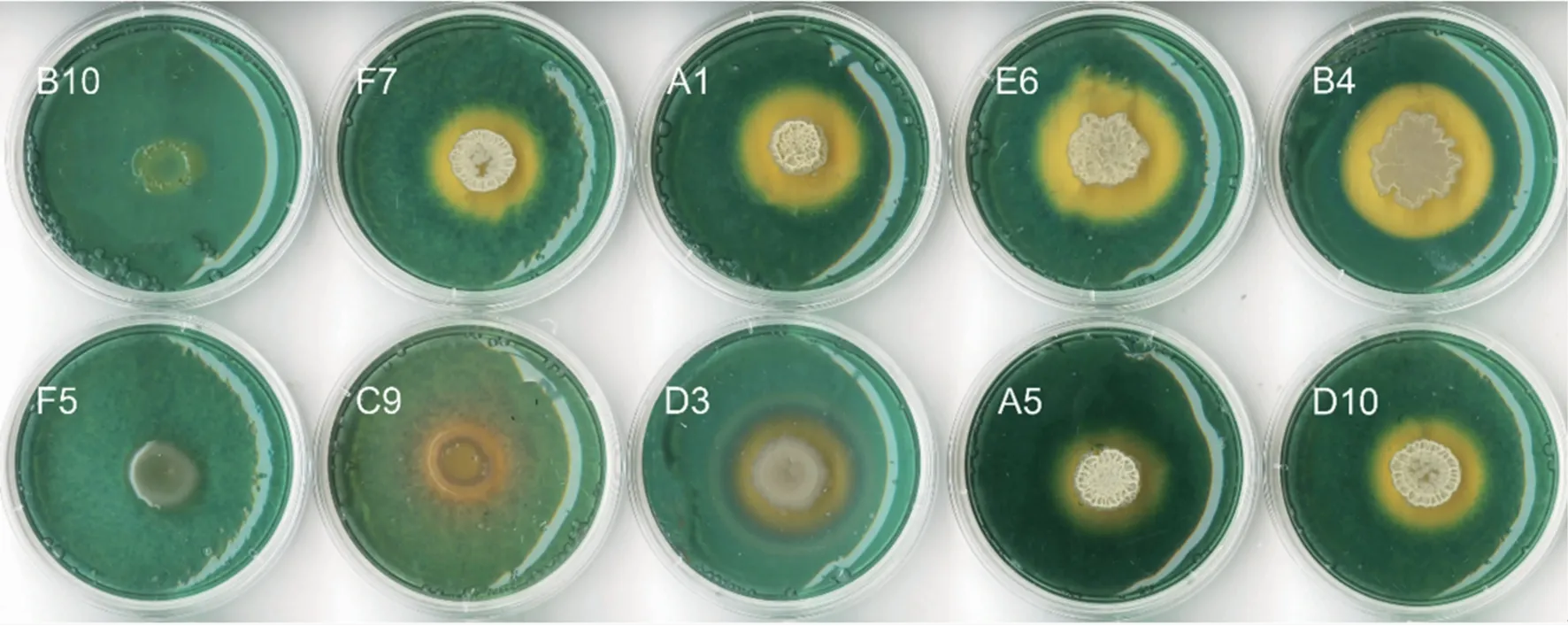
图9 黄瓜根际细菌中具有产铁载体活性的菌株
2.4 根际促生细菌对黄瓜的促生效果
盆栽促生试验结果表明,不同菌株对黄瓜幼苗的根干重产生显著影响(表2,one-way ANOVA,F16,85=1.787,P=0.046)。与对照相比,菌株D10、C4、C9显著提高黄瓜幼苗根部干重约87.2%、74.4%、65.2%,而菌株E6、B4、D3、F4、A2、B3、F7、A1、B1、E1、F5、B5虽能够提高黄瓜幼苗根干重,但与对照差异不显著;菌株A5对根干重具有轻微的抑制作用。
不同菌株对黄瓜幼苗的茎干重产生显著影响(表2,one-way ANOVA,F16,85=1.942,P=0.027),其中菌株C9、F4、D10、A2、B3、F7、E6、D3、E1、A1、B1、C4处理后分别显著提高黄瓜幼苗茎干重约77.0%、67.9%、66.5%、64.6%、63.5%、56.2%、55.1%、53.4%、53.1%、52.9%、48.2%、45.3%;菌株B5、B4、F5、A5虽提高了黄瓜幼苗的茎干重,但与对照无显著差异。
不同菌株对黄瓜幼苗的根茎比产生显著影响(表2,one-way ANOVA,F16,85=3.863,P<0.001),其中菌株C4处理后显著提高了黄瓜幼苗根茎比约17.0%,菌株B4、D10虽提高了黄瓜幼苗的根茎比,但与对照无显著差异;菌株A1、C9、F7、B1、A2、B3、F4、F5、B5、E1、A5均降低了黄瓜幼苗的根茎比,其中菌株A5差异显著。
黄瓜幼苗植株干重受菌株影响显著(表2,oneway ANOVA,F16,85=1.830,P=0.040)。菌株C9、D10、F4、A2、B3、E6、F7、D3、A1、C4、E1、B1处理后黄瓜幼苗植株干重显著增加75.0%、70.1%、65.2%、62.1%、60.9%、55.8%、54.2%、53.6%、51.0%、50.4%、49.2%、46.3%;而菌株B4、B5、F5、A5虽提高了黄瓜植株干重,但与对照差异不显著。
黄瓜幼苗壮苗指数受菌株影响显著(表2,Welch’s ANOVA,F16,31.49=1.761,P<0.001)。菌株D10、C4、C9、E6、B4分别显著提高黄瓜幼苗壮苗指 数109.7%、95.2%、89.5%、79.0%、75.8%,而菌株F4、D3、A2、B3、B5、F7、A1、B1、E1、F5虽提高了黄瓜幼苗的壮苗指数,但与对照差异不显著。

表2 不同菌株对黄瓜幼苗根干重、茎干重、根茎比、植株干重、壮苗指数的影响
3 讨论
本研究检测了基质栽培的黄瓜根际细菌组成,丰度较高的属包括Phenylobacterium、Pseudomonas、Acidovorax、Flavobacterium、Arenimonas、Noviherbaspirillum、Methylophilus、Paenibacillus、Bacillus、Sphingomonas、Rhizobacter、Cellvibrio、Rhizobium、Enterobacter、Devosia等以及一些不能鉴定到属的细菌(图2)。上述种类的细菌类群在以往研究中也有报道。例如,Pseudomonas属在一些温室黄瓜的根际中检测到[25,26],另外,本研究发现的Devosia、Dyella、Flavobacterium、Methyloversatilis、Sphingomonas、Rhizobacter、Acidovorax、Bradyrhizobium、Noviherbaspirillum、Shinella、Pseudomonas等属细菌在使用基质栽培的黄瓜幼苗根际也有发现[11]。一般来说,植物的根系会分泌特定的分泌物,这些分泌物是根际微生物群落组装的重要驱动因素。受到这一因素的影响,某些特殊种类的微生物会在植物根际富集,形成根际微生物的核心菌群;但由于栽培介质理化性质、土著菌群的差异及不同栽培模式、环境下的植物根际微生物组存在一定差异[27]。本研究中丰度较高的细菌类群和已经报道的黄瓜根际细菌种类很有可能属于黄瓜根际细菌的核心菌群,这些菌群在黄瓜生长过程中发挥着重要功能,其中可能存在一些根际促生菌。
本研究使用TSB培养基分离到了黄瓜根际细菌群落中的大部分优势属,如Pseudomonas、Acidovorax、Flavobacterium、Bacillus、Sphingomonas等;也有部分优势属未分离到,如Phenylobacterium、Arenimonas等。分离作物根际细菌常用的培养基一般包括TSB[20]、NB[28]、LB[6]等,在高通量分离技术中,也有学者使用稀释后的TSB分离作物根际细菌[20],其主要目的是分离出生长速度较慢的细菌种类。本研究目的在于从黄瓜根际分离出易培养、生长速度快的细菌种类以便于后期开发应用,因此选取了比较常用的TSB培养基,这也导致未分离到一些生长速度比较慢、对营养成分要求较高的细菌种类。
本研究选用固氮、解无机磷、产IAA、产ACC脱氨酶、产铁载体5个指标从黄瓜易培养的根际细菌中定性筛选根际促生菌。通过固氮培养基,从黄瓜根际细菌中筛选出固氮菌B.subtilis、B.megaterium、A.delafieldii、A.tumefaciens(表1)。芽孢杆菌属中多种细菌具有固氮功能,如B.subtilis固氮功能在多种作物如番茄[29]等已有报道,固氮菌B.megaterium在杉木土壤中的丰度也很高[30]。也有研究报道了A.tumefaciens的固氮活性[31]。本研究首次发现A.delafieldii具有固氮活性,之前相关研究只推测这一细菌可能具有固氮活性[32]。本研究共筛选到3株具有解无机磷活性的菌株(表1),其中包括两株芽孢杆菌B.cereus和B.subtilis,与以往研究一致[33];已有研究报道Pseudomonas属细菌具有解磷活性[34],本研究发现菌株P.alcaligenes具有解磷活性。IAA是重要的植物激素,能够促进作物生长。本研究从黄瓜根际细菌中共分离到3株具有产IAA活性的菌,分别为B.subtilis、B.megaterium、C.indologenes(表1)。已有研究表明,芽孢杆菌属中的多个种能够产生IAA[35]。ACC脱氨酶对多种作物具有显著的促生作用,这种酶尚未在植物中发现,其主要来源于一些土壤微生物[36]。本研究发现了9种能够产ACC脱氨酶活性的菌株,其中S.changzhouense、B.megaterium、B.endophyticus、A.delafieldii、S.thalpophilum、C.indologenes、P.ureafaciens、A.tumefaciens产ACC脱氨酶活性已有广泛报道[37-44],而细菌C.casei是首次被发现具有产ACC脱氨酶活性。本研究共筛选到8种具有产铁载体活性的细菌,其中芽孢菌属的B.subtilis、B.megaterium、B.aquimaris、B.velezensis产铁载体活性较高,以往也有广泛报道[45]。此外,与以往报道一致,细菌A.delafieldii[38]、C.indologenes[46]、P.alcaligenes[47]均能够产生铁载体。本研究中首次发现S.changzhouense具有产铁载体活性,以往只在其同属的一些菌株中有过报道[48]。本研究筛选到的促生细菌如Pseudomonas、Acidovorax、Bacillus和Sphingomonas在黄瓜根际微生物群落中的相对丰度均较高(图2),与前人研究结果一致[3]。
目前在根际促生菌的开发应用过程中,往往存在田间实际使用效果不稳定的情况。因此本研究在室内开展了盆栽试验,筛选到部分效果较好的菌株。如菌株D10(B.aquimaris)、C9(P.alcaligenes)、C4(B.endophyticus)对黄瓜幼苗的地上植株、地下根系的生长均具有显著的促进作用(表2)。Bacillus和Pseudomonas属细菌是比较常见的根际促生菌,尤其是关于Bacillus属的促生效果报道较多[49],关于P.alcaligene的促生效果也有报道[50],但这些研究往往更加关注菌株本身的促生效果,而没有关注菌株对不同栽培介质的适应性。本研究表明,Bacillus和Pseudomonas属细菌在基质栽培的黄瓜根际微生物群落中的相对丰度均较高(图2),这也暗示这类细菌如果外源添加到基质后可能会在基质栽培的黄瓜根际定殖产生促生效果,具体定殖情况还需要进一步研究。
4 结论
总体来说,菌株D10(B.aquimaris)、C9(P.alcaligenes)、C4(B.endophyticus)对黄瓜幼苗生长均具有显著的促进作用,并且能够显著提高壮苗指数,可以考虑将其作为候选菌株在基质栽培黄瓜中使用。
