冻干甲型肝炎减毒活疫苗规格变更后(复溶后0.5 mL/瓶)的稳定性
2022-05-13王艺博李勇侯丽娟岳立广李莉王拥军王春雨徐艳玲
王艺博,李勇,侯丽娟,岳立广,李莉,王拥军,王春雨,徐艳玲
长春生物制品研究所有限责任公司,吉林长春 130012
甲型病毒性肝炎(hepatitis A)简称甲肝,是由甲型肝炎病毒(hepatitis A virus,HAV)引起的以肝脏损伤为主的急性肠道传染性疾病[1-2],临床上主要表现为畏寒、发热、恶心、疲乏,食欲减退,肝肿大,肝功能异常,黑尿和黄疸等症状[3]。甲肝一般不会引起慢性感染[4-5],其主要传播途径为“粪-口”途径,也有报道称其可通过血源传播,但这种情况十分罕见[6]。
甲肝在病毒性肝炎中的发病率及感染率很高。在防控甲肝的过程中,WHO推荐最有效的方法就是接种甲肝疫苗[7-8]。2008年,甲肝疫苗被列入国家计划免疫,接种对象进一步扩大至婴幼儿,表明甲肝疫苗在我国甲肝疫情防控上起重要作用,同时也对甲肝疫苗的产量和质量提出了更高的要求,且甲肝疫苗的市场需求也进一步提升。
冻干甲型肝炎减毒活疫苗是我国具有自主知识产权的疫苗,其具有模拟病毒自然感染人体的优点[9],可同时诱导人体产生细胞免疫和体液免疫,且经多年大规模应用,其安全性及有效性均能达到要求。
生物制品的稳定性研究是药品研发的重要内容,可作为产品有效期设定的依据,也可作为产品质量标准制订的基础。本研究旨在探讨冻干甲型肝炎减毒活疫苗规格变更后(由复溶后1.0 mL/瓶变更为复溶后0.5 mL/瓶)成品的稳定性,并与市售冻干甲型肝炎减毒活疫苗(复溶后1.0 mL/瓶)的稳定性进行比对分析。
1 材料与方法
1.1疫苗 规格变更后的冻干甲型肝炎减毒活疫苗试验疫苗(批号:S20140301、S20140302、S20140303,规格为复溶后每瓶0.5 mL,以下简称试验疫苗)和市售冻干甲型肝炎减毒活疫苗(批号:20140201、20-140202,规格为复溶后每瓶1.0 mL,以下简称市售疫苗)均由长春生物制品研究所有限责任公司疫苗二室制备。
1.2主要试剂及仪器 甲型肝炎病毒抗原检测试剂盒(批号:20130820)购自北京北方生物技术研究所有限公司;澄明度检测仪(型号:YB-2)购自天津大学精密仪器厂;水分仪(型号:V30)和酸度计(型号:Seven multi)购自梅特勒-托利多公司;酶标仪(型号:iMarK)购自日本BIO-RAD公司;渗透压摩尔测定仪(型号:030)购自德国Gonotec公司。
1.3长期稳定性试验 将3批试验疫苗成品分别于(5±3)℃放置,每隔3个月抽样检测,持续做至样品检测结果不合格为止,其中0、6、12、18及24个月依照《中国药典》三部(2010版)[10]进行成品的全面检定,包括鉴别试验、热稳定性试验、无菌检查及病毒滴度、外观和可见异物、水分、三氯甲烷残留量、牛血清白蛋白残留量、抗生素残留量、细菌内毒素、pH值、渗透压摩尔浓度检测;其余时间点进行外观和可见异物、水分、病毒滴度及pH值的关键质量指标检定。
1.4加速稳定性试验 将3批试验疫苗成品于(25±2)℃放置6个月,分别于0、1、2、3及6个月取样检测,其中0、2及6个月进行成品的全面检定,其余时间点进行外观和可见异物、水分、病毒滴定及pH值的关键质量指标检定。
1.5试验疫苗与市售疫苗的稳定性对比 将3批试验疫苗与2批市售疫苗的稳定性研究试验数据进行对比分析,稳定性数据包括(5±3)℃放置0、9、18个月的产品质量检测结果,其中0、18个月为全面检测,9个月为关键指控指标的检测。
1.6统计学分析 应用SPSS 19.0软件对试验数据进行单因素方差分析,比较(5±3)和(25±2)℃放置不同时间点的试验疫苗关键质量指标的差异,以P<0.05为差异有统计学意义。
2 结果
2.1长期稳定性
2.1.1外观 3批试验疫苗于(5±3)℃放置30个月,外观均为白色疏松体,复溶后无异物,与试验前相比无差异。
2.1.2水分含量 3批试验疫苗于(5±3)℃放置27个月,水分含量均为2.4%;放置30个月,水分含量略有升高,但均低于3.0%的限度值。水分检测结果均合格,各时间点3批疫苗的水分含量差异无统计学意义(F=0.091,P=0.913)。见表1。
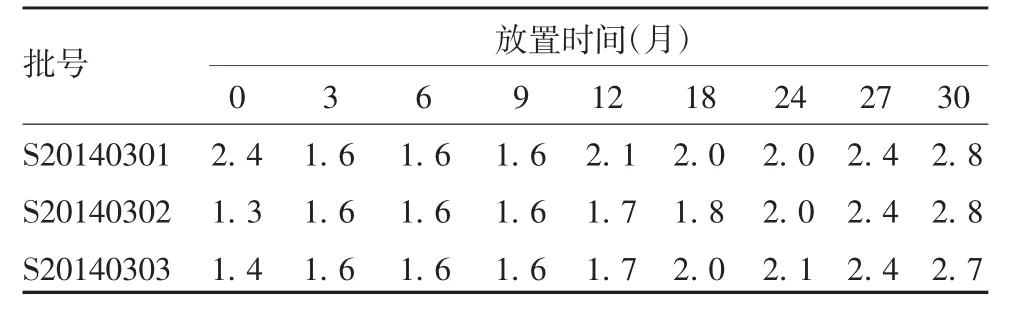
表1 3批试验疫苗于(5±3)℃放置不同时间的水分含量(%)Tab.1 Moisture contents(%)of three batches of experimental vaccine stored at(5±3)℃for various months
2.1.3病毒滴度 3批试验疫苗于(5±3)℃放置27个月,其中1批病毒滴度低于6.50 lgCCID50/剂;放置30个月,3批试验疫苗的病毒滴度均低于6.50 lgCCID50/剂。各时间点3批试验疫苗的病毒滴度差异无统计学意义(F=0.051,P=0.950),见表2。
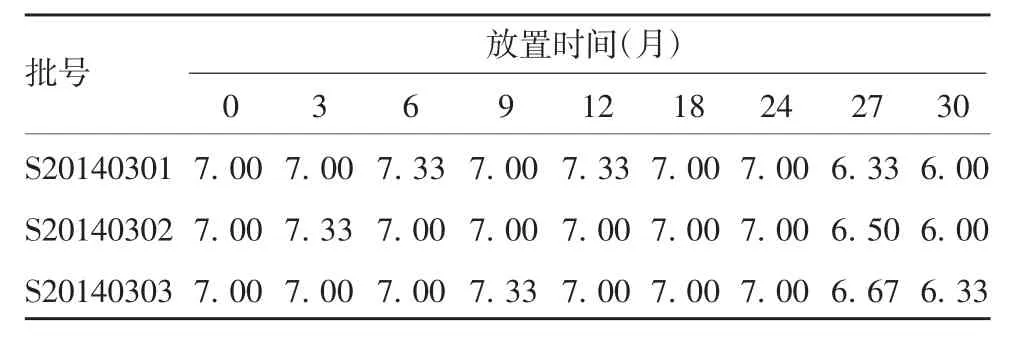
表2 3批试验疫苗于(5±3)℃放置不同时间的病毒滴度(lgCCID50/剂)Tab.2 Virus titers(lgCCID50/dose)of three batches of experimental vaccine stored at(5±3)℃for various months
2.1.4pH值 3批试验疫苗于(5±3)℃放置30个月,各取样时间点样品的pH值在6.9~7.0之间,均达到合格标准。各时间点3批试验疫苗的pH值差异无统计学意义(F=0.001,P=1.000)。见表3。
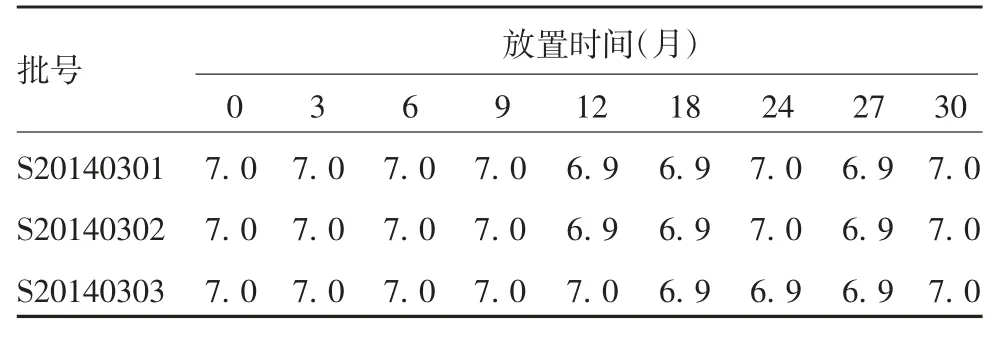
表3 3批试验疫苗于(5±3)℃放置不同时间的pH值Tab.3 The pH values of three batches of experimental vaccine stored at(5±3)℃for different various months
2.1.5全面检测 3批试验疫苗于(5±3)℃放置0、6、12、18、24个月的全面检测结果均合格。
2.2加速稳定性
2.2.1外观 3批试验疫苗于(25±2)℃放置6个月,外观均为白色疏松体,复溶后无异物,与试验前相比无差异。
2.2.2水分含量 3批试验疫苗于(25±2)℃放置6个月,水分含量随放置时间的延长而逐渐升高,放置6个月后,水分含量接近3.0%的限度值,但仍处于合格水平。各时间点3批试验疫苗的水分含量差异无统计学意义(F=0.007,P=0.993)。见表4。
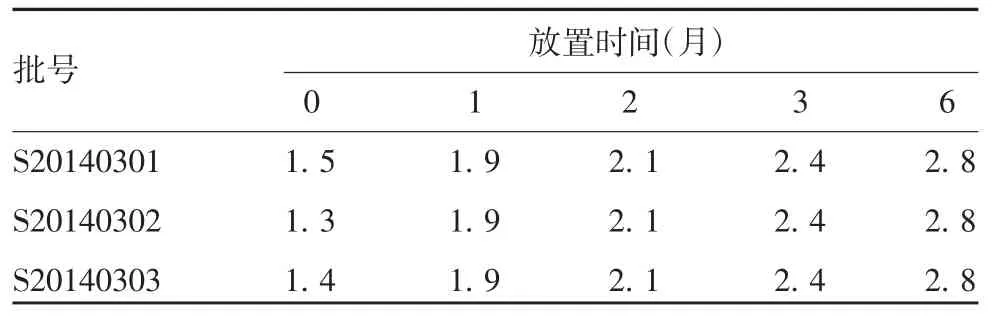
表4 3批试验疫苗于(25±2)℃放置不同时间的水分含量(%)Tab.4 Moisture contents(%)of three batches of experimental vaccine stored at(25±2)℃for various months
2.2.3病毒滴度 3批试验疫苗于(25±2)℃放置的病毒滴度随放置时间的延长呈逐渐下降趋势,放置6个月后,病毒滴度在6.50 lgCCID50/剂及以上,仍在合格范围内。3批试验疫苗各时间点的病毒滴度差异无统计学意义(F=0.371,P=0.698)。见表5。
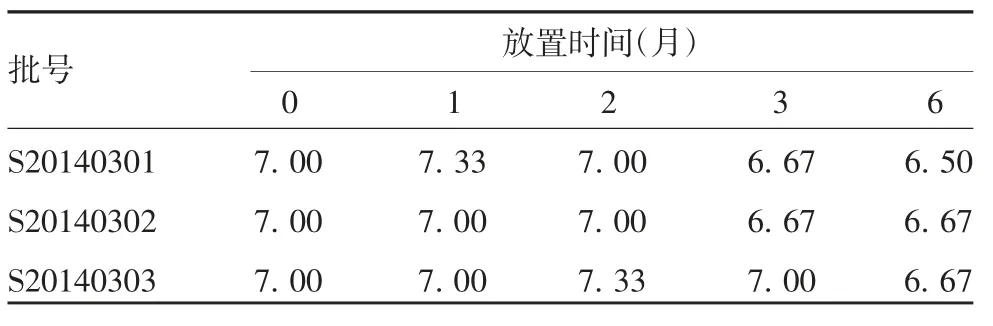
表5 3批试验疫苗于(25±2)℃放置不同时间的病毒滴度(lgCCID50/剂)Tab.5 Virus titers(lgCCID50/dose)of three batches of experimental vaccine stored at(25±2)℃for various months
2.2.4pH值 3批试验疫苗于(25±2)℃放置6个月,pH值平稳,未发生变化,均为7.0,达到合格标准。
2.2.5全面检测 3批试验疫苗于(25±2)℃放置0、2、6个月的全面检测结果均合格。
2.3试验疫苗与市售疫苗的稳定性对比 试验疫苗与市售疫苗于(5±3)℃放置0个月,全面检测结果均达到合格标准;放置9个月,外观均为白色疏松体、复溶后无异物,水分含量均低于3.0%的限度值,符合规定,病毒滴度均达到合格标准,pH值检测结果稳定;放置18个月,除渗透压摩尔浓度因质量标准不同存在差异外,其他各项检测结果均无明显差异。见表6。
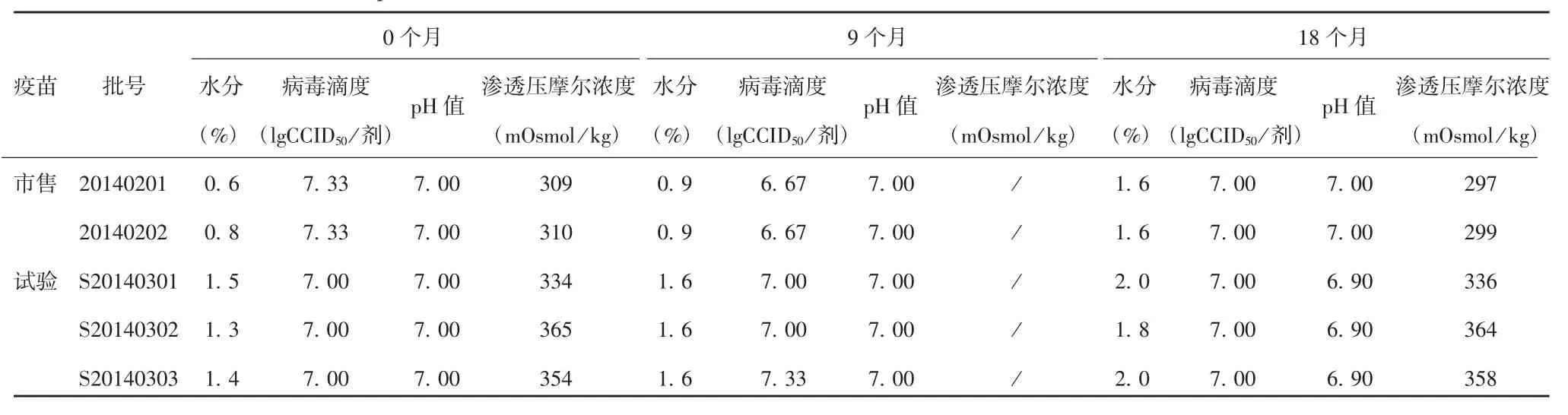
表6 试验疫苗与市售疫苗于(5±3)℃放置0、9和18个月的检测结果对比Tab.6 Control test results of experimental and commercial vaccines stored at(5±3)℃for 0,9 and 18 months
3 讨论
甲肝的发病率与社会经济生活水平和环境卫生情况密切相关[11]。我国近年来随着甲肝疫苗的广泛应用,甲肝的感染率和发病率呈明显下降趋势[12],但仍存在散发流行和局部暴发的潜在风险。2020年,辽宁省甲肝疫情暴发,感染人数较上一年同期上升67.62%[13]。可持续地接种甲肝疫苗,使易感人群形成免疫屏障,是最有效的疫情防控手段。
稳定性研究是贯穿整个药品研发阶段和支持药品上市及上市后研究的重要内容,通过对产品的稳定性进行研究,可设定产品的有效期,判断产品工艺、制剂处方、包装材料选择的合理性,同时也可作为产品质量标准的制定基础。
本研究结果显示,规格变更后的冻干甲型肝炎减毒活疫苗(由复溶后1.0 mL/瓶变更为复溶后0.5 mL/瓶)无论是长期稳定性试验还是加速稳定性试验,均表现出较好的稳定性,各项检测结果均合格,符合《中国药典》三部(2010版)中相关规定。将该试验疫苗(0.5 mL/瓶)与市售冻干甲型肝炎减毒活疫苗(1.0 mL/瓶)进行稳定性对比研究可知,该疫苗与市售冻干甲型肝炎减毒活疫苗在所有质量参数上均一致,符合市售疫苗质量标准。表明将冻干甲型肝炎减毒活疫苗的规格由复溶后1.0 mL/瓶变更为复溶后0.5 mL/瓶,在工艺和质量上可行且稳定。
复溶后为0.5mL/瓶的疫苗与复溶后为1.0mL/瓶的疫苗相比,具有可减轻接种时的疼痛感,有利于计划免疫的推广和应用;提高疫苗的安全性;减少疫苗注射过程中活病毒外溢;减少辅料用量,从而降低生产的成本等优点。同时,通过查阅生物制品一类疫苗批签发数据可知,因每种疫苗生产厂家不同,26个国家计划免疫一类疫苗(包括糖丸及其他剂型)中,规格为0.5 mL/剂的疫苗多达15个,占58%,表明0.5 mL规格的疫苗是计划免疫中疫苗发展的趋势,更有利于计划免疫的接种和实施。
综上所述,本文对冻干甲型肝炎减毒活疫苗规格变更后(复溶后0.5 mL/瓶)的稳定性进行了研究,为该疫苗的质量提升奠定了基础。
