无机纳米佐剂的设计及其在人类冠状病毒疫苗免疫增效中的应用
2022-05-12高素素王馨王亚玲陈春英
高素素,王馨,王亚玲 ,陈春英
1国家纳米科学中心,北京 100190
2广东粤港澳大湾区国家纳米科学创新研究院,广州 510700
3中国科学院大学,北京 100049
1 引言
新型冠状病毒(COVID-19)在全球范围内的大流行,截止2022年2月24日已有超过4.3亿例确诊病例,其中包括590多万例死亡病例,共接种疫苗超过84亿针次。冠状病毒是一大类病毒家族,其中一些可导致人类的呼吸系统疾病,从轻微的感冒到严重的急性呼吸道感染及其他并发症,如2003年首次发现的严重急性呼吸综合征(SARS),2012年发现的中东呼吸综合征(MERS)以及2019年至今由SARS-CoV-2冠状病毒引发的COVID-19大流行。冠状病毒(CoV)可分为四类:α-CoV、β-CoV、γ-CoV与δ-CoV,目前已知的所有能导致人类疾病的冠状病毒都属于α与β-CoV,包括轻症状株HCoV-OC43、HCoV-HKU1、HCoV-229E、HCoV-NL63和严重症状株MERS-CoV、SARS-CoV、SARS-CoV-2,而γ与δ-CoV主要感染禽类动物[1]。冠状病毒是一种正义RNA病毒,因其具有日冕状外观而得名,其基因组一般为27-32 kb,如图1所示,主要编码四种结构蛋白:刺突蛋白(S,Spike Protein)、核衣壳蛋白(N,Nucleocapsid Protein)、膜蛋白(M,Membrane Protein)与包膜蛋白(E,Envelope Protein)[2]。SARSCoV和SARS-CoV-2通过将其S蛋白上的受体结合域(RBD)与宿主细胞表面受体血管紧张素转化酶2(ACE2,Angiotensin Converting Enzyme 2)结合而感染人体[3]。由于具有介导病毒与宿主细胞的吸附和融合,诱导宿主免疫反应和病毒中和抗体的作用,S蛋白是疫苗设计中的重要抗原特异性靶点,包括全长S蛋白、S1亚基、RBD和S2亚基。
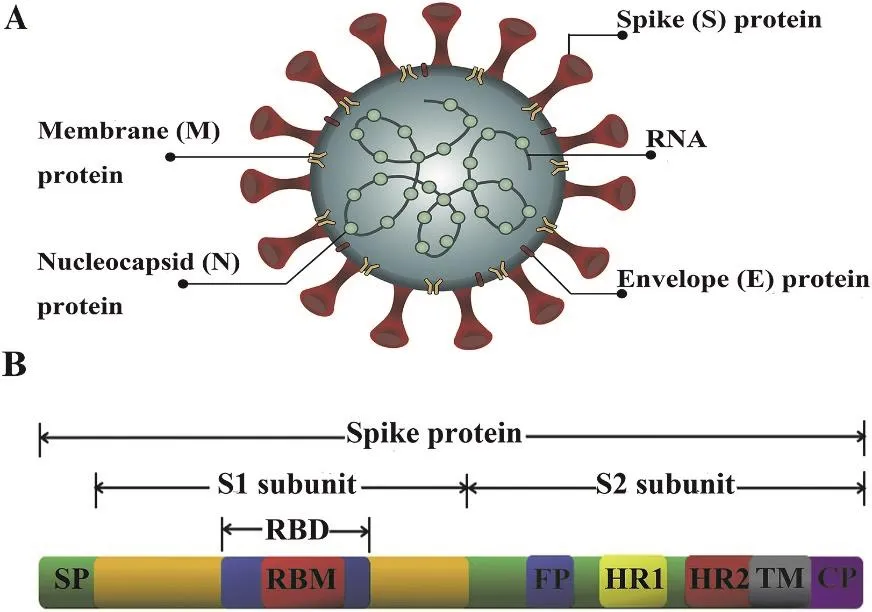
图1 冠状病毒结构[3]
目前,疫苗作为最强有力的技术平台,极大地降低了人类冠状病毒在世界范围内的传播率和致死率,主要包括传统的减毒活疫苗、灭活疫苗、亚单位疫苗与新型的核酸疫苗、基因工程亚单位疫苗、多糖疫苗和基因工程载体活疫苗。然而,SARS-CoV-2基因组的一些适应性突变有可能改变其致病潜能,从而增加传播能力或疾病严重程度。目前,备受关注的SARS-CoV-2变异株(Variants of concern,VOC)包括Alpha、Beta、Gamma、Delta和Omicron,其流行病学特征、传播性和免疫逃逸变化还需进一步研究[4]。伴随着病毒不断的突变和进化,上市疫苗在应对SARS-CoV-2变异株的过程中还需更新换代。尽管疫苗在预防人类冠状病毒感染方面取得了初步成功,但对于一些免疫原性较差的灭活疫苗和亚单位疫苗来说,佐剂是其中不可或缺的关键成分。佐剂,即免疫增强剂,能够提升机体对于抗原免疫响应的速度、强度、广度与持久度,从而减少抗原剂量与注射次数。然而,目前传统的商业化佐剂面临诸多问题,比如无法诱导足够强的免疫响应,具体作用机理尚不明确,生物相容性有待继续考量等。近年来,随着纳米技术的兴起,无机纳米颗粒被开发为对抗各种病毒的疫苗佐剂。通过材料合成与表面化学修饰,可精确调控无机纳米颗粒的组成、大小、形貌、亲疏水性、表面电荷、均匀性与分布等理化性质,以有效刺激体液和细胞免疫,提高疫苗效力[5]。
本文主要综述了近年来用于人类冠状病毒疫苗的无机纳米佐剂,以及无机纳米佐剂在人类冠状病毒疫苗免疫中的增效机制,并提出针对COVID-19疫苗的无机纳米佐剂设计建议,为后续新型无机纳米佐剂与疫苗开发提供新的见解。
2 无机纳米佐剂的设计
佐剂是疫苗中的重要成分。在抗病毒免疫应答的过程中,无机纳米佐剂可作为储存抗原的临时仓库,稳定抗原构象并延长抗原暴露时间;有助于免疫细胞的招募和成熟;促进抗原的摄取、呈递和交叉呈递;选择性诱导不同类型的免疫反应[6]。金属元素在免疫应答过程中的关键作用以及在癌症免疫治疗中的重要应用越来越得到人们的关注。金属离子在免疫信号转导过程中的功能不只限于第二信使,例如,锰离子和锌离子作为先天免疫激活剂的机制研究已被报道[6]。随着疫苗制剂临床研究的深入,传统铝佐剂也正在面临着关键技术和产品性能问题,其理化性质不均一,免疫保护作用机制不清晰,极大地限制了疫苗制剂的稳定性和免疫功效。随着人们对金属免疫的认识增加,目前除了长期应用的铝佐剂外,其他无机金属元素及其纳米颗粒也因其独特的性质发展成为具有潜力的候选佐剂。目前,研究人员开发了不同类型的无机纳米佐剂用于抗冠状病毒疫苗,主要包括铝盐佐剂、锰佐剂、钙佐剂、硅基佐剂与金佐剂等。
2.1 铝盐佐剂及含铝复合佐剂
铝盐佐剂是美国食品药品监督管理局(FDA)批准的第一个人用疫苗佐剂,目前在预防人类冠状病毒感染疫苗中应用广泛。铝佐剂一般通过以下途径增强机体的免疫反应:作为储存抗原的临时仓库,缓慢而持续地释放抗原;激活并促进CD4+T细胞分化为Th2型细胞;促进抗原呈递等[7]。在SARSCoV-2亚单位疫苗的开发过程中,需要面对两个挑战。一是制备重组蛋白亚基,主要激发中和性抗体而不是非中和性抗体,避免非中和性抗体可能导致的抗体依赖性增强效应(ADE,Antibody Dependent Enhancement)。二是添加佐剂,克服亚单位疫苗免疫原性较差的问题。传统铝佐剂通常诱导增强的Th2免疫响应,但Th1免疫响应不足。因此,需要开发各种类型的疫苗佐剂,如含铝复合佐剂,诱导更平衡的Th1/Th2免疫响应,提高疫苗效力[8]。
Darrell J.Irvine教授等通过磷酸盐介导的结合,将SARS-CoV-2受体结合域(RBD)和分子佐剂联合锚定到明矾颗粒上,可促进疫苗成分共同输送到淋巴结,从而引起协同的体液免疫。在免疫原蛋白RBD上位点特异性地引入磷酸丝氨酸(pSer)肽标签,可通过配体交换反应有效结合到氢氧化铝表面,减缓抗原清除,刺激小鼠生发中心反应,并导致中和抗体滴度显著增加。进一步在pSer-RBD中添加含磷酸盐的CpG或皂苷佐剂,可与明矾协同作用,增强疫苗的免疫原性,协同诱导小鼠与恒河猴体内对SARS-CoV-2的中和反应与更平衡的Th1/Th2型免疫响应[9]。
一般情况下,铝佐剂只附着于细胞膜表面,不进入树突细胞,造成细胞内抗原呈递和处理的缺失。并且,抗原在经过溶酶体加工后通过主要组织相容性复合体II(MHC-II)呈现,而不在MHC-I介导的细胞免疫中交叉呈现,限制了T细胞介导的免疫反应。马光辉课题组成功合成了一种明矾颗粒稳定的Pickering乳液(PAPE),作为基于重组蛋白(S蛋白和RBD)的COVID-19新型疫苗佐剂(图2)。与传统的铝佐剂对照组相比,PAPE诱导的抗原特异性抗体滴度提高了6倍以上,分泌IFN-γ的T细胞增加了3倍,表明其同时具有有效的体液和细胞免疫激活作用。铝佐剂具有可获得性广的优势,其微凝胶能够在油/水中间相自发吸附得到PAPE佐剂,并能够迅速吸附抗原,为开发一种安全、可获得、高效的COVID-19疫苗佐剂提供了思路[10]。
图2 PAPE的设计策略[10]
管轶等人开发了一种有效的、基于蛋白质亚单位的SARS-CoV-2候选疫苗,该疫苗(StriFKFH002C)由穗状胞外结构域蛋白(StriFK)和新型的氮二膦酸盐修饰的锌铝混合佐剂(FH002C)组成。FH002C中含有一种临床上用于治疗骨质疏松症的药物活性成分——利塞膦酸盐。研究人员在三个动物模型中系统评估了StriFK-FH002C的免疫原性和保护效果。接种疫苗后,小鼠、仓鼠和食蟹猴体内产生的中和抗体滴度比从COVID-19恢复期个体分离的血浆中观察到的抗体滴度高出30至250倍。与临床上被许可用于戊型肝炎病毒和人乳头瘤病毒疫苗中的传统铝佐剂(Al001)相比,该疫苗能够同时诱导小鼠体内Th1和Th2极化辅助T细胞免疫响应。在重现人类COVID-19疾病的动物模型仓鼠中,接种StriFK-FH002C疫苗可提供保护性免疫,预防SARS-CoV-2感染、发病和传播(图3)[8]。
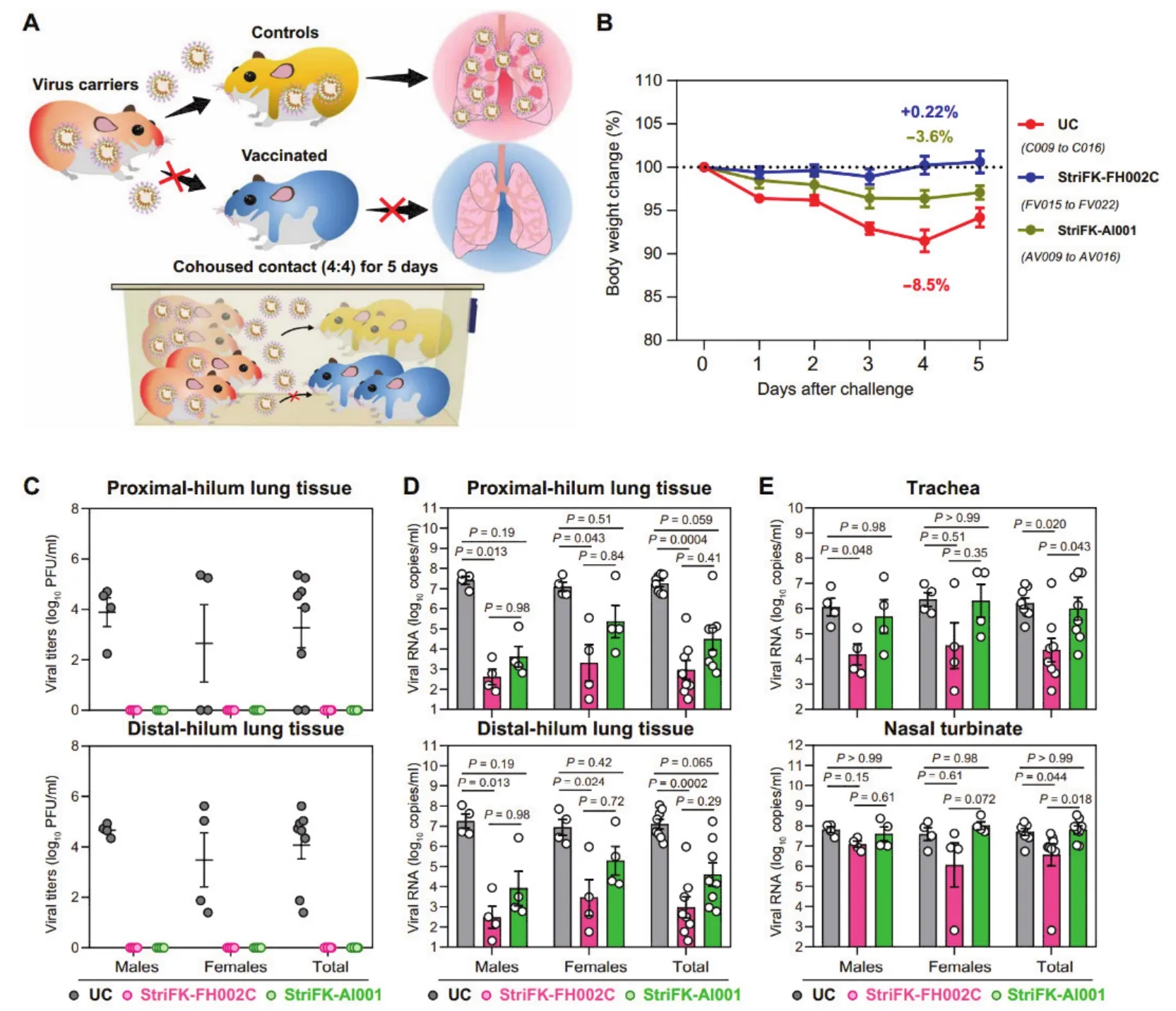
图3 StriFK-FH002C和StriFK-Al001疫苗三次免疫可保护仓鼠免受鼻内SARS-CoV-2感染
除此之外,研究表明,氢氧化铝与CpG佐剂在SARS-CoV-2 RBD疫苗中联合使用,能够增强RBD的免疫原性,在青年和老年小鼠中产生更高的中和抗体滴度,比单独使用氢氧化铝增加80倍,其诱导的抗野生型SARS-CoV-2和B.1.351(beta)变异株的中和抗体血清浓度与已获批的辉瑞BNT162b2 mRNA疫苗诱导的抗体浓度相当。并且,佐剂的联合使用能够协同提高小鼠体内细胞因子和趋化因子的产生,增强树突细胞依赖的记忆T细胞激活,且CpG吸附在氢氧化铝表面形成更易于有效内化的复合物,促进TLR9的激活[11]。
铝佐剂在历史上的使用中显现出了良好的生物安全性,相关研发技术更为成熟,但其免疫刺激能力有限,还需通过对其进行表面修饰、性能优化、与其他佐剂联用等方式,发展新的设计策略,提升其免疫增强效力,尤其是对细胞免疫的激活。
2.2 磷酸钙
磷酸钙(CaP)得益于其优异的生物降解能力、良好的生物相容性、可预测的生物代谢途径、免疫细胞组织粘附能力,以及激活平衡的Th1/Th2型免疫响应的能力,在新型疫苗佐剂的开发中具有良好的发展前景[12]。目前在欧洲,已有磷酸钙佐剂被批准应用于临床上白喉和破伤风疫苗的案例[13]。
磷酸钙首先是一种良好的免疫刺激物质递送载体。一项研究以鸡卵溶菌酶(HEL)为抗原模型,发现相较于直接使用可溶性抗原,利用CaP递送的蛋白抗原CaP-HEL更容易与B细胞上的受体结合,并易被HEL特异性B细胞内化,能靶向并活化抗原特异性B细胞[14]。同时,CaP也可以用于递送其他佐剂。如研究发现一种参与固有免疫激活的TLR激动剂CpG,当使用CaP递送体系时,树突细胞对CpG的内化率明显提高,同时DC的熟化程度和相关细胞因子水平(IL-6、TNF-α)也远高于直接递送CpG的对照组[15]。此外,CaP也是一种适用于鼻腔给药的疫苗递送载体。唐睿康课题组开发了一种鼻腔给药的生物矿化膜包覆的嵌合疫苗(BioVaccine),如图4[16]。该设计采用登革热病毒嵌合疫苗(ChinDENV2)为原料,通过沉积的方式,在原始疫苗表面包覆上一层CaP外壳(图4a)。研究发现,相较于未经包覆的疫苗,CaP外壳能有效地帮助该疫苗粘附在鼻内黏膜上,使其在鼻腔内的驻留时间由6 h延长至24 h。由于CaP外壳的存在还能促进APC对纳米疫苗非受体依赖性的摄取,BioVaccine能进一步诱导局部黏膜IgA抗体的大量产生,显著激活鼻腔黏膜免疫。同时相较于未经包覆的ChinDENV2,BioVaccine经鼻腔给药能在生物体内同时诱导更强效的抗病毒体液免疫和细胞免疫(图4)。
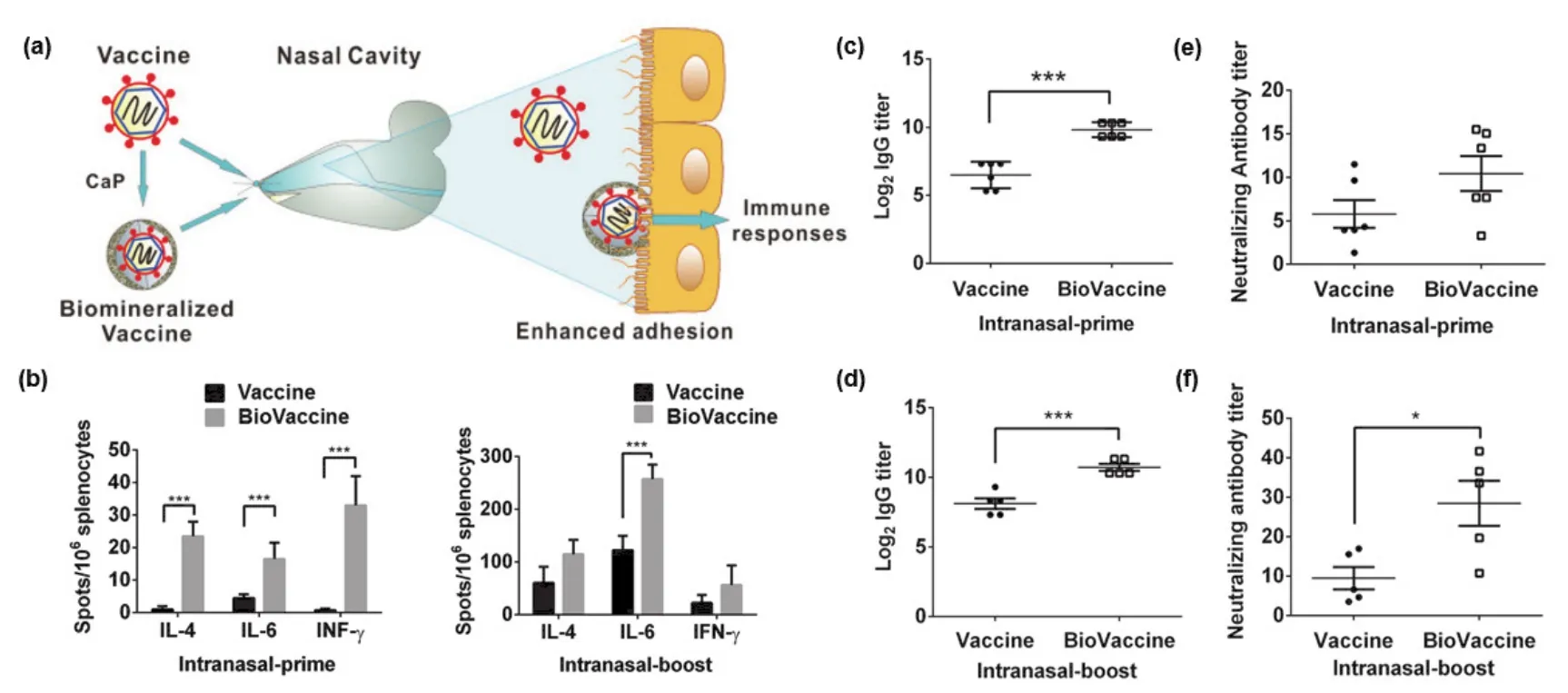
图4 鼻腔给药的磷酸钙包覆的嵌合疫苗(BioVaccine)
磷酸钙在作为递送载体的同时也展现出了其本身优异的免疫刺激效果。磷酸钙的免疫激活机理与铝佐剂有诸多相似之处[12]:(1)磷酸钙也具有存储库效应,可以递送抗原,维持抗原稳定性;(2)磷酸钙可以激活NLRP3炎性小体,促进炎性因子的释放;(3)磷酸钙可以促进APC熟化,增强抗原呈递。但与传统铝佐剂不同的是,磷酸钙具有良好的黏膜粘附性,能有效调控生物体黏膜免疫,并且磷酸钙和抗原组成核壳结构后能有效诱导系统性细胞免疫。由此可见钙盐佐剂有可能是继铝盐之后,免疫激活效果更优,安全性更好,极具临床转化潜力的新一代疫苗佐剂。
2.3 锰佐剂
锰是人体必需的一种微量元素,参与人体的生长发育、生殖以及神经信号转导等诸多生理活动[17]。同时,锰离子的存在对于维持机体良好的免疫防御功能也有重要的意义。研究发现,Mn2+与cGAS结合,能够提高cGAS对双链DNA识别敏感度,增强cGAS的酶活性,增强cGAMP和干扰素基因刺激因子(STING)间的结合亲和力,有助于激活cGAS-STING信号通路,加强生物体固有免疫[18]。此外,Mn2+本身也是一种有效的先天免疫刺激因子,在无感染的情况下即可诱导I型干扰素(IFN)和细胞因子的产生[18]。锰离子上述优异的免疫刺激能力,均显示了其对增强人体抗病毒免疫的重要意义,具有作为新型疫苗佐剂的巨大潜能。
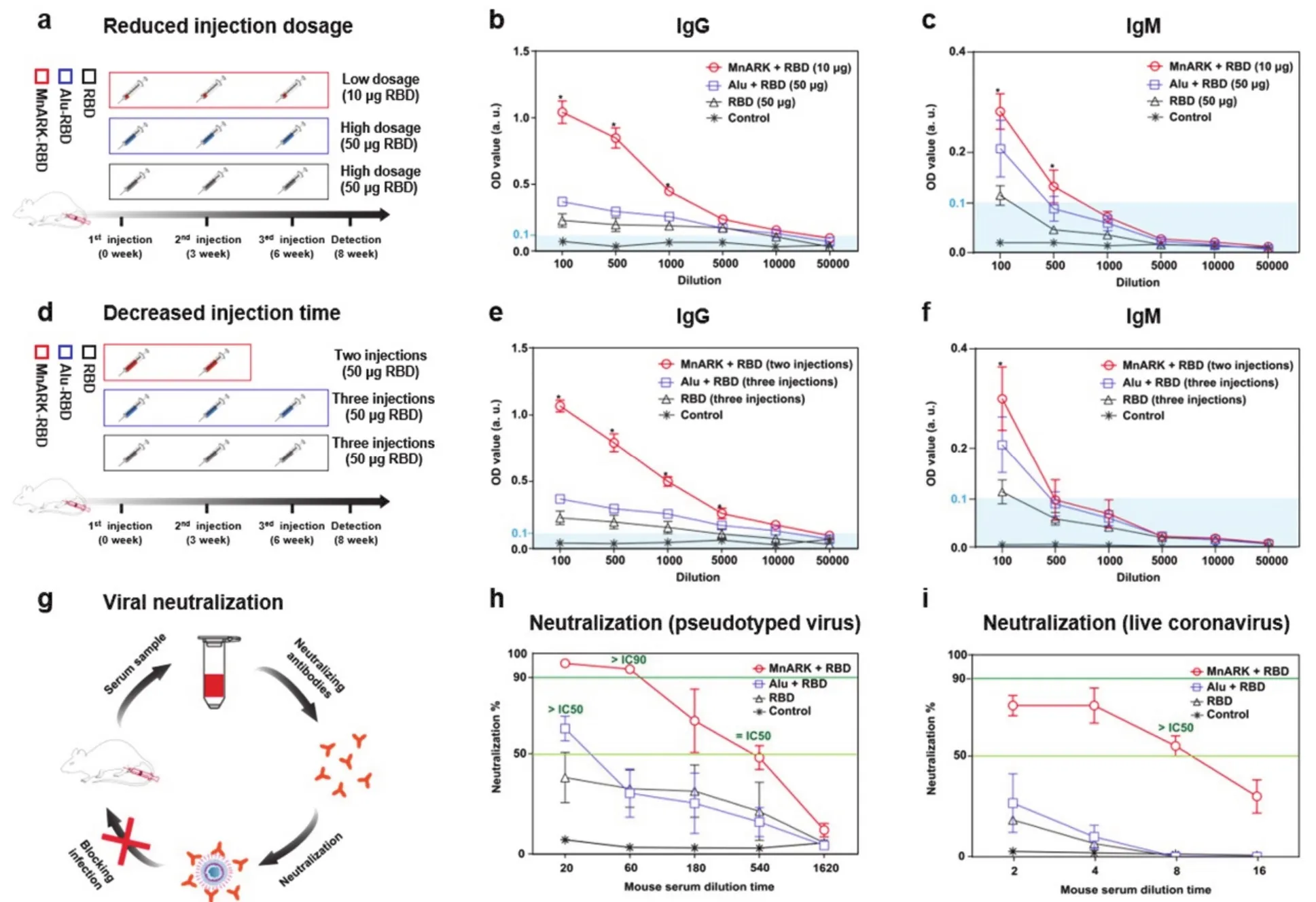
图5 预防新型冠状病毒的RBD-MnARK纳米疫苗作用效果
纳米锰佐剂具有成本低、可获得性广、稳定性好与生物相容性良好的优点,并且如MnJ等纳米锰佐剂也被证实在生物体内能诱导有效的抗病毒黏膜免疫[21]。由此见得,纳米Mn佐剂在新冠病毒疫苗领域具有巨大的临床开发潜力。
2.4 硅佐剂
抗病毒疫苗通常以生物活性大分子作为抗原,如蛋白质、DNA、RNA等,可以通过特殊的载体进行递送。介孔二氧化硅纳米颗粒(MSNs)为抗原的递送提供了合适的条件:高稳定性、高比表面积、易于表面功能化修饰以及大的孔容量。MSNs由无定形二氧化硅组成,随着时间的推移,很容易在体内降解,因此在体内具有较好的安全性。研究人员制备了具有大孔隙(30 nm)的单分散二氧化硅微球,可通过传递多种细胞因子(如IL-4)来调控免疫系统,比传统的小孔隙(3.2 nm)二氧化硅微球具有更高的蛋白负载能力。IL-4负载的MSNs能够在体内触发M2巨噬细胞极化(图6)[23]。介孔二氧化硅棒(MSRs)能够自发地堆叠形成微孔和三维支架结构。研究人员开发了一种基于MSRs的可注射疫苗,能够提升全身性Th1和Th2血清抗体和细胞毒性T细胞水平[24]。通过释放炎症信号和佐剂(如单链DNA,CpG-ODN等),树突细胞被招募到三维支架之间的孔隙中。
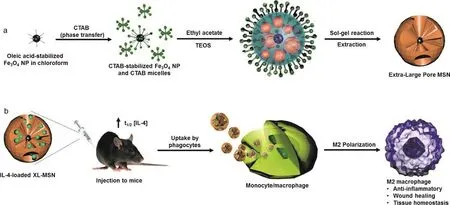
图6 MSNs的合成及其在体内递送IL-4的示意图[23]
除此之外,介孔二氧化硅与其他抗原载体联合使用可增强佐剂的免疫活性。例如,层状双氢氧化物(LDH)纳米颗粒可以被单核细胞衍生树突细胞(MDDC)吸收,并能够促进树突细胞成熟。为了进一步增强LDH的免疫佐剂活性,研究人员成功合成了一种具有约210 nm平均直径的核-壳结构SiO2@LDH纳米颗粒,用于乙型肝炎病毒DNA疫苗递送,可促进IFN-γ、IL-6、MHC II和CD86的表达,从而增强小鼠体内免疫响应。SiO2@LDH纳米颗粒还能促进T细胞增殖,诱导辅助T细胞向Th1型免疫应答倾斜,并导致NF-kB免疫信号通路活化[25]。此外,MSNs的理化性质易通过表面配体的偶联作用进行调节,构建pH响应型疫苗递送系统[26]。
硅基佐剂,尤其是介孔二氧化硅材料,具有强大的负载能力和易于表面修饰的特点,为新型佐剂开发和抗原、佐剂共递送,增强佐剂活性提供更多思路。
2.5 金纳米颗粒
金纳米颗粒(AuNPs)在生物环境中的物理化学性质稳定,具有低毒性、非免疫原性、多功能性的特征和良好的抗原负载能力,并且可刺激多种免疫细胞产生促炎因子和细胞因子(包括IL-1β、TNF-α等),可同时作为抗原的递送载体和疫苗佐剂,有效调控生物体免疫应答。
研究显示,使用SARS-CoV的刺突蛋白作为抗原模型,单独使用AuNPs作为佐剂,虽能促进抗原特异性IgG的产生,但是无法诱导产生足以对抗病毒感染的免疫屏障,并且不能缓解冠状病毒导致的肺部嗜酸性粒细胞的浸润[27]。通常,结合多种额外的免疫佐剂,能使AuNPs发挥更理想的免疫调节效果。詹林盛课题组设计了一种新型功能化纳米金促进剂(NanoAu-Cocktail),能共同递送OVA抗原肽和TLR9激动剂CpG,激活生物体免疫响应[28]。NanoAu-Cocktail可使DC总淋巴器官归巢数量提高15倍,肝脏引流淋巴结归巢数量提高36倍。该体系显著增强了DC对抗原的摄取和交叉呈递,促进Th1型细胞因子的上调,为机体提供有效的抗病毒细胞免疫。针对目前的SARS-CoV-2,Kumar等人开发了一种壳聚糖修饰的金纳米星,用于递送携带新冠病毒刺突蛋白编码信息的DNA疫苗(图7)[29]。通过鼻腔给药的模式,该疫苗体系能显著激活小鼠的呼吸道黏膜免疫,促进机体高水平表达S蛋白特异性IgG和IgA,且研究中这两种抗体对新冠亚种(Wuhan,D614G和beta突变体)的假病毒都表现出了极强的中和能力。同时,免疫荧光染色实验也显示了在接种该疫苗后,小鼠淋巴结和肺部的T细胞和B细胞都被激活,能有效对抗新冠病毒感染。
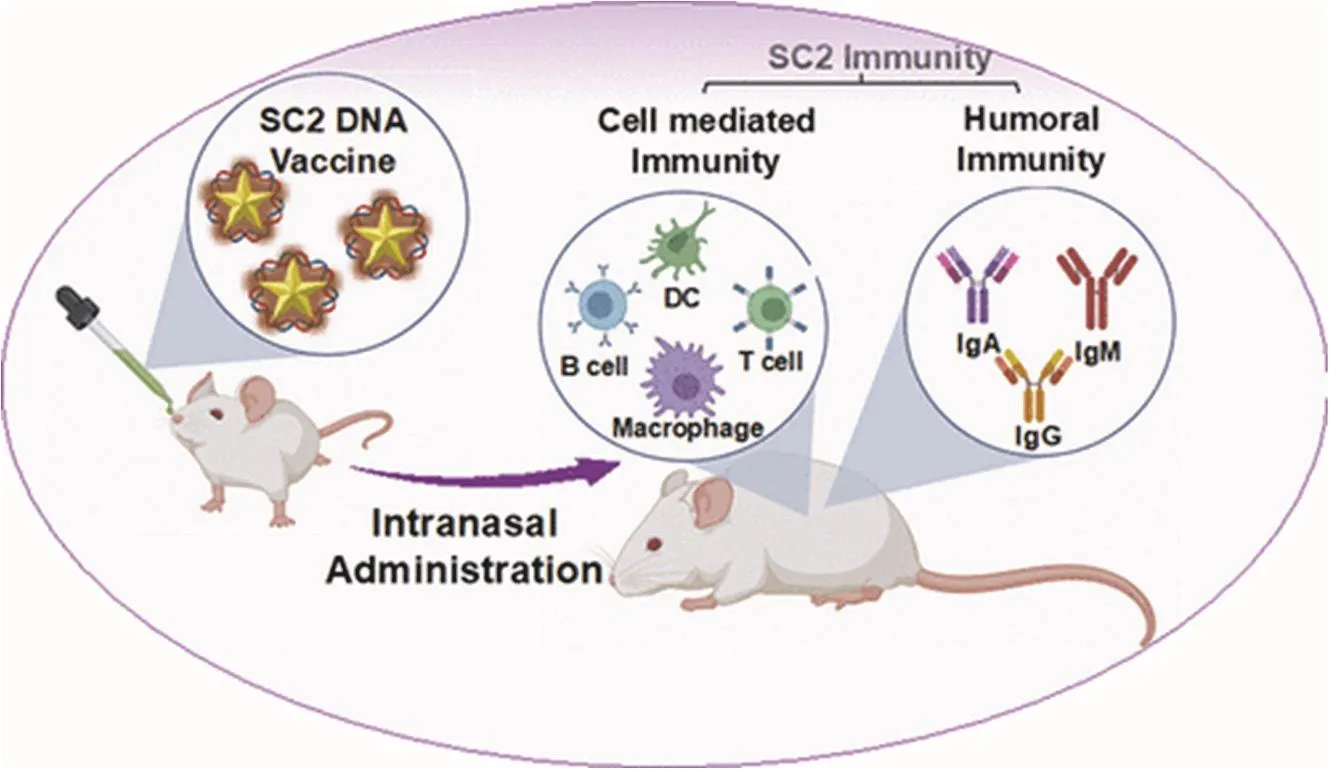
图7 壳聚糖修饰的金纳米星递送DNA疫苗[29]
此外,通过在戊型肝炎疫苗(HEVA)中“原位”生长金纳米团簇可获得一种新型疫苗[30],基于金纳米团簇的荧光特性,该体系不仅能激活生物体免疫响应,还能通过金纳米团簇实时跟踪疫苗的动态行为,有助于进一步了解疫苗诱导免疫应答的分子机制。
金纳米颗粒能有效递送抗原,引起生物体所需的免疫响应。但研究显示较高剂量(>8 mg·kg-1)裸露的金纳米颗粒会在生物体内引起严重的毒性反应,使用AuNP作为疫苗佐剂或载体的风险和长期后果仍需进一步调查[31,32]。
3 无机纳米佐剂在人类冠状病毒疫苗免疫中的增效机制
免疫系统在机体对抗病毒的过程中起到了重要的作用(图8)。疫苗的出现为人类对抗病毒的过程提供了极大的助力。疫苗中抗原和佐剂的设计为人类对抗新冠病毒提供了双重保险。目前,佐剂在冠状病毒疫苗中主要起到了以下作用[33]:(1)诱导平衡的Th1和Th2免疫反应,阻止嗜酸性粒细胞浸润;(2)增加中和抗体水平;(3)诱导抗原特异性IgG反应;(4)诱导黏膜免疫;(5)提高疫苗的免疫原性,减少疫苗剂量;(6)提高机体免疫系统的响应速度和免疫效果持续时间。
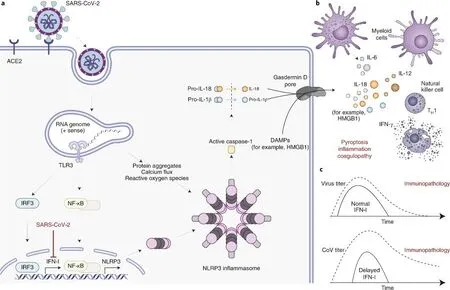
图8 新冠病毒感染及生物体免疫应答过程[34]
3.1 增强体液免疫
中和抗体是机体对病毒适应性免疫系统中体液免疫的关键部分,通过与病毒表面抗原结构特异性结合,发生中和反应,从而阻止病毒感染宿主细胞。研究表明,许多无机纳米佐剂具有增加中和抗体水平的基本作用。针对预防MERS和SARS的重组蛋白(S蛋白)亚单位疫苗中,接种含有明矾佐剂的疫苗后,小鼠体内中和抗体的水平提升了15倍[35]。不同佐剂的联合使用可能进一步促进中和抗体的产生,诱导协同的免疫保护反应。在小鼠接种联合使用明矾佐剂与rASP-1佐剂的RBD疫苗后,其体内产生了一种能够强烈抑制MERS-CoV的中和抗体,通过抑制RBD与宿主细胞受体的结合发挥作用[36]。研究人员利用含明矾和CpG佐剂的SARS-CoV-2 RBD亚单位疫苗,也可诱导小鼠体内产生大量中和抗体。此外,不同的给药方式影响产生的中和抗体水平,使用鼻内或腹腔内免疫途径可能提供血清与黏膜内理想的SARS-CoV中和抗体活性[37]。因此,在疫苗开发中,应充分考虑并优化各种佐剂的组合、配比、混合顺序与注射部位等因素,使疫苗激发最佳的保护性免疫应答。
免疫球蛋白(Immunoglobulins,Ig)是免疫活性分子中的一类,根据其化学结构不同,可分为五类,即免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白D(IgD)和免疫球蛋白E(IgE)。其中,IgG约占血清总Ig的75%-80%,是机体抗感染的“主力军”,亲和力高,能够促进单核巨噬细胞的吞噬作用,中和病毒。IgA有血清型和分泌型两种。分泌型IgA是黏膜局部免疫的主要成分,能够阻止病毒黏附于细胞表面并中和毒素[38]。研究表明,SARS-CoV灭活疫苗中添加明矾佐剂,能够提升血清中特异性IgG抗体水平,但不足以刺激IgA抗体水平提升[39]。研究人员比较了含有不同市售明矾佐剂、弗氏佐剂、单磷酰脂质A(Monophosphoryl lipid A,MPLA)、Montanide ISA51以及MF59的MERS-CoV RBD亚单位疫苗在体内产生的不同免疫反应。其中,MF59表现出诱导IgG,IgG1和IgG2a亚型中和抗体的最佳效果[40]。此外,含有CpG-ODN佐剂的SARS-CoV灭活疫苗,能够促进小鼠血清中特异性IgG与IgA抗体的产生,并在黏膜分泌物中检测到大量的IgA抗体[37]。研究人员开发了一种通过鼻腔给药的壳聚糖修饰的金纳米星SARS-CoV-2 DNA疫苗,能够诱导S蛋白特异性IgG和IgA的高表达。因此,发展铝盐佐剂之外的无机纳米佐剂,尤其是黏膜免疫佐剂,诱导血清和黏膜分泌物中抗原特异性IgG和IgA的产生,进一步提高免疫应答,还需更多探索。
3.2 诱导T细胞活化,平衡Th1/Th2免疫响应
SARS-CoV-2能够在不暴露于细胞外环境的情况下从一个细胞传播到另一个细胞,因而单纯依赖B细胞介导体液免疫产生抗体在对抗新冠感染的过程中产生的作用始终是有限的。在对抗病毒感染的过程中,T细胞始终扮演着重要的角色。T细胞在胸腺内经MHC限制性选择发育为CD8+T细胞和CD4+T细胞。在接受抗原刺激后,活化的CD8+T细胞主要形成细胞毒性T细胞(CTL),通过细胞毒作用对宿主细胞进行直接杀伤,且CD8+T细胞更容易分化形成记忆T细胞;而CD4+T细胞主要分化为Th1、Th2、Th17等T效应细胞亚群,Th1细胞主要通过产生的细胞因子介导细胞免疫,Th2细胞则主要通过分泌Th2型细胞因子,支持B细胞发挥功能,介导体液免疫应答[41,42]。例如,以淋巴液的分子伴侣蛋白(白蛋白)为模板的锰纳米佐剂,通过对淋巴结的自靶向实现了新冠RBD抗原和佐剂的共递送,激活抗病毒的天然免疫通路(STING),不仅产生了强的中和抗体水平,也激活了强而广泛的T细胞免疫(图9)[22]。
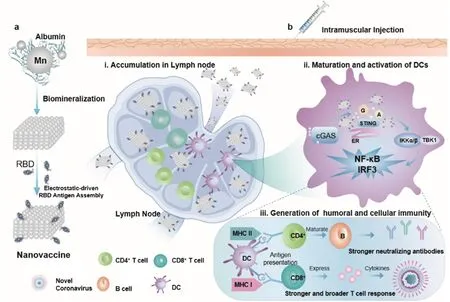
图9 抗新型冠状病毒的RBD抗原/锰纳米佐剂共递送疫苗设计及免疫增效机制示意图[22]
一项研究设计了一种氧化石墨烯纳米片佐剂(L-GO)[43],该佐剂能通过整合素ICAM-1膜定位促进DC-T细胞突触的形成,作为一种“纳米拉链”,促进DC-T细胞簇的聚集,为T细胞的激活创造一个稳定的微环境。此外,L-GO能显著激活小鼠体内的SARS-CoV-2刺突蛋白特异性CD8+T细胞,介导强大的细胞免疫,为开发有效的COVID-19疫苗提供了一种新的方案。对于只能激活Th2型免疫响应的传统铝佐剂,它们一般无法诱导有效的细胞免疫,通常可以通过设计复合佐剂诱导更为平衡的Th1/Th2型免疫响应以弥补这一缺陷。北卡罗来纳大学Rama Rao Amara团队针对SARS-CoV-2开发了一种RBD的三聚体,用TLR7/8激动剂结合传统明矾佐剂组成的Alum-3M-052不仅诱导了比Alum高100倍的中和抗体效价,而且还显著诱导CD4+T细胞Th1型分化,具有更好的抗新冠病毒感染保护作用[44]。Maria Pino等人同样采用Alum-3M-052佐剂,发现其不仅检测到Th1细胞的上调,还发现了针对SARSCoV-2 RBD的CD8+T细胞的显著激活[45]。此外,冠状病毒感染会诱发肺部嗜酸性病变,而诱导平衡的Th1/Th2型免疫响应,能避免肺部嗜酸性粒细胞浸润,有助于提高疫苗的有效性和安全性[33]。
3.3 诱导抗病毒长效免疫
一款成功的疫苗,需要能诱导长期有效的抗病毒免疫反应,这可以通过诱导产生长效中和抗体和记忆细胞的产生来实现[46]。目前全球已有多款新冠病毒疫苗投入到临床应用中,但人们至今未明确这些疫苗接种后在人体内诱发的抗体持久性和免疫记忆程度。研究认为,引流淋巴结(dLNs)的生发中心(GC)反应是诱导高质量持久B细胞反应的基础,滤泡辅助性T细胞(TFH)又是生发中心反应的关键调节细胞。Etsuro Nanishi采用氢氧化铝佐剂(AH)和CpG混合佐剂配合新冠病毒RBD抗原,发现该佐剂能显著促进生发中心的形成,抗原体异性类别转换IgG1阳性GC B细胞、TFH细胞的生成,并能有效促进单核细胞来源树突细胞依赖的记忆T细胞的产生。朱明昭课题组对小鼠接种了一种基于铁蛋白纳米颗粒和新冠病毒RBD的新型疫苗后,成功诱导了长达7个月的有效抗体应答,接种后210天进行抗原再刺激时能检测到大量记忆B细胞和高于对照组2000倍的特异性抗体产生[47]。
4 无机纳米佐剂在疫苗递送与抗原展示中的应用
无机纳米材料,除了具有佐剂效应外,本身也是一种特性优良的疫苗递送载体。无机纳米材料首先能作为一个临时抗原储存点,吸附抗原并维持抗原在生物环境中的稳定性,延长抗原在生物体内的循环时间。如应用铝佐剂和重组蛋白抗原时,即使在加热加速降解的条件下,蛋白抗原由于吸附在铝佐剂表面从而一定程度上维持了结构的稳定性[48]。同时,无机纳米佐剂能通过存储库效应,吸附抗原,提高抗原在注射位点的驻留,从而发挥免疫增强作用。一项研究通过与Alum、QuilA两种FDA批准的疫苗佐剂进行比较,研究了存储库效应在双层氢氧化物(LDH)和水辉石(HEC)黏土类纳米材料发挥免疫刺激功能时的作用[49]。研究发现,LDH和HEC能在生物环境中形成具有疏松结构的聚集物,经皮下注射能检测到有作为抗原存储库的结块生成。注射LDH和HEC35天后仍能检测到明显的抗原释放,而使用Alum的实验组35天后仅检测到微量的抗原释放;并且相较于Alum和QuilA,LDH和HEC能诱导更高水平的T细胞增殖,促进长效免疫响应。
一些无机纳米材料经有效调控可获得靶向特定免疫器、组织、细胞的功能,可以极大地提高疫苗的递送效率和作用效果。如金纳米颗粒表面修饰树突状细胞特异性细胞内粘附分子抓取非整合素(DC-SIGN),能有效吸附抗原,并在3D肺细胞模型中有效靶向和激活单核细胞来源树突细胞,促进DC摄取抗原,介导下游T细胞响应[50]。此外,严格调控纳米材料的粒径、形貌、表面电性、亲疏水性能有效调控纳米颗粒的淋巴结靶向功能[51]。如研究发现吸附OVA抗原的金纳米颗粒(GNP-OVA),当其粒径达到30 nm时,相较于粒径为10 nm的GNP-OVA,靶向淋巴结的效率更高[52]。同时通过使无机纳米材料结合具有特定靶向功能的结构也可以赋予该体系免疫器官靶向能力。如陈春英课题组使用白蛋白结合MnOx,利用白蛋白的淋巴结靶向能力,同时向淋巴结递送新冠RBD抗原和锰佐剂[22]。
此外,利用无机纳米颗粒可以有效设计抗原在生物体内的展示方式。如可以将无法诱导抗病毒中和抗体的抗原表位掩蔽起来,从而提高疫苗对生物体免疫系统的刺激效率。Darrel课题组使用一种HIV三聚体抗原,通过在该抗原基底上修饰磷酸丝氨酸,使得基底处免疫刺激无效位点吸附在氢氧化铝佐剂上,从而降低该表位的可识别性[53]。针对新冠病毒RBD抗原,该课题组同样修饰上磷酸丝氨酸基团,调控抗原和氢氧化铝佐剂之间的相互作用,并有效暴露出免疫刺激关键表位,从而诱导更高水平的新冠病毒特异性体液免疫[9]。
由此可见,疫苗设计中,应用无机纳米颗粒,并根据需求精准调控无机纳米颗粒物化特性,能有效提高疫苗递送效率和作用效果。下一步,应进一步明确无机纳米材料生物学效应和其物化特性的构效关系,从而进一步推进无机纳米颗粒在疫苗递送中的应用。
5 总结与展望
无机佐剂主要具有以下特点及优势[6]:储存并参与递送疫苗成分,提高抗原稳定性;减少免疫所需抗原用量;增强免疫响应覆盖面;促进树突细胞活化及对抗原的呈递;在生物体内根据需求诱发所需类型的免疫反应;促进抗原交叉呈递,增强T细胞响应;扩大疫苗提供免疫的覆盖范围,延长疫苗成分作用有效时间等。
面对新冠病毒全球大流行,对目前已有的新冠疫苗进行进一步完善,以及积极开发更多能提供强力抗病毒免疫效果的新型疫苗是必要的。基于已有的研究可以发现,相较于传统铝佐剂,新型无机纳米佐剂能够帮助疫苗在生物体内同时激活体液免疫和细胞免疫,诱导更为平衡的Th1/Th2型免疫应答,提高疫苗的安全性和有效性,同时也帮助延长了疫苗的有效时间,为新冠疫苗的开发提供更多思路和可能。此外,SARS-CoV-2是一种呼吸道病毒,生物体针对SARS-CoV-2的首次免疫响应主要在呼吸道黏膜表面发生,如何诱发有效的黏膜免疫也是新冠疫苗设计的一大要点[54]。新型无机疫苗佐剂中,包括Mn佐剂和经有效表面修饰的磷酸钙、金佐剂等都可以增强疫苗对黏膜的粘附作用,增强生物体黏膜免疫,对当下新冠疫苗的研发具有重要的参考意义。
未来,相关研究领域应深入探究无机佐剂的作用机理,建立明确的佐剂和免疫学特性之间的构效关系,积极开发相关原位表征技术,推广系统免疫学概念,全面分析无机纳米材料在生物体内诱发的免疫响应,系统性解释已有纳米免疫材料作用机制,并为新纳米免疫材料的发现及设计提供可靠的理论依据。纳米技术为佐剂领域注入了新鲜血液,帮助开发了具有精准、安全、高效等特征的新一代疫苗佐剂,确保了相关领域研究的持续推进。
