线粒体靶向铱(III)配合物克服肿瘤耐药
2022-05-12熊凯陈禹计亮年巢晖
熊凯,陈禹,计亮年,巢晖
中山大学化学学院,生物无机与合成化学教育部重点实验室,广州 510006
1 引言
癌症已经成为严重威胁人类健康的主要病因。据世界卫生组织报道,全球112个国家中,癌症是70岁之前死亡的第一或第二大原因;在另外23个国家中,癌症居死亡原因的第三或第四位。国际癌症研究机构最新的统计数据显示,全球癌症病例呈现迅猛增长态势。2018年约有1810万例癌症新增病例和960万死亡病例[1],这一数值在2020年分别上涨至1930万和1000万[2]。中国也面临着癌症的严重威胁,我国恶性肿瘤发病占全球的23.9%,恶性肿瘤死亡占我国居民死亡的23.9%[3]。
尽管靶向治疗和免疫治疗发展迅猛,但是化疗仍然是目前临床癌症治疗的最主要手段之一,其中铂类化疗药物占据很大比例,是多种癌症化疗临床方案的主要选择。2019年,中国铂类化疗市场销售收入高达人民币40亿元。铂类化疗药物的研究最早兴起于20世纪60年代。1969年美国密歇根州立大学教授Barnett Rosenberg等首次报道顺铂具有抗肿瘤活性[4]。自此,铂类药物获得了全球众多科学家的青睐。目前已经形成以顺铂、卡铂和奥沙利铂分别为代表的第一、第二、第三代铂类化疗药物[5]。然而在长期临床实践中,患者对铂类化疗药物表现出先天性或后天获得性的耐药性,极大地限制了这类药物的疗效[6]。
线粒体科学是当今化学、生命科学及分子医学最为活跃的交叉前沿研究领域之一。线粒体是生物细胞中负责能量供给、调控细胞存亡的重要细胞器。肿瘤细胞与正常细胞的线粒体无论在结构上还是功能上都存在较大差异,肿瘤细胞由于发生较为广泛的变异,如更加脆弱的氧化还原平衡、基因组不稳定而更容易受线粒体损伤的影响。此外,代谢重编程是癌症细胞的一个核心特征,它与线粒体错综复杂地联系在一起,为开发针对癌症的药物提供了独特的机会。从细胞代谢的全局来看,癌细胞线粒体的能量代谢途径由氧化磷酸化的有氧呼吸转变为以糖酵解为主的无氧呼吸(Warburg effect),其中间产物通常用于合成代谢反应中的氧化磷酸化[7,8];氧化磷酸化过程中产生的活性氧自由基还可导致线粒体蛋白、DNA和RNA分子的氧化[9,10]。
金属药物在药物发展的舞台上扮演着不可或缺的重要角色。2019年中国科学院主办了“金属化学生物学前沿论坛”“金属药物及金属材料应用于疾病诊疗及生物安全性评价”作为论坛三个讨论主题之一,是金属化学生物学的一个重要研究方向。在此背景下,以结构稳定、具有独特三维立体构型的钌、铱等非铂类金属配合物为构筑单元,可以有效跳出传统铂类化疗药物的局限。此外,相比于正常细胞,肿瘤细胞通常具有较高的线粒体膜电位,有利于带正电荷的金属基抗肿瘤药物实现在线粒体中的靶向累积,将有助于实现选择性地杀伤肿瘤细胞。在本文中,我们将简要介绍铂类化疗药物耐药机制和线粒体靶向的环金属铱(III)配合物克服肿瘤耐药研究进展。
2 铂类化疗药物耐药机制
铂类化疗药物的耐药性原因众多。以顺铂为例,其属于细胞周期非特异性药物,主要通过进入肿瘤细胞后与DNA形成Pt-DNA加合物,从而介导肿瘤细胞坏死或凋亡,进而产生抗癌效果。如图1所示,顺铂发挥作用包括三个过程:通过自由扩散以及跨膜主动运转进入细胞(过程1);在细胞内发生离解反应生成水合配离子(过程2);向靶DNA迁移,与DNA配位形成Pt-DNA加合物,使DNA的合成受阻(过程3)。在这三个过程中,肿瘤细胞均可能应激导致顺铂耐药[11]。
(1)摄取过程:顺铂通过主动运输协同自由扩散被细胞摄取。在此应激下,一些癌细胞高表达三磷酸腺苷结合转运蛋白(ABC)超家族酶,如P糖蛋白(ABCB1,又名P-gp或MRP1)、ABCG2(又名MRP2)、ABCG3(又名MRP3)等,这些蛋白作为分子泵会将细胞内顺铂外排至细胞外,降低细胞内药物分子有效浓度,从而引起耐药[12]。
(2)水解过程(一系列水分子取代一个或两个氯原子过程):细胞内氯离子浓度(约2-10 mmol·L-1)低于细胞外环境(约110 mmol·L-1),顺铂在细胞内更易发生这一水解反应。但由于这一水解过程主要在细胞质中发生,而细胞质中富含还原性谷胱甘肽(GSH)、RNA以及金属硫蛋白等含半胱氨酸/蛋氨酸蛋白质,水解产物易与这些内源性亲核试剂相互作用(图1,过程4),阻止顺铂进入细胞核与DNA结合,从而引起顺铂失活[13]。
(3)DNA损伤过程:顺铂水解产物与DNA上鸟嘌呤共价结合致使DNA损伤,最终杀伤癌细胞。然而细胞核中存在多种DNA损伤修复机制,如光修复、错配修复、切除修复、重组修复、烷基转移修复等,其中核苷酸切除修复、碱基错配修复、DNA双链断裂损伤修复及跨损伤修复与顺铂耐药密切相关。肿瘤细胞通过上调这些特定DNA修复酶抵抗顺铂诱导的DNA损伤[14]。
上述顺铂耐药机制集中于药物作用靶点或者药物代谢、药物运输等靶点上游活动。而近些年来,随着对肿瘤发生发展机制研究的深入,人们发现除了上述因素之外,细胞对于药物作用的反应也会累积耐药结果,其表现为凋亡机制的失调。作为细胞程序性死亡模式,凋亡涉及一系列基因的激活、表达以及调控,由几十种抗凋亡和促凋亡蛋白组成,同时也受多种致癌信号的影响,调控难度大[15]。
3 线粒体靶向铱(III)配合物克服肿瘤耐药
作为可预见的治疗靶点,线粒体靶向抗肿瘤试剂在克服肿瘤耐药、治疗肿瘤中具有十分突出的优势。相比于正常细胞,肿瘤细胞通常具有较高的线粒体膜电位,有利于带正电荷的金属基抗肿瘤药物实现在线粒体中的累积,有可能实现选择性地杀伤肿瘤细胞[16,17]。针对上述顺铂耐药关键机制,中山大学巢晖课题组开展了系列研究。
3.1 靶向线粒体DNA
人体细胞内仅有线粒体和细胞核这两种细胞器具有DNA。与细胞核强大的DNA损伤修复机制不同,线粒体DNA损伤机制较为匮乏、单一,因此诱导线粒体DNA损伤可以规避细胞核DNA损伤修复机制所引起的耐药。
在前期实现铱(III)配合物线粒体靶向性的基础上,通过将顺铂与铱(III)配合物有机结合,构建了异双核金属配合物Ir-Pt,并应用于线粒体靶向抗肿瘤(图2)[18]。电感耦合等离子体质谱(ICP-MS)等实验结果证实,被细胞摄取的Ir-Pt中有80%富集于线粒体。有趣的是,这一设计策略不仅有效改变顺铂的细胞内靶向性,还提高了顺铂的细胞摄取量并减少耐药肿瘤细胞对顺铂的外排,显著提高细胞内顺铂有效浓度。Ir-Pt孵育12小时后,顺铂耐药的人非小细胞肺癌细胞A549R中Pt元素含量为41.2±2.5 ng/106细胞;作为对照,同等条件下,顺铂在该细胞中的摄取仅为5.1±1.3 ng/106细胞。体外抗肿瘤活性筛选实验结果表明,48小时Ir-Pt对A549R细胞的半抑制浓度(IC50)为2.46±0.28 μmol,与顺铂的半抑制浓度(78.8±8.9 μmol)相比提高了32.8倍,表明Ir-Pt可有效克服顺铂耐药。后续的细胞生物学实验结果表明,Ir-Pt高效损伤线粒体DNA、改变肿瘤细胞能量代谢途径、诱导线粒体去极化。值得注意的是,Ir-Pt诱导A549R细胞的死亡方式是坏死而非传统的凋亡。半胱氨酸蛋白酶(caspase)级联反应检测、不同死亡方式抑制剂筛选以及坏死关键信号蛋白质印迹法(Western Blot)均证实了这一结论。
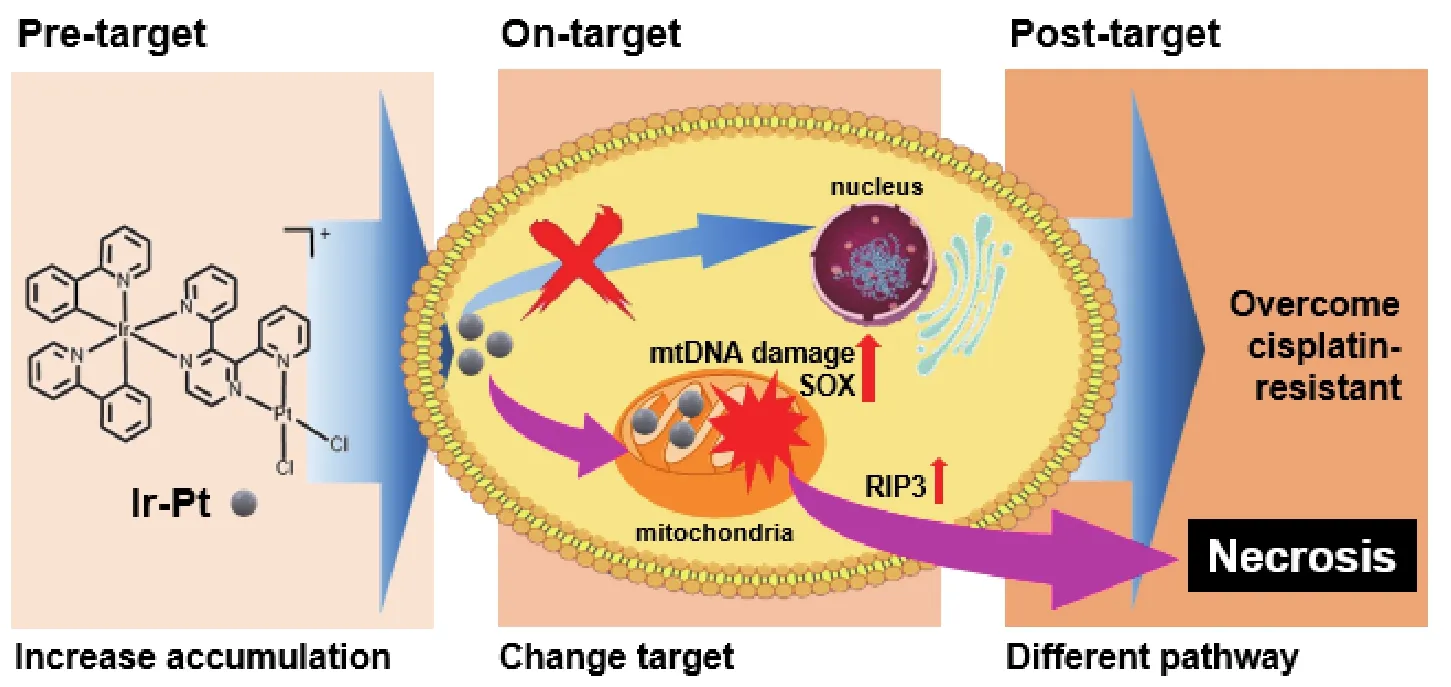
图2 具有线粒体靶向的异双核配合物Ir-Pt克服肿瘤耐药示意图[18]
Ir-Pt虽然取得显著的克服肿瘤耐药效果,但其结构中顺铂衍生物的水解过程与顺铂类似,属于不可控的自发过程,在到达作用靶点前有可能与细胞中的内源性亲核试剂相互作用,引发毒副作用。因此,巢晖等利用配位不饱和的钌(II)多吡啶结构取代Ir-Pt中顺铂衍生物,构建了另一例异双核金属配合物Ir-Ru(图3)。与Ir-Pt不同,Ir-Ru具有生理稳定性,确保其可更高效地富集于作用靶点。当到达作用位点后,利用可见光(450 nm,蓝光)照射可使Ir-Ru光解离,实现时空可控的特异激活。解离后的钌(II)多吡啶部分与线粒体DNA共价结合,损伤线粒体DNA,实现光激活化疗(PACT);而铱(III)配合物部分作为光敏剂,在405 nm光照下产生具有强氧化性的单线态氧,协同损伤线粒体DNA,实现光动力治疗(PDT)。体外抗肿瘤活性筛选实验结果表明,PACT和PDT协同显著提高了Ir-Ru对A549R细胞的抗肿瘤活性(IC50=0.45±0.1 μmol),与顺铂活性相比提高了205.6倍。该策略为后续金属前药的开发提供了新思路[19]。
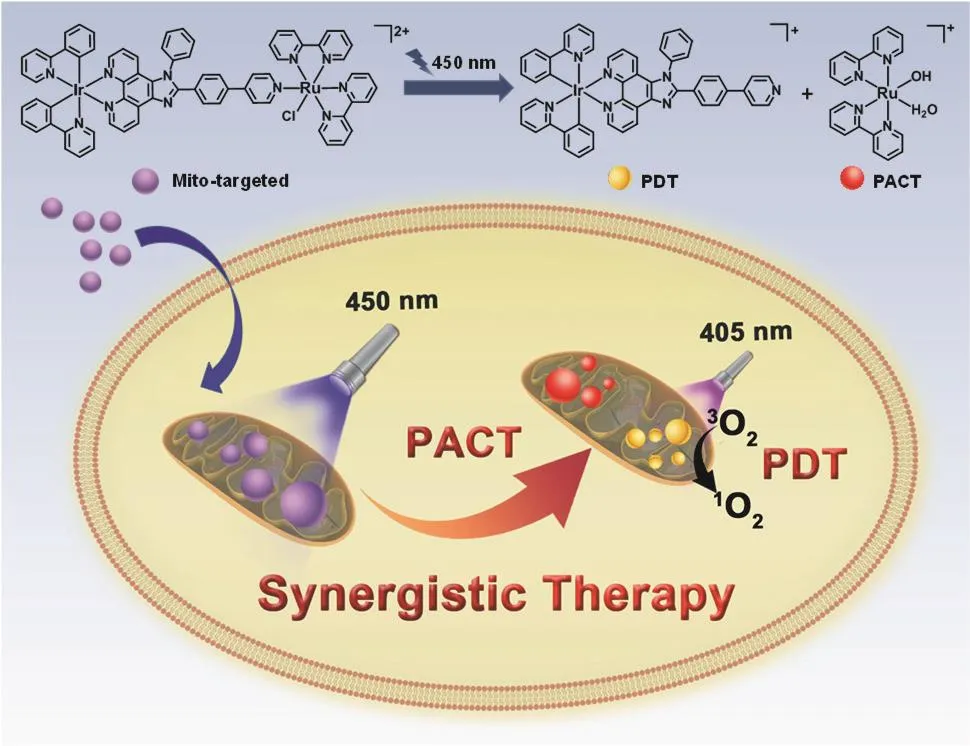
图3 具有线粒体靶向的异双核配合物Ir-Ru通过PACT和PDT协同克服肿瘤耐药示意图[19]
3.2 靶向线粒体拓扑异构酶I
拓扑异构酶是催化DNA链断裂和结合,从而调控DNA拓扑状态的一类酶。由于肿瘤细胞的快速增殖,拓扑异构酶在肿瘤细胞中表现出不受其他因素影响的高水平表达,成为肿瘤化疗药物的一个重要靶标。拓扑异构酶存在于细胞核及线粒体中,但现有的临床药物及相关研究均集中于细胞核拓扑异构酶抑制。巢晖课题组前期构建了系列基于金属配合物的拓扑异构酶抑制剂,展现优异的抗肿瘤活性,但这些配合物的细胞核靶向性以及克服肿瘤耐药的能力尚不明确。2020年,在前期工作基础上,通过辅助配体改变配合物的电荷和脂溶性,从而调控配合物的细胞摄取量和细胞器靶向性,开发了具有细胞核靶向性的钌(II)基拓扑异构酶I/II双重催化抑制。首次揭示了钌(II)配合物通过抑制拓扑异构酶,诱导肿瘤细胞坏死性凋亡之间的内在联系;同时首次在活体模式动物上系统评估诱导肿瘤细胞坏死性凋亡的金属配合物克服肿瘤耐药效果[20]。
上述工作中,拓扑异构酶抑制介导的DNA损伤是激活肿瘤细胞坏死性凋亡的上游事件,耐药肿瘤可能上调特定的DNA修复酶从而削弱药效。而线粒体DNA损伤修复机制较为单一,因此巢晖等进一步发展线粒体拓扑异构酶抑制剂。将已报道的拓扑异构酶抑制剂茚并异喹啉酮,通过柔性烷基链嫁接至铱(III)配合物,构筑了首例基于金属配合物的线粒体拓扑异构酶抑制剂Ir1和Ir2(图4)。拓扑异构酶介导的DNA解旋凝胶电泳实验证实,Ir1和Ir2可高效抑制线粒体拓扑异构酶I活性,其效果优于喜树碱(临床使用的拓扑异构酶抑制剂)。抑制机理实验表明Ir1和Ir2是线粒体拓扑异构酶I毒剂,通过形成稳定的拓扑异构酶-DNA-抑制剂三元复合物,抑制拓扑异构酶活性。进一步的研究表明,Ir1和Ir2诱发拓扑异构酶抑制介导的线粒体DNA损伤、破坏线粒体氧化还原平衡、诱导线粒体去极化,最终诱导细胞凋亡。值得一提的是,Ir1和Ir2对A549R细胞的抗肿瘤活性比顺铂提高约30倍,有效克服肿瘤耐药,具有良好的应用前景[21]。
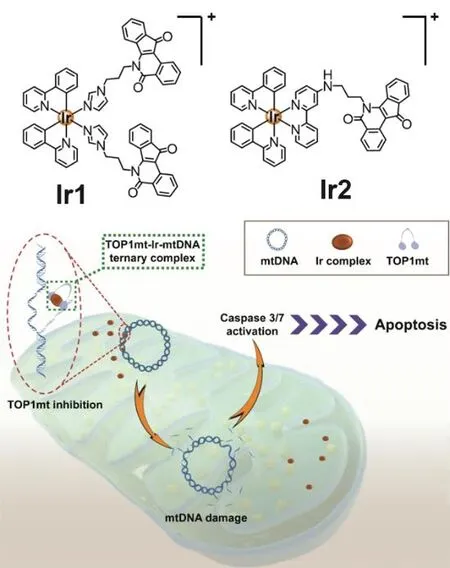
图4 基于铱(III)配合物的线粒体拓扑异构酶抑制剂克服肿瘤耐药示意图[21]
3.3 诱导非凋亡性死亡
如上文所述,许多肿瘤细胞通过凋亡机制的失调表现出耐药性。非凋亡性死亡通常包括坏死(Necrosis)、坏死性凋亡(Necroptosis)、自噬(Autophagy)、副凋亡(Paraptosis)、胀亡(Oncosis)、铁死亡(Ferroptosis)、焦亡(Pyroptosis)、失巢凋亡(Anoikis)、有丝分裂灾难(Mitotic Catastrophe)等。除不受控制的坏死之外,其余死亡方式都受到细胞信号通路控制,为程序性死亡。这些死亡方式在细胞超微结构形态、信号通路调控蛋白、执行死亡的关键蛋白上均与凋亡不同,为规避凋亡抗性耐药提供了理论基础。
金属配合物诱导肿瘤非凋亡性死亡的研究尚处于起步阶段,而其中具有线粒体靶向性的更是罕见。前文提到的Ir-Pt可诱导肿瘤耐药细胞坏死,但由于坏死是不受控的死亡方式,人们更希望能够发展可诱导肿瘤耐药细胞程序性死亡的药物。2018年,巢晖课题组开发了系列靶向线粒体的诊疗试剂Ir3–Ir6(图5)[22]。该系列配合物具有良好的广谱抗肿瘤活性,并对正常细胞具有良好的选择性。体外抗肿瘤活性筛选实验结果表明,Ir3–Ir6可有效杀伤来自不同组织器官的共计21个肿瘤细胞系,其中包括7种耐药细胞,展现优异的克服肿瘤耐药能力。Ir3–Ir6还具有高度选择性,其对肿瘤细胞和正常细胞的IC50值相差30倍以上,为后续临床应用奠定坚实基础。值得注意的是,在研究过程中发现Ir3–Ir6杀伤肿瘤细胞时,细胞的死亡形态与传统的凋亡显著不同。Ir3–Ir6孵育后的肿瘤细胞出现大量空泡;随着孵育时间增长,还可以观察到细胞鼓泡等现象(图5)。进一步的机理研究表明,Ir3–Ir6诱导线粒体去极化及细胞内ATP含量骤降,随后激活前胀亡受体Porimin并诱导细胞骨架(α-Tubulin和β-Actin)坍塌,改变细胞膜通透性改变(乳酸脱氢酶释放),最终诱导细胞胀亡。
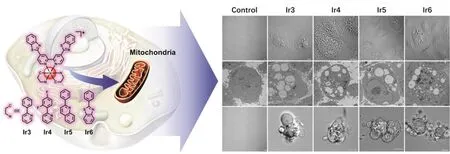
图5 诱导耐药肿瘤细胞胀亡的铱(III)配合物结构及细胞胀亡形态变化[22]
坏死性凋亡是另一种非凋亡性细胞死亡方式,具有坏死和细胞凋亡的共同特征。坏死性凋亡虽然与凋亡共享着一些上游的信号元件,但坏死性凋亡不依赖于caspase的酶联激活,且每个过程的细胞形态有明显差异,特别是坏死性凋亡最终会导致细胞膜破裂,释放内容物。前文提到,巢晖课题组在2020年开发了具有细胞核靶向性的钌(II)基拓扑异构酶I/II双重催化抑制。首次揭示了钌(II)配合物通过抑制拓扑异构酶,诱导肿瘤细胞坏死性凋亡之间的内在联系;同时首次在活体模式动物上系统评估诱导肿瘤细胞坏死性凋亡的金属配合物克服肿瘤耐药效果[20]。
在此基础上,该课题组进一步构建了铱(III)配合物Ir7和Ir8(图6)[23]。ICP-MS结果证实Ir7和Ir8选择性富集于A549R细胞线粒体中。Ir7和Ir8诱导线粒体氧化应激、引起线粒体膜电位丧失,随后激活丝氨酸酸酸激酶3(RIPK3)及下游混合系激酶结构域样伪激酶(MLKL)。激活后的MLKL发生四聚,在细胞膜形成通道,破裂细胞膜通透性,释放细胞质中的乳酸脱氢酶(LDH),最终引发细胞坏死性凋亡。有趣的是,Ir7和Ir8还通过下调细胞周期蛋白依赖性激酶(CDK1、CDK2、CDK4与CDK6)和细胞周期蛋白(A2与D2),阻滞细胞周期停留于G0/G1期,展现多途径的抗肿瘤能力。体外抗肿瘤活性筛选实验结果表明,Ir7和Ir8展现出良好的克服肿瘤耐药能力。
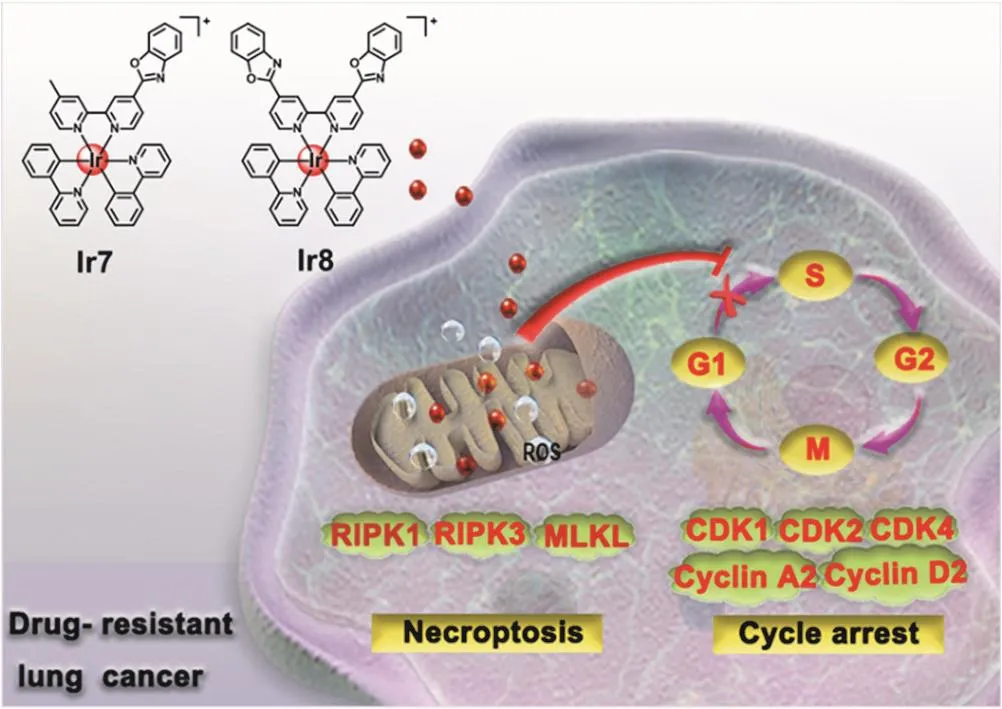
图6 线粒体靶向Ir7和Ir8多途径克服肿瘤耐药机理示意图[23]
3.4 其他
除上述工作之外,中山大学巢晖等还利用铱(III)配合物丰富的光物理性能和长寿命,制备了系列线粒体靶向光敏剂用于克服肿瘤耐药[24];针对实体肿瘤乏氧微环境,通过引入具有可逆氧化还原性质的蒽醌基团,构筑线粒体靶向、肿瘤微环境激活的铱(III)-蒽醌配合物,实现高选择性地杀伤肿瘤耐药细胞[25]。通过利用线粒体靶向铱(III)配合物与纳米材料有机杂合,发展系列无机纳米杂合材料实现高抗肿瘤活性[26]。由于篇幅限制,在此仅列出参考文献,供有兴趣的读者查阅。
4 结语
肿瘤的耐药性仍然是实现癌症患者治愈的主要限制因素。近些年,针对铂类化疗药物的缺陷,特别是针对其耐药机制,巢晖等尝试以非铂类金属配合物为构建单元,通过结构裁剪调控配合物生物活性及细胞器靶向性,成功开发了系列线粒体靶向的铱(III)基抗肿瘤试剂。在作用机制方面,通过改变作用靶点规避细胞核DNA损伤修复机制、通过诱导非凋亡性死亡途径规避凋亡抗性机制,同时结合化疗、光动力治疗、光热治疗、声动力治疗等实现多模式、多途径克服肿瘤耐药。相关工作以表格形式进行了总结(表1)。但是,目前这一领域的研究尚处于起步阶段,仍有大量科学问题待解决。金属配合物结构与其克服肿瘤耐药之间的关系尚不明确,特别是金属配合物抗肿瘤的作用靶标、作用途径以及作用机制的研究仍是具有挑战性的前沿科学问题,还有待于化学、生物、医学等多学科科研人员进行交叉的深入探索。我们也希望通过这篇介绍,能够让学生、教师等读者更好地理解了肿瘤耐药性治疗领域,同时为相关科研工作者提供了设计研究思路,为实现耐药肿瘤治疗、全面推进健康中国建设贡献力量。
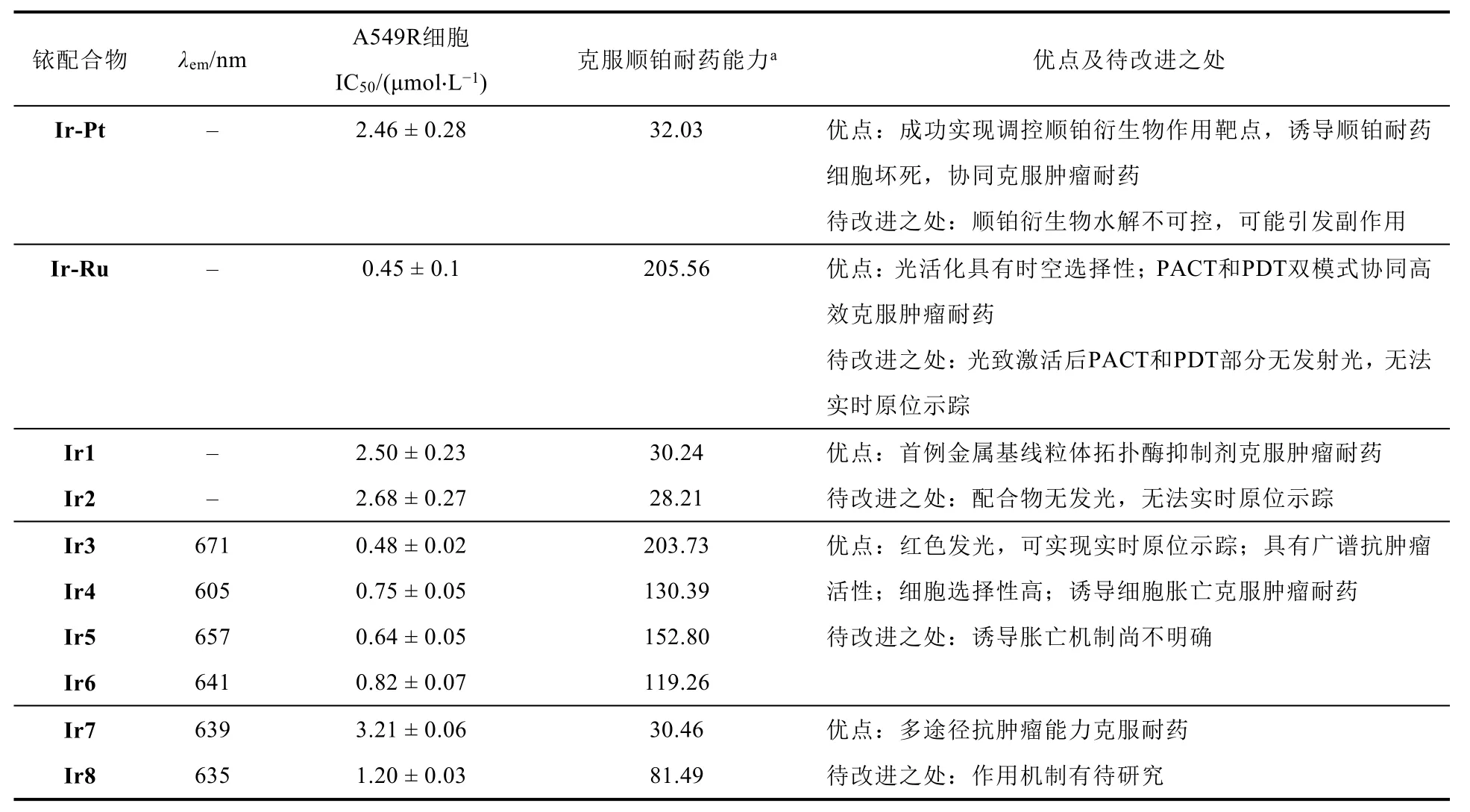
表1 线粒体靶向Ir配合物主要性质及优缺点
