宫颈癌术后预后分析及列线图建立
2022-05-12冯逸凡伍曙薇李雨洋
冯逸凡, 伍曙薇, 李雨洋, 李 敏
宫颈癌是女性恶性肿瘤发病率排名第四的癌症,仅次于乳腺癌、结直肠癌及肺癌,同时也是最常见的女性生殖系统恶性肿瘤[1]。据统计,2018年全球新增病例570 000例,死亡311 000例[2]。尽管人乳头瘤病毒(HPV,human papillomavirus)疫苗的问世可有效阻断宫颈疾病的发生及进展,但在部分国家,宫颈癌的发病率还在缓慢上升[3]。我国近些年来宫颈癌的发病率和死亡率还在逐年升高,尤其在年轻女性中[3]。剧统计,2015年我国宫颈癌发病人数共计约11万,死亡病例高达3万[4]。这可能与HPV疫苗较高的经济负担及低普及性有关。国际妇产科协会(FIGO)分期系统是目前最常用的基于临床检查制定的分期系统[5]。但是,FIGO 并不涉及年龄、病理参数及治疗等。该研究旨在探讨宫颈癌预后高危因素,并建立列线图以预测宫颈癌患者的生存情况。
1 材料与方法
1.1 病例的来源与选择标准收集2010年1月至2020年7月在安徽医科大学第一附属医院住院宫颈癌患者的资料。纳入标准:① 术后病理证实宫颈癌;② 年龄、病理特征(组织学类型、浸润深度、细胞分化、颈管累及、脉管浸润、分期)及放化疗资料完整;③ 所有患者均行全子宫切除及盆腔淋巴结清扫术式。排除标准:① 合并其他肿瘤病史;② 术前行辅助治疗。
1.2 分组方法年龄以50岁为界限,≥50岁为一组,<50岁为一组;颈管累及、脉管浸润各分成两组,包括阳性组和阴性组;组织学类型包括鳞癌、腺癌及其他类型;细胞分化程度以低分化为一组,中/高分化为一组;肿块<4 cm为一组,≥4 cm为一组;宫颈间质浸润深度则以浸润深度<1/2全层为一组,≥1/2全层为一组;分期包括Ⅰ期、Ⅱ期、Ⅲ C1期;放疗包括放疗组和无放疗组;化疗组包括化疗组和无化疗组。
1.3 随访本研究针对纳入研究的患者进行随访,随访方式包括门诊随访、电话回访等,记录患者的生存状态(是否存活)。对每个病例的随访开始日期即确诊日期,截至日期至2020年12月31日,失访患者不纳入本次研究。
1.4 统计学处理分类变量采用频数和百分比计数。分类变量的组间比较使用χ2检验。采用Log-rank检验对病例的总生存(overall survival, OS)进行单因素分析并绘制生存曲线。再采用COX比例风险模型进行多因素预后分析。基于多因素结果建立列线图。通过一致性指数(C指数)和受试者工作特征曲线(receiver operating characteristic curve, ROC)及受试者工作特征曲线下面积(area under curve, AUC)来评估列线图预测生存性能。C指数的最大值为1.0,表示模型是完美的,而0.5表示模型正确预测结果的概率是随机的,即C指数越接近1.0,模型的预测能力越高。AUC值为0.5表示列线图无预测作用,AUC值为1表示列线图可以完全区分不同生存率的患者。AUC数值在0.5 ~ 1之间越高,列线图的分辨率越高。此外,使用1年、3年和5年OS的列线图校准曲线来评估预测生存期和观察生存期之间的一致性,当校正曲线应用于完全校正的模型时,将落在图的45°对角线上。所有的统计分析及做图均使用Graphpad Prism 8.0 和 R version 3.6.2 (http://www.R-project ct.org/)。以P<0.05为检验标准。
2 结果
2.1 随访结果及患者参数本研究共随访到456例患者结局,失访57例,失访率11.00%。456例患者中年龄最小22岁,最大74岁,其中以年龄<50岁病例为主,共281例。组织学类型中,鳞癌占比最大(83.33%)。浸润深度多超过1/2全层、组织分化以中/高分化为主、肿块大小以<4 cm占比较多。颈管累及和淋巴脉管间隙浸润的病例数相对较少,分别占比8.55%及35.09%。Ⅰ期、Ⅱ期、Ⅲ C1期患者分别有341、27、88例。治疗方式中,多数患者接受了放疗(65.57%)及化疗(54.39%)。见表1。
2.2 宫颈癌患者预后因素分析单因素分析结果如表1所示,组织学类型、浸润深度、细胞分化、肿块大小、分期、放疗均为宫颈癌患者的总生存的相关因素,生存曲线见图1。经COX比例风险模型多因素分析结果显示,腺癌、低分化、肿块大小≥4 cm、高分期、无放疗均为宫颈癌总生存的独立危险因素。见表2。
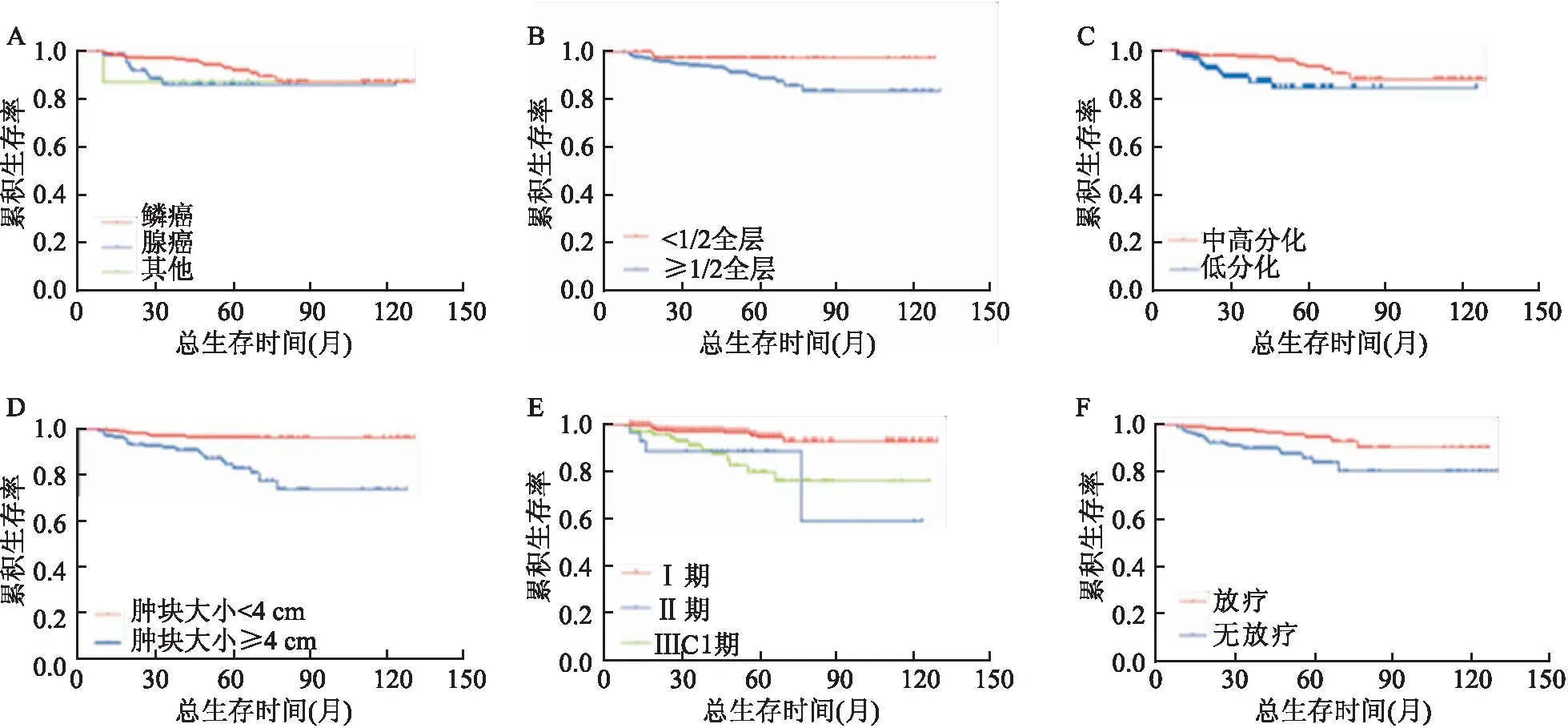
图1 宫颈癌患者Kaplan-Meier生存曲线A:组织学类型;B:浸润深度;C:细胞分化;D:肿块大小;E:分期;F:放疗
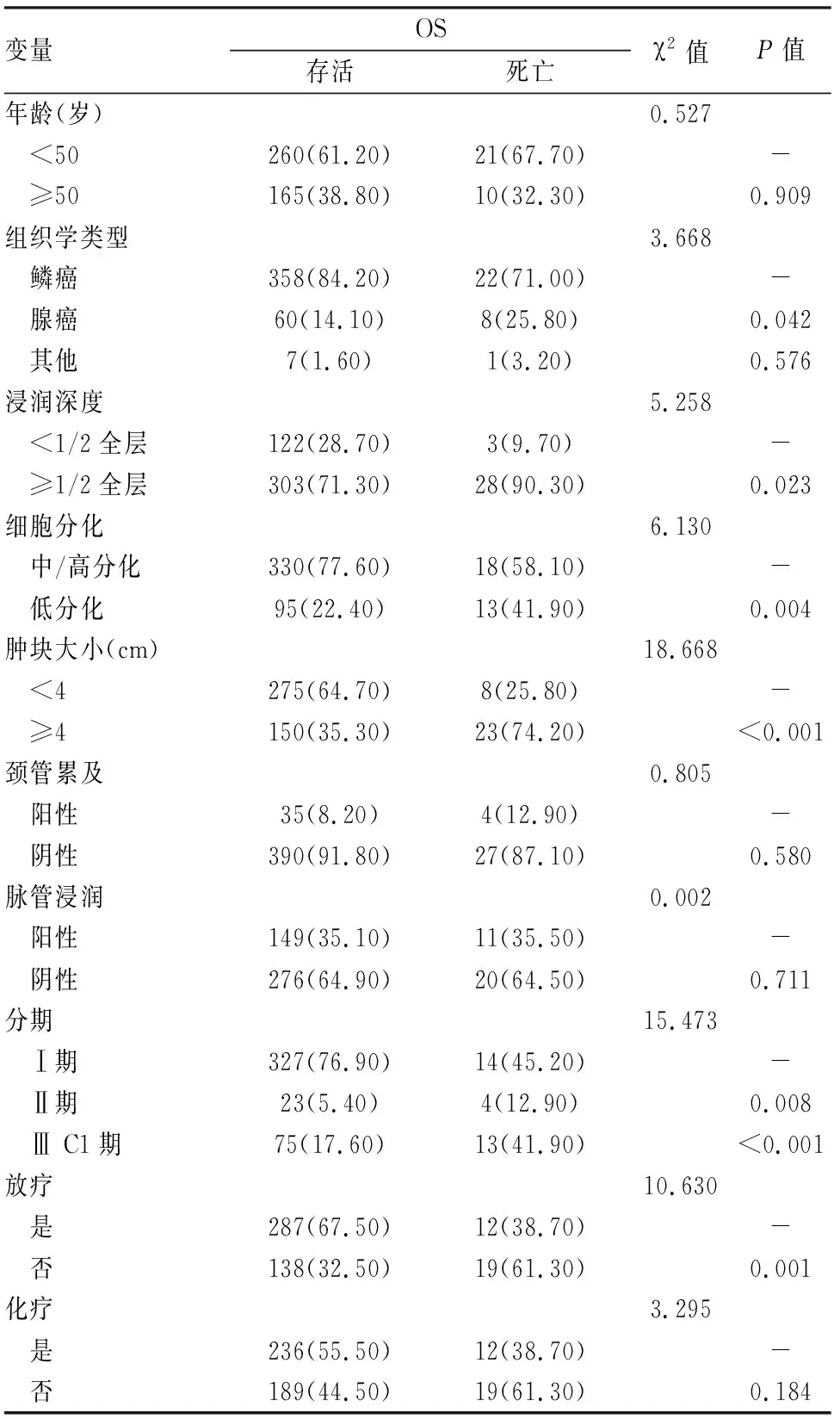
表1 宫颈癌各参数分布及预后单因素分析结果[n (%)]
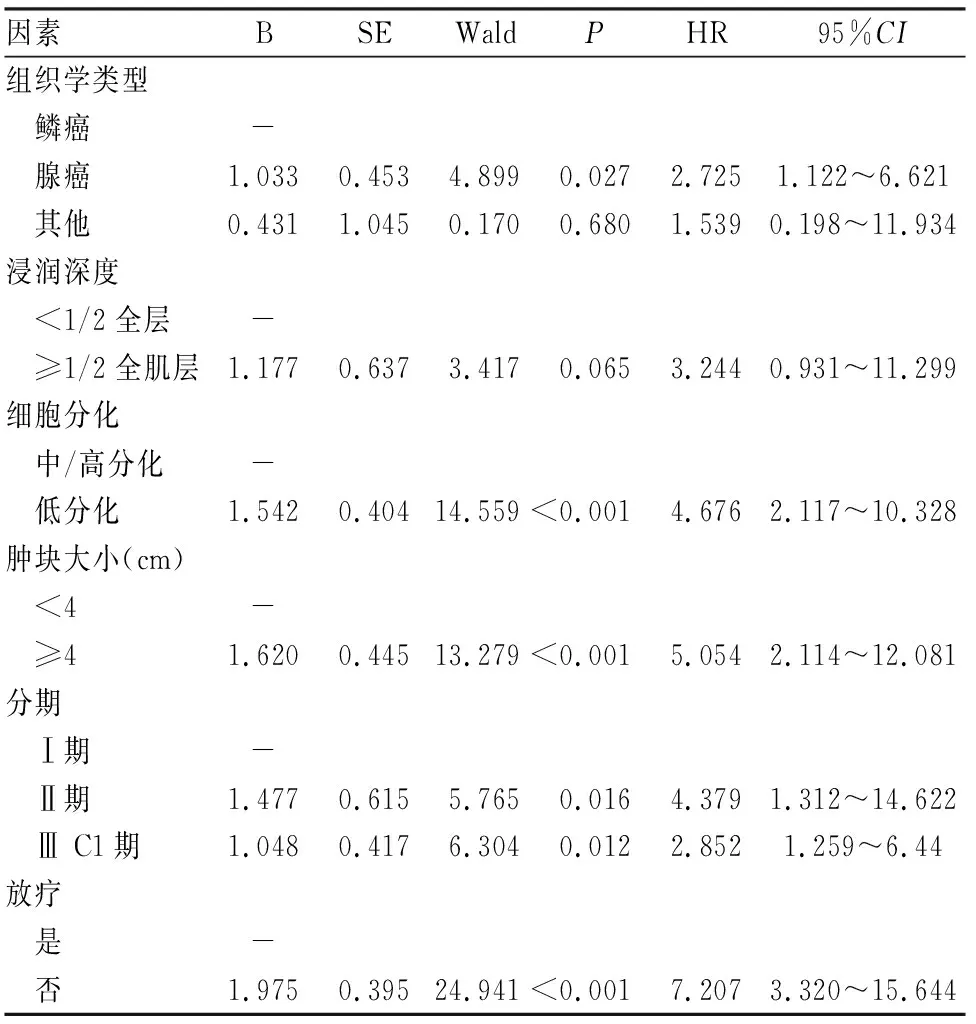
表2 子宫颈癌预后多因素分析
2.3 宫颈癌总生存列线图如图2所示,基于COX比例风险模型多因素分析结果,纳入放疗、分期、细胞分化、肿块大小、组织学类型5个危险因素建立宫颈癌总生存列线图。放疗对列线图的贡献最大,其次为肿块大小、分期、细胞分化和组织学类型。宫颈癌总生存列线图C指数为0.83。此外,图3显示预后模型1、3、5年校准曲线与实际观测结果拟合性较好,平均误差分别为0.011、0.021、0.040。ROC曲线见图3,预后模型的1、3、5年的AUC值分别为0.836(95%CI:0.688~0.987)、0.847(95%CI:0.772~0.929)、0.824(95%CI:0.720~0.912),均超过0.8,进一步确认了模型的可靠性。
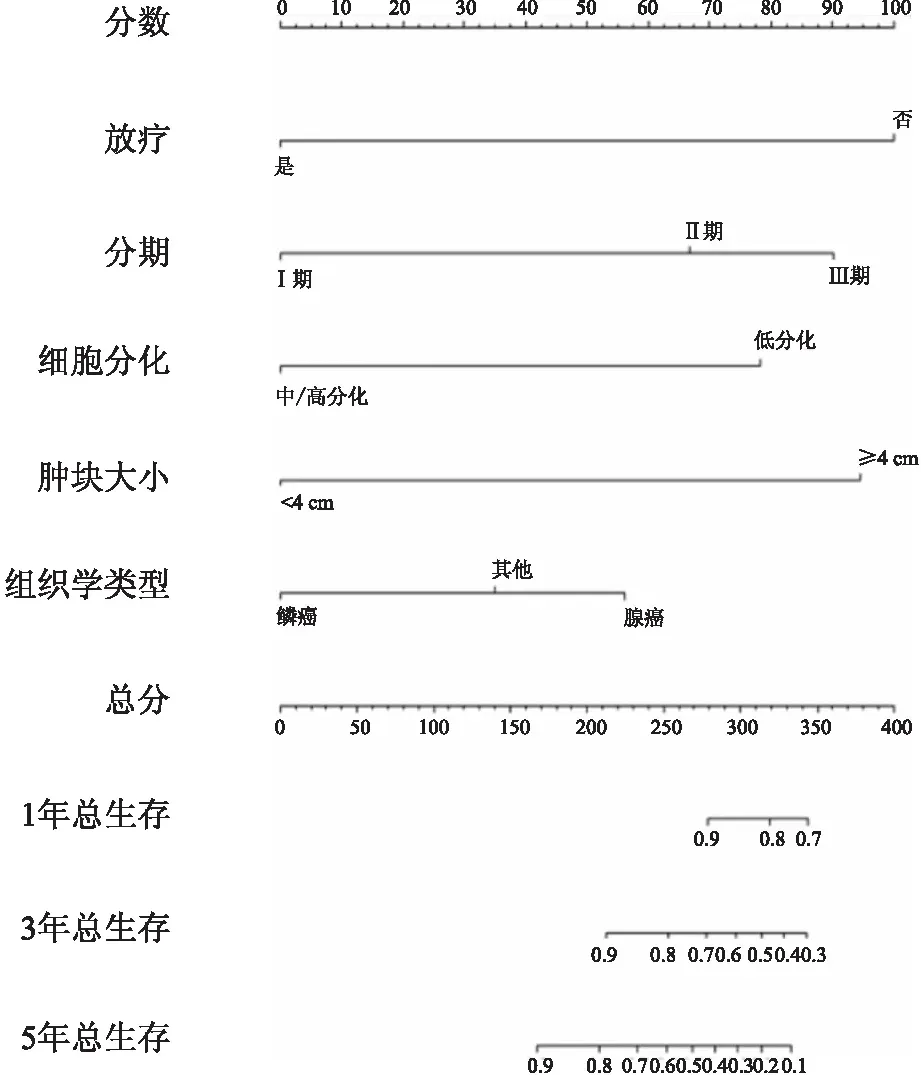
图2 宫颈癌总生存预后列线图
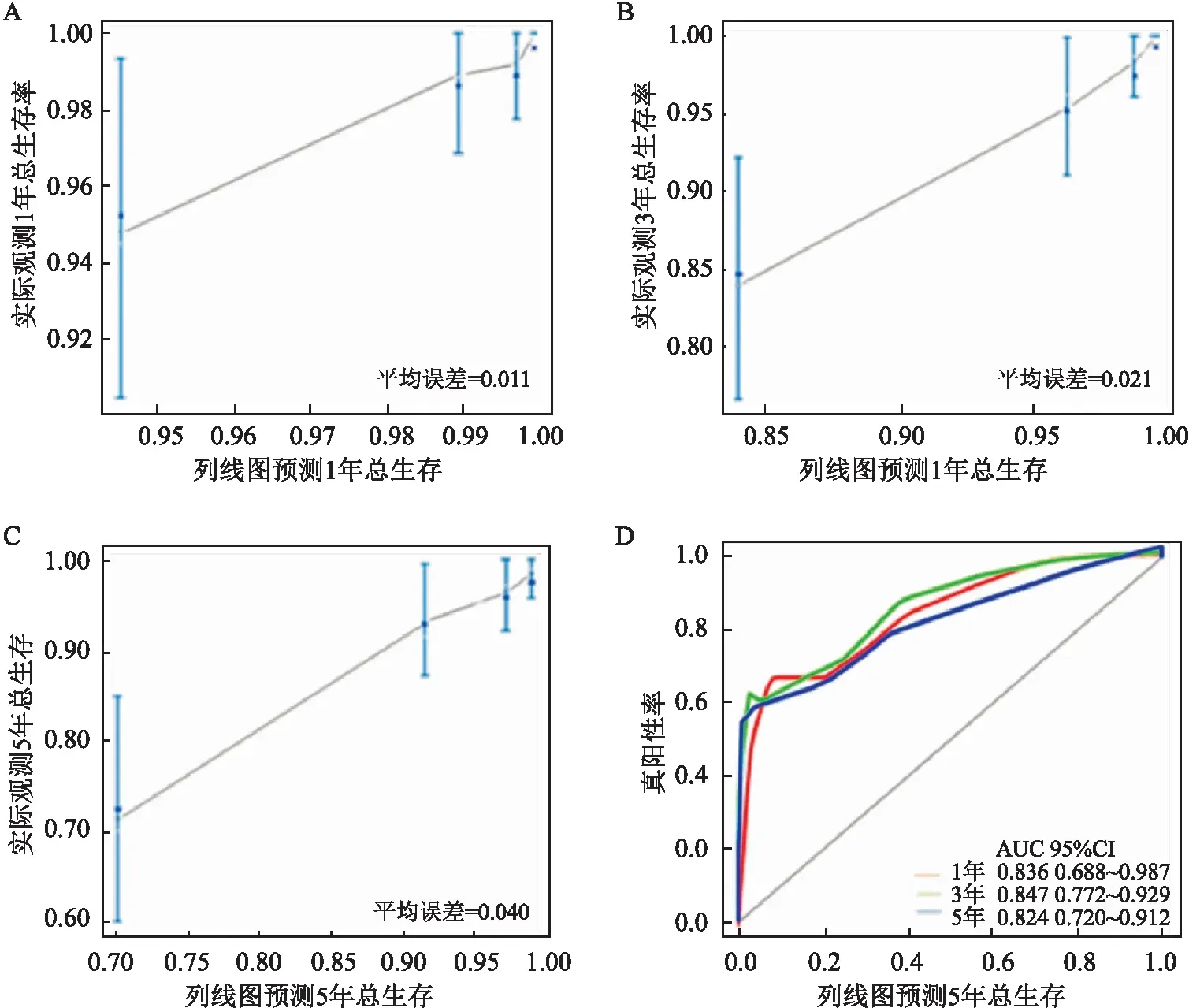
图3 列线图校准曲线及ROC曲线A:列线图1年总生存校准曲线;B:列线图3年总生存校准曲线;C:列线图5年总生存校准曲线;D:列线图1、3、5年总生存ROC曲线
3 讨论
在宫颈癌中,腺癌发病率与鳞癌发病率相比较低,但近些年,腺癌的发病率在中国呈逐渐上升的趋势[6-7]。目前关于腺癌患者与鳞癌患者生存结局存在差异仍有争议,尽管多数学者认为腺癌患者的预后较差,但也有研究[8]表明腺癌与鳞癌患者的生存结局无明显差异。尽管本研究结果已初步表明腺癌患者的死亡风险为鳞癌患者的2.725倍。但值得注意的是,本研究对象仅包括Ⅰ期、Ⅱ期及盆腔淋巴结转移的Ⅲ C1期,这导致结果可能存在一定的局限性。一项大规模的回顾性分析研究显示,局部转移的宫颈癌腺癌患者预后较差,而在远处转移的宫颈癌患者中鳞癌与腺癌未发现显著的生存差异[9]。所以笔者认为,早期宫颈癌患者腺癌预后更差,而这与手术、放疗及化疗等人工干预方式及卵巢转移、血管侵犯等危险因素有关[9]。但在ⅢA、ⅢB及Ⅳ期宫颈癌患者中,腺癌与鳞癌的预后是否存在差异仍值得关注。
目前,FIGO分期是评价宫颈癌预后的金标准。但FIGO分期在应用过程中也存在一定的局限性,一是FIGO分期依据解剖学上的进展将患者纳入分期中,对于年龄、种族等人口流行病学因素及人工干预如手术、放化疗等资料均无涉及,导致其预测不够准确。2018年,宫颈癌FIGO分期将盆腔或腹主动脉旁淋巴结转移的患者归类为ⅢC1/2期[5]。本研究中多因素分析结果显示ⅢC1期患者的死亡风险是Ⅰ期患者的2.852倍,但相比于Ⅱ期患者与Ⅰ期患者的HR值(4.379),ⅢC1期患者未体现出更差的预后。因此,当考虑到手术、放疗等因素后,淋巴结转移的预后是否较Ⅰ期及Ⅱ期患者更差有待进一步研究。二是具有相同解剖扩散但生存结局不同的患者被纳入同一分期,导致同一分期的患者生存结局存在异质性,即FIGO分期不具备精准的个体化预测能力[10]。
近年来,利用列线图建立癌症预测模型得到了广泛的接受,因为列线图可将大量复杂的因素简化成简单的数字预测模型来预测事件发生的可能性并且能较好地预测不同个体间的生存差异[11]。例如使用列线图预测结肠癌患者的生存结局或是预测直肠癌患者术后发生吻合口瘘的风险等[12-13]。在本研究中,组织学类型、分化程度、肿块大小、分期、放疗均为宫颈癌总生存的独立预测因素并被纳入列线图的建立。有研究者认为列线图的C指数在0.65~0.75之间是可接受的[14],而本研究列线图的C指数明显高于这个区间,这表明本研究的列线图的预测能力较高。此外,通过校准曲线可判断列线图是否存在预测失误或过度拟合,当曲线与45°线有较好的拟合时,则认为预测模型具有较好的校准能力[15]。而本研究的列线图的校准曲线与45°线的有较好的拟合性并且较高的AUC值反映出模型较好的预测精准性。
综上所述,基于多因素分析结果得到的5个宫颈癌预后因素,包括组织学类型、细胞分化、肿块大小、分期、放疗。并基于多因素分析结果建立了具有较好的预测能力及预测精准性的列线图。宫颈癌预后总生存列线图的建立有助于妇科肿瘤医师对患者预后作出更准确的评估,并指导临床个体化治疗。
