褪黑素对控制性超排卵周期中体外成熟卵母细胞受精后所获胚胎发育的影响
2022-05-12王凯娟张学森刘婷婷曹云霞章志国
朱 琦,丁 丁,王凯娟,霍 然,张学森,刘婷婷,曹云霞,章志国
与体外受精(invitrofertilization,IVF)相比,体外成熟(invitromaturation,IVM)治疗妊娠率相对较低,主要是因为获得的优质胚胎数目较少。胚胎在体外培养过程中不可避免地处于一个相对高氧的环境,导致胚胎产生大量的活性氧(reactive oxygen species,ROS),高水平的ROS会造成氧化应激进而引起细胞损伤、线粒体功能障碍、胚胎发育阻断和凋亡[1]。因此,在培养液中添加抗氧化剂是抑制氧化损伤并促进胚胎体外发育的重要途径之一。褪黑素(melatonin,MT)作为一种强力的抗氧化剂,有动物研究[2]证明在培养液中添加合适浓度的MT可提高绵羊的囊胚形成率。然而,在人类胚胎培养液中添加MT进行胚胎体外培养却鲜有报道,因此,该研究旨在探讨人类胚胎培养液中添加MT能否改善胚胎的发育结局。
1 材料与方法
1.1 研究对象及分组收集控制性超排卵(controlled ovarian hyperstimulation,COH)周期中,年龄在36岁以下患者的未成熟卵母细胞(germinal,GV或metaphase I,MI)行IVM培养,随后将体外成熟的卵母细胞(IVM-MII)随机分为MT组和非MT组,MT组的IVM-MII卵母细胞行单精子胞浆内注射(intracytoplasmic sperm injection,ICSI)后,置于添加了不同浓度(10-11、10-9、10-7、10-5mol/L)MT的分裂期胚胎培养液培养3 d,随后将分裂期胚胎转入与分裂期培养液所含MT浓度一致的囊胚期培养液中继续培养2~3 d,而非MT组卵母细胞ICSI后直接置于不含MT的胚胎培养液中培养,观察各阶段胚胎发育情况。各组患者的年龄、基础卵泡刺激素(follicle stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、雌激素(estradiol,E2)、身体质量指数(body mass index,BMI)、不孕年限和获卵数等相比较差异均无统计学意义,见表1。该研究已获得安徽医科大学伦理委员会批准(编号:2015013)。
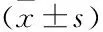
表1 患者基本临床资料
1.2 药物与试剂重组人卵泡刺激素(Serino Barueri,SP,Brazi),促性腺激素释放激素拮抗剂(Merck Serono SA-Geneva, Switzerland),人绒毛膜促性腺激素(AESCA Pharma,Austria),褪黑素(Sigma Chemical Co.St.Louis,MO,USA),胚胎培养液(Cook,Sydney,Australia),组织培养油(Vitrolife,Goteborg,Sweden),SurePlex DNA Amplification System试剂盒(New England Biolabs,USA)。
1.3 控制性超排卵方案所有入组患者均采用GnRH拮抗剂方案(灵活方案)进行超促排卵,即从月经周期第2~3天给予重组人卵泡刺激素(gonadotropins,Gn,Gonal F)进行超排卵,4~5 d后根据卵泡大小及激素水平调整Gn用量,当优势卵泡达到12~14 mm时添加促性腺激素释放激素拮抗剂(gonadotropin-releasing hormone antagonist,GnRH-A,Cetrotide)至注射人绒毛膜促性腺激素(human chorionic gonadotropin,HCG,Pregnyl)日。当卵巢上2~3个卵泡直径 ≥18 mm时,注射10 000 U HCG,在阴道超声指导下于36~38 h后完成取卵。
1.4 IVM培养收集COH周期的GV/MI卵母细胞,挑选形态正常的卵母细胞入已准备好且平衡过夜的IVM液培养,24 h后挑选IVM-MII卵母细胞行ICSI,随后进行受精及胚胎体外发育培养。IVM详细过程参考已发表文献[3]。
1.5 胚胎培养液的准备用无水乙醇将MT溶解并稀释至浓度为10-2mol/L(母液),将母液分装进EP管,每管约10~20 μl,置于-20 ℃保存;每次实验前1 d,取出一至多管母液复温后用胚胎培养液(卵裂期或囊胚期胚胎培养液)通过稀释倍数法将母液稀释至适当的MT浓度(10-11、10-9、10-7、10-5mol/L),充分混匀后分别将不同MT浓度的胚胎培养液在直径60 mm的培养皿中制备6~8滴液滴(30 μl/滴),并覆盖2 ml组织培养油。最后将培养皿移至37 ℃、6%CO2及饱和湿度条件下平衡18 h,备用。
1.6 胚胎体外培养IVM-MII卵母细胞行ICSI后,依次入分裂期及囊胚期培养液行5~6 d的胚胎体外培养,最后收集优质囊胚。ICSI授精、胚胎体外培养、发育观察及胚胎评估等详细过程参考已发表文献[4]。
1.7 胚胎冷冻及复苏应用玻璃化法冷冻和复苏所获得的优质囊胚,并于-196 ℃液氮中保存半年,随后解冻,复苏后的胚胎应用array CGH技术检测其非整倍体的发生情况。胚胎冻融的详细操作过程参考已发表文献[5]。
1.8 Array CGH检测应用SurePlex DNA Amplification System试剂盒对复苏后的胚胎进行全基因组扩增,然后通过array CGH方法(BlueGnome 24SureV3 packagekit)对扩增后的产物进行检测,最后通过PGXCloud系统PGS/gDNA分析软件2.0分析并出具报告。

2 结果
2.1 MT对IVM-MII卵母细胞受精及受精后所获胚胎发育的影响该研究共收集721枚人GV/MI卵母细胞行IVM培养,获得IVM-MII卵母细胞589枚。如表2所示:589枚IVM-MII卵母细胞行ICSI受精和胚胎培养,共获得囊胚125枚,其中优质囊胚53枚,见图1,47枚发育自MT组,6枚发育自非MT组。10-9mol/L组的囊胚率分别与10-11、10-7、10-5、0 mol/L组相比,差异均有统计学意义(P<0.05,P<0.01,P<0.0001,P<0.01);10-9mol/L组的优质囊胚率分别与10-5mol/L和0 mol/L组相比,差异均有统计学意义(P<0.01,P<0.05)。以上结果表明胚胎培养液中添加10-9mol/L MT能明显改善人卵母细胞ICSI后受精及受精后所获胚胎的体外发育结果,且10-9mol/L是最佳的作用浓度。
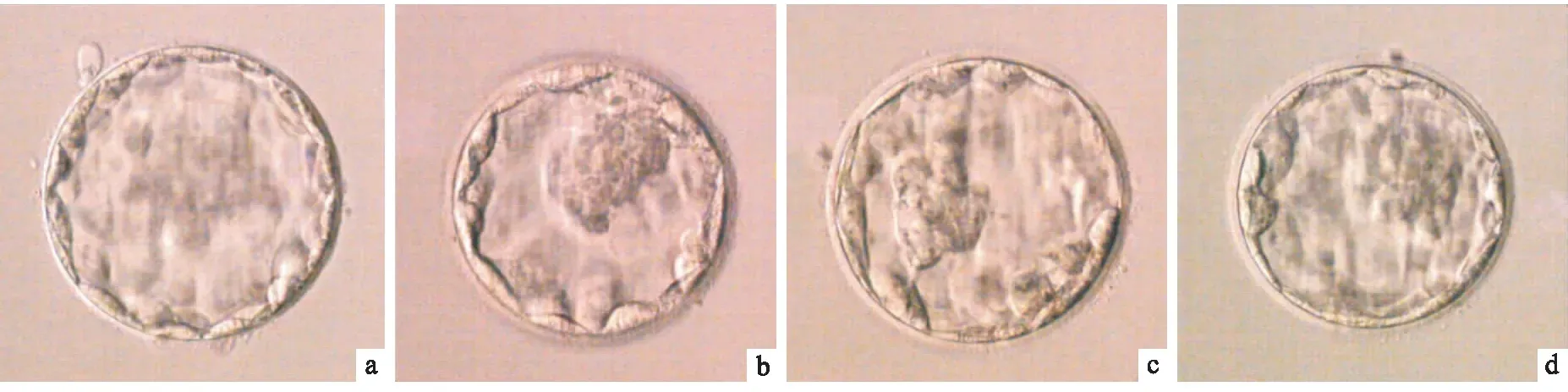
图1 优质囊胚代表图 ×500a: 4AA; b: 4AB; c: 4AB; d: 4AB

表2 添加不同浓度MT对胚胎体外发育的影响
2.2 MT对源于GV/MI期的IVM-MII卵母细胞受精及受精后所获胚胎发育的影响共589枚IVM-MII卵母细胞,其中295枚源于GV期卵母细胞(GV-IVM-MII),294枚源自MI期卵母细胞(MI-IVM-MII)。
2.2.1MT对GV-IVM-MII卵母细胞受精及受精后所获胚胎发育的影响 如表3所示:295枚GV-IVM-MII卵母细胞行ICSI授精和胚胎体外培养,共获得囊胚71枚,其中优质囊胚32枚。10-9mol/L组的囊胚率分别与10-11、10-7、10-5mol/L组相比,差异统计学有统计学意义(P<0.05,P<0.05,P<0.01),优质囊胚率方面,10-9mol/L组均高于其他组,但差异无统计学意义。

表3 MT对GV-IVM-MII卵母细胞受精及受精后所获胚胎发育的影响
2.2.2MT对MI-IVM-MII卵母细胞受精及受精后所获胚胎发育的影响 如表4所示:294枚MI-IVM-MII卵母细胞行体外授精和胚胎体外培养,共获得囊胚54枚,其中优质囊胚21枚。受精率、卵裂率、囊胚率和优质囊胚率方面:10-9mol/L组的受精率和卵裂率均高于其他组,但差异无统计学意义;10-9mol/L组的囊胚率分别与10-7、10-5和0 mol/L组相比,差异有统计学意义(P<0.05,P<0.01,P<0.05);10-9mol/L组的优质囊胚率均高于其他组,但差异无统计学意义。

表4 MT对MI-IVM-MII卵母细胞受精及受精后胚胎发育的影响
2.3 Array CGH检测结果该研究共获得并冻存优质囊胚53枚,随后共复苏40枚优质囊胚用于array CGH检测,其中非MT组(0 mol/L)6枚胚胎接受检测,而MT组共34枚(10-11mol/L:n=7;10-9mol/L:n=16;10-7mol/L:n=8;10-5mol/L:n=3)。非MT组有2枚胚胎被诊断为非整倍体(整条染色体水平和片段水平的缺失),其余4枚胚胎正常;MT组中,共6枚胚胎被诊断为非整倍体(整条染色体水平和片段水平的缺失、重复和嵌合),其余28枚胚胎正常。结果表明MT组的非整倍体发生率(17.6%)低于非MT组(33.3%),但两者之间差异无统计学意义。Array CGH结果代表图如图2所示。
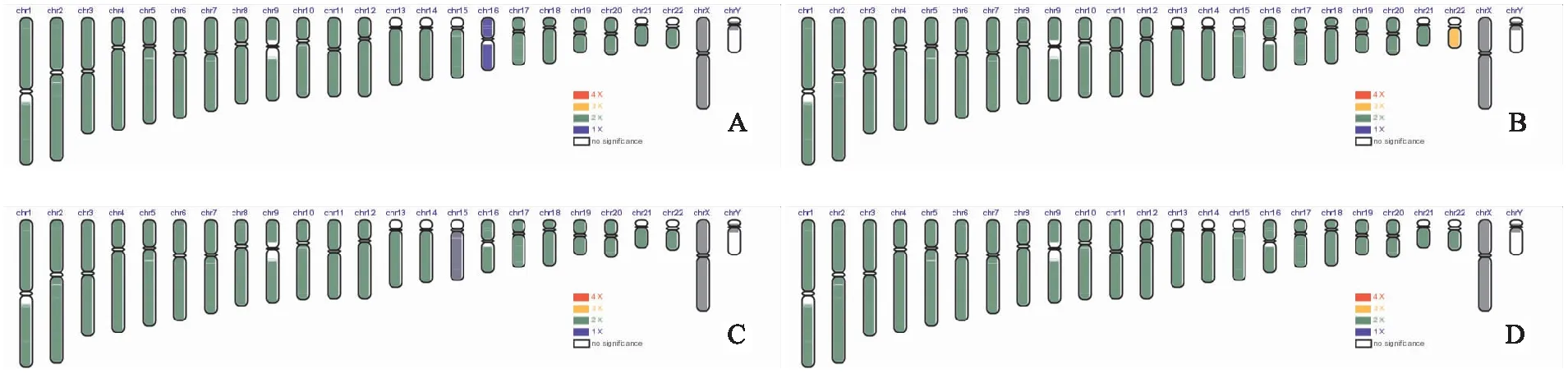
图2 优质囊胚CGH结果代表图A:整条染色体水平缺失;B:整条染色体水平重复;C:整条染色体30%以下嵌合;D:整倍体平衡囊胚代表图
3 讨论
人类辅助生殖技术(assisted reproduction technology, ART)中的受精和胚胎培养方案与过去相比有了很大改进,然而ART得到的胚胎只有少数可以足月发育,主要原因是体外培养难以完全模拟胚胎体内生长的动态环境。研究[6]表明氧化应激对胚胎发育起着抑制作用。体内生长的胚胎会受到体内抗氧化物质如谷胱甘肽等的保护而免受氧化应激,而在体外培养的胚胎不可避免地处于一个相对高氧的环境,会因为抗氧化防御系统失衡而导致严重的氧化应激损伤,使胚胎在发育过程中产生大量的ROS[7],最终严重降低胚胎的体外发育潜能。MT作为调节体内生理周期的内源性物质,能够对抗氧化应激,直接清除ROS等自由基,具有很强的抗氧化作用[8]。因此该研究通过在胚胎培养液中添加不同浓度的MT,观察MT的处理对胚胎体外发育的影响。
动物研究[9]显示,在胚胎培养液中添加MT能改善胚胎的体外发育结果,同时也证实这种改善作用存在浓度相关性。另有研究证明MT可降低卵母细胞中ROS水平,并对小鼠[10]、牛[11]和猪[12]的体外胚胎培养起到促进作用。2020年,Zou et al[6]发现在人IVM液中添加MT可以通过促进线粒体功能,抑制氧化应激损伤进而改善人未成熟卵子的IVM结果,并且证实10-5mol/L是最佳的作用浓度。基于以往的研究结论可以推测:在人类胚胎的培养液中添加MT也可以改善胚胎的体外发育结果,并且其作用效果也存在浓度相关性。因此,本研究收集了COH周期的人未成熟卵母细胞进行IVM培养,以获得IVM-MII卵母细胞并对其进行ICSI授精,接着用含0、10-11、10-9、10-7、10-5mol/L MT的培养液对受精卵进行体外培养,随后对各组的受精及胚胎的早期发育状况进行系统地比较分析。结果显示:若不考虑卵母细胞未成熟阶段,10-9mol/L组的囊胚率优于10-11、10-7、10-5、0 mol/L组(P<0.05,P<0.01,P<0.000 1,P<0.01);优质囊胚率也均高于其他组,但仅与10-5和0 mol/L组比较差异有统计学意义(P<0.01,P<0.05)。以上研究结果表明:10-9mol/L MT的应用可以显著改善人类胚胎的体外发育结果,提高优质囊胚的形成。随后,研究组将未成熟卵母细胞按发育阶段进一步分为GV组和MI组,发现MI组的成熟率高于GV亚组(90.7%vs83.2%,P<0.01),而GV组的受精率高于MI组(88.4%vs74.9%,P<0.000 1);卵裂率、囊胚率和优质囊胚率方面,GV组均高于MI亚组,但差异无统计学意义。高明 等[4]研究发现:GV期卵母细胞的成熟率低于MI期;受精率和卵裂率方面两者相当;囊胚和优胚率方面,GV期高于MI期,但组间差异无统计学意义。Ouandaogo et al[13]研究显示GV期卵母细胞的受精率高于MI期卵母细胞。这些结果与本研究相一致,均提示了GV期卵母细胞来源的胚胎发育潜能可能高于MI期。
IVF过程中,染色体异常是导致胚胎发育失败的关键因素,而非整倍体的发生率(3.1%~57%)是导致流产的主要危险因素,尽管胚胎表现为正常的形态[14-15]。本研究array CGH结果显示:MT组优质囊胚中的非整倍体发生率(17.6%,6/34)低于非MT组(33.3%,2/6),表明在胚胎培养基中补充10-9mol/L MT是有效的。
IVF/ICSI作为ART的重要组成部分,越来越受到人们的关注,任何影响卵母细胞质量的因素都会影响其受精及后续胚胎的发育。本研究探究了不同浓度MT对COH周期中IVM-MII卵母细胞胚胎发育的影响。结果表明人类胚胎培养液中添加MT可以促进胚胎的体外发育,这种促进作用存在浓度相关性,10-9mol/L是最佳的作用浓度。这一结论为改善胚胎体外发育结果提供了一种新的策略,具有重要的临床应用价值。
