灯盏花素通过调节Nrf2途径抑制大鼠颅内动脉瘤的形成和机制
2022-05-12艾奇渊徐瑞春李劲松
艾奇渊,王 勇,徐瑞春,彭 臻,李劲松
颅内动脉瘤(intracranial aneurysm,IA)破裂是蛛网膜下腔出血的主要原因,通常会导致神经功能衰竭或死亡。显微外科手术和血管内干预在治疗IA方面取得了重大进展,但发病率和死亡率仍然很高[1]。IA发病机制包括IA相关的氧化应激、炎症和血管肌细胞功能障碍[2]。因此,缓解炎症和氧化应激的策略对于IA的治疗是迫切需要的。灯盏花素(breviscapine,Bre)是从灯盏花中提取的一种黄酮类化合物,其基本活性成分是黄酮。它可以扩张血管,降低血液粘度和改善微循环,并作为氧自由基的清道夫[3]。此外,Bre在治疗心血管和中枢神经系统疾病方面显示出积极的效果[4-5]。Li et al[6]研究发现Bre通过其抗炎和抗氧化作用减轻短暂性脑缺血/再灌注引起的认知障碍。Li et al[7]研究表明Bre在创伤性脑损伤后通过调节核因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)信号通路提供神经保护作用。但Bre在颅内动脉瘤中的药理作用知之甚少。该研究通过建立IA大鼠模型和过氧化氢(H2O2)诱导血管平滑肌细胞(vascular smooth muscle cell,VSMC)氧化损伤模型,探究Bre对IA形成及对Nrf2途径的影响。
1 材料与方法
1.1 试剂和仪器灯盏花素(breviscapine,Bre,纯度>98%)(美国Sigma-Aldrich公司);苏木精伊红(HE)染色试剂盒(货号C0105)、比辛酸(BCA)蛋白浓度测定试剂盒(货号P0012)、ECL发光液(货号P0018S)、RIPA裂解缓冲液(货号P0013B)和活性氧检测试剂盒(货号S0033S)(碧云天生物公司);TRIzol试剂、NE-PER核和细胞质提取试剂(美国Thermo Scientific公司);One Step PrimeScriptTMⅢ RT-qPCR Mix(大连宝生物工程有限公司);兔来源一抗Nrf-2 (ab137550)、平滑肌22α(smooth muscle 22α,SM22α)(ab14106)、Lamin B1(ab16048)、基质金属蛋白酶(matrix metalloproteinase,MMP)-2(ab92536)、MMP-9(ab76003)、辣根过氧化物酶(HRP)标记的山羊抗兔IgG(ab205718)和山羊抗兔 IgG H&L (Alexa Fluor® 488)(ab150077)、源一抗β-肌动蛋白(β-actin)(ab8226)、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)(ab7817)、山羊抗小鼠 IgG H&L(Alexa Fluor® 647)(ab150115)、兔抗小鼠 IgG H&L (HRP)(ab6728)(英国Abcam公司);白细胞介素1β(IL-1β)、IL-6、单核细胞趋化蛋白1(monocyte chemoattractant protein 1,MCP-1)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(南京建成生物工程研究所);ML385(Nrf2抑制剂)(美国MCE公司);Annexin V/碘化丙啶(PI)(美国Invitrogen公司)。Gel Doc XR+凝胶成像系统(美国伯乐公司),RX51光学显微镜(日本Olympus公司),多功能紫外酶标仪(美国 Bio-Rad 公司),高速离心机(德国 Eppendorf 公司),荧光显微镜(德国徕卡),CytoFLEX流式细胞仪(美国Beckman Coulter公司)。
1.2 动物建模和给药SPF级雄性 SD 大鼠 50只,6~8周龄,体质量200~250 g,购自贵州医科大学实验动物中心。动物饲养在温度25 ℃左右、湿度50%左右,12/12 h光-暗环境中,实验前适应性喂养1周。将大鼠随机分为3组(n=15):假手术组、模型组、Bre组,Bre剂量(50 mg/kg)根据Li et al[7]研究确定。
造模方法[8]及给药:用3%戊巴比妥钠腹腔注射麻醉大鼠后,结扎大鼠的右颈总动脉,并将10 μl的10 U/ml弹性蛋白酶立体定向注入基底池,立即施用血管紧张素Ⅱ以诱导全身高血压,假手术组大鼠立体定向注射相等体积的生理盐水。Bre组以50 mg/kg的剂量腹腔注射给药,假手术组和模型组腹腔注射等体积生理盐水,持续3周,采用袖带法测量大鼠尾部收缩压。监测大鼠的存活3周,取大鼠颈总动脉分叉部取动脉瘤组织标本和正常动脉组织标本,检查IA的发病率和破裂。
1.3 免疫组化和HE染色将动脉瘤组织和正常动脉组织固定在10%中性甲醛溶液中24 h后,常规脱水、透明和石蜡包埋,并切成5 μm截面,置于聚赖氨酸涂覆的载玻片上,行HE染色。对于免疫组织化学分析,用一抗Nrf2(1 ∶200)4°C孵育过夜,PBS洗涤,DAB 显色5 min,PBS 洗3 次,显微镜下观察。
1.4 免疫荧光染色用SM22α(1 ∶400)和α-SMA(1 ∶200)一抗在4 ℃下孵育5 μm切片过夜,PBS洗涤3次,加入荧光标记的二抗(1 ∶1 000),室温孵育2 h,PBS洗涤3次,封片,荧光显微镜下观察。
1.5 分离培养大鼠VMSC和细胞分组向雄性SD大鼠(n=5)注射肌肉松弛剂和麻醉剂,处死后分离大鼠胸主动脉。去除组织的结缔外层,并使用微型镊子剥离外膜。用镊子轻轻刮擦血管的内表面,以除去内膜。然后,将中膜切成1 mm3的碎片,并均匀地铺在25 cm2的培养瓶中。将所得VMSC在含有10%胎牛血清(FBS)、100 U/ml青霉素和100 mg/ml链霉素的DMEM中培养,置于37 ℃、5%CO2的条件下。实验仅使用第4~6代的VSMC。用单克隆α-SMA抗体进行的免疫荧光染色用于VSMC的鉴定和表征。
1.6 细胞分组和处理本研究中用H2O20.5 mmol/L 处理VSMC 12 h,以诱导氧化损伤。VSMC分组情况如下:对照组、H2O2(0.5 mmol/L)组、H2O2+Bre(100 μmol/L)组、H2O2+Bre(100 μmol/L)+ ML385(Nrf2抑制剂)组。上述分组Bre(根据He et al[5]研究确定浓度)和ML385(5 mmol/L)分别预处理VSMC 24 h,然后用H2O20.5 mmol/L处理12 h,收获VSMC用于后续实验。
1.7 实时荧光定量PCR(qRT-PCR)检测谷氨酸-半胱氨酸催化亚基(glutamate-cysteine ligase catalytic subunit,GCLC)、NAD(P)H醌脱氢酶1[NAD(P)H quinone dehydrogenase 1,NQO-1]、超氧化物歧化酶1(superoxide dismutase 1,SOD1)、α-SMA、SM22α mRNA水平使用TRIzol试剂从VSMC或脑动脉中提取总RNA,然后反转录成cDNA,进行实时PCR,引物序列见表1。使用β-actin作为内参,使用2-ΔΔCt法计算相对mRNA水平。

表1 引物序列
1.8 核质分离按照1.6项分组处理细胞后,用胰蛋白酶消化收获VSMC,用PBS洗涤,并通过离心沉淀。根据制造商的说明,使用NE-PER核和细胞质提取试剂从细胞中制备核和细胞质提取物。蛋白质水平以相对于Lamin B1(核组分内参)或β-actin(质组分内参)的相对比值进行测量。
1.9 Western blot检测蛋白表达RIPA 裂解液提取VSMC中总蛋白,BCA测定总蛋白浓度。每孔上样量40 μg,用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离并电转至PVDF 膜,室温下用5%脱脂奶粉液封闭膜2 h,加入一抗Nrf2(1 ∶500)、Lamin B1(1 ∶1 000)、β-actin(1 ∶1 000)、α-SMA (1 ∶200)、SM22α (1 ∶250)、MMP-2(1 ∶1 000)、MMP-9(1 ∶1 000),4 ℃孵育过夜,加HRP标记的山羊抗兔IgG(1 ∶3 000)和兔抗小鼠 IgG(HRP)(1 ∶2 000),室温孵育2 h,洗膜,ECL发光显色,拍照。采用Image J 软件分析蛋白条带灰度值。
1.10 ELISA检测VSMC中细胞因子水平按照1.6项分组处理细胞后,1 062 r/min离心5 min,收集细胞上清液,按照试剂盒说明书操作,检测IL-1β、IL-6、MCP-1和TNF-α含量。
1.11 流式检测细胞凋亡按照1.6项分组处理细胞后,收集细胞,用PBS洗涤,再悬浮在100 ml结合缓冲液中。然后用Annexin V和PI在黑暗中孵育10 min,用流式细胞仪进行分析。
1.12 DCFH-DA荧光染色检测活性氧(reactive oxygen species,ROS)产生将细胞以1×105个/孔密度接种在6孔板中,按照1.6项分组处理细胞后,加入DCFH-DA荧光探针(1 ∶1 000),将细胞在37 ℃下孵育1 h。然后,用无血清DMEM洗涤VSMC 3次并悬浮在PBS中。在流式细胞仪488 nm(激发)和525 nm(发射)的波长下测量DCFH的荧光强度。
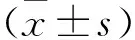
2 结果
2.1 灯盏花素可以防止大鼠模型中IA的形成和破裂在假手术组中,Nrf2表达主要在细胞质中,IA大鼠Nrf2表达下调且转移至细胞核中,Bre治疗后Nrf2在核内表达增多。HE结果显示,假手术组未发现动脉内膜、VSMC和外膜损伤,并且细胞排列整齐,结构完整。模型组大鼠内膜受损,VSMC数量和层数减少,动脉壁变薄,弹性纤维断裂和炎性细胞浸润。Bre治疗减轻IA大鼠的病理损伤和炎性细胞浸润程度,见图1A。与假手术组比较,模型组IA发生率(14vs0)升高(P<0.01),生存率降低,收缩压升高(P<0.01);与模型组相比,Bre组的IA发生率(12vs14)降低(P<0.01),见图1B,生存率改善(P<0.01),见图1C,收缩压降低(P<0.01),见图1D。
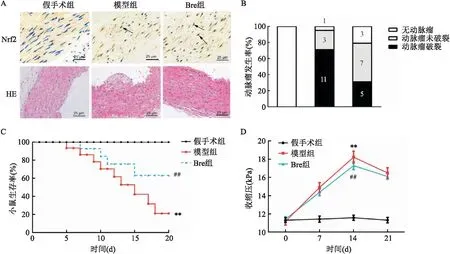
图1 灯盏花素可以防止大鼠模型中IA的形成和破裂A:Nrf2免疫组化和HE染色 ×400;B:颅内动脉瘤发生率;C;各组大鼠生存率;D;各组大鼠收缩压;与假手术组比较:**P<0.01;与模型组比较:##P<0.01
2.2 灯盏花素恢复IA大鼠中收缩相关基因的表达如图2所示,与假手术组比较,模型组脑动脉瘤中α-SMA和SM22α荧光密度降低(t=36.63,P<0.01;t=23.73,P<0.01),α-SMA和SM22α mRNA水平(t=23.90,P<0.01;t=23.70,P<0.01)和蛋白表达水平(t=34.08,P<0.01;t=31.52,P<0.05)均下调;与模型组比较,Bre预处理增加α-SMA和SM22α的荧光密度(t=25.36,P<0.01;t=23.63,P<0.01),上调α-SMA和SM22α mRNA水平(t=15.45,P<0.01;t=13.51,P<0.01)和蛋白表达水平(t=7.40,P<0.01;t=8.52,P<0.05)。
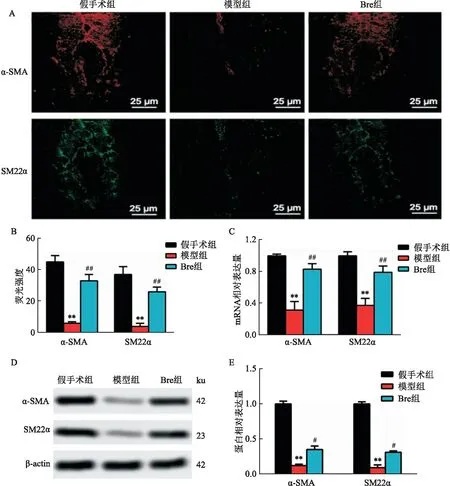
图2 灯盏花素对IA大鼠中收缩相关基因表达的影响A:免疫荧光染色检测α-SMA和SM22α表达 ×400;B:荧光强度统计;C:α-SMA和SM22α mRNA水平;D:Western blot检测α-SMA和SM22α蛋白表达;E:蛋白相对表达量;与假手术组比较:**P<0.01;与模型组比较:#P<0.05,##P<0.01
2.3 在H2O2诱导的VSMC中灯盏花素可激活Nrf2途径如图3所示,在H2O2处理后,VSMC中的核Nrf2表达上调(t=5.04,P<0.05),胞质Nrf2表达下调(t=5.71,P<0.01),Bre预处理VSMC上调核Nrf2表达(t=13.51,P<0.01),下调胞质Nrf2表达(t=6.28,P<0.01)。与假手术组比较,虽然模型组表现出SOD-1、GCLC和NQO1 mRNA水平的升高,但Bre组表现出更高的上调 (F=231.50,P<0.01;F=101.60,P<0.01;F=61.34,P<0.01)。
图3 灯盏花素对Nrf2途径的影响A:Western blot检测各组核Nrf2和胞质Nrf2的表达;B:核Nrf2蛋白相对表达量;C:胞质Nrf2蛋白相对表达量;D:SOD1转录水平;E:GCLC转录水平;F:NQO-1转录水平;与对照组比较:*P<0.05,**P<0.01;与 H2O2组比较:##P<0.01
2.4 灯盏花素通过Nrf2途径抑制H2O2诱导的VSMC表型切换和促炎细胞因子的产生如图4所示,H2O2处理下调VSMC中α-SMA和SM22α的表达(t=25.25,P<0.01;t=34.08,P<0.01),上调MMP-2和MMP-9的表达(t=24.58,P<0.01;t=20.75,P<0.01);Bre预处理组上调VSMC中α-SMA和SM22α的表达(t=11.28,P<0.01;t=13.80,P<0.01),下调MMP-2和MMP-9的表达(t=18.73,P<0.01;t=17.23,P<0.01);抑制Nrf2可逆转Bre的治疗作用。如表2所示,H2O2处理的VSMC中炎性因子含量增加,Bre预处理降低了H2O2诱导的高炎性因子水平;抑制Nrf2减弱了Bre的抗炎效果。
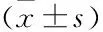
表2 ELISA法检测VMSC细胞中促炎因子水平
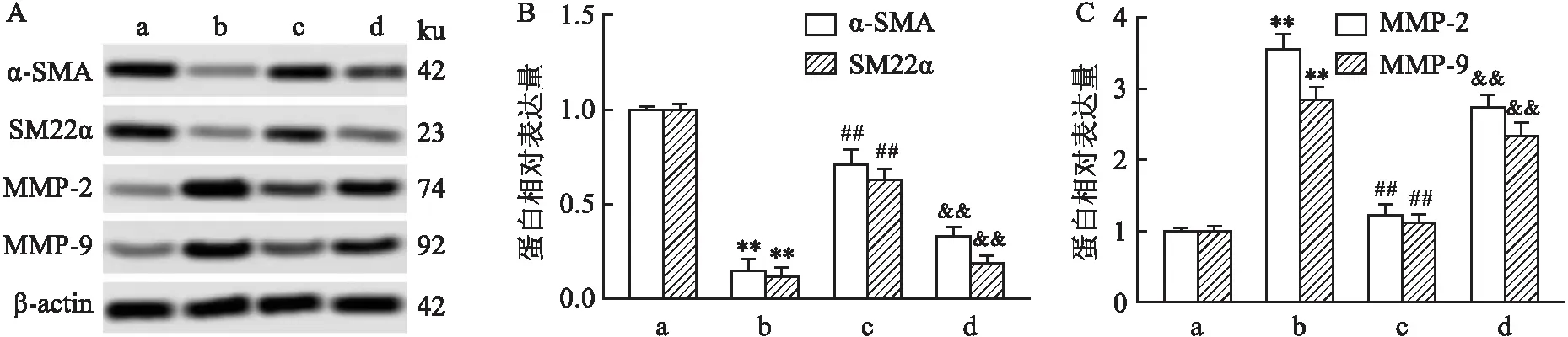
图4 灯盏花素通过Nrf2途径对H2O2诱导的VSMC损伤的影响A:Western blot检测各组α-SMA、SM22α、MMP-2和MMP-9蛋白表达;B:α-SMA和SM22α 蛋白相对表达量;C:MMP-2和MMP-9蛋白相对表达量;a:对照组;b: H2O2组;c: H2O2+Bre组;d: H2O2+Bre+ML385组;与对照组比较:**P<0.01;与H2O2组比较:##P<0.01;与H2O2+Bre组比较:&&P<0.01
2.5 灯盏花素通过Nrf2途径抑制H2O2诱导的
ROS产生和VSMC凋亡如图5所示,在H2O2处理的VSMC中ROS的产生较高(t=9.03,P<0.01),Bre预处理降低了ROS的产生(t=6.78,P<0.01)。H2O2处理导致VSMC凋亡率增加(t=8.42,P<0.01),Bre预处理降低了H2O2诱导的凋亡(t=4.31,P<0.05)。此外,Nrf2被抑制时减弱了Bre对H2O2处理的VSMC细胞ROS产生和凋亡的抑制作用(P<0.01)。
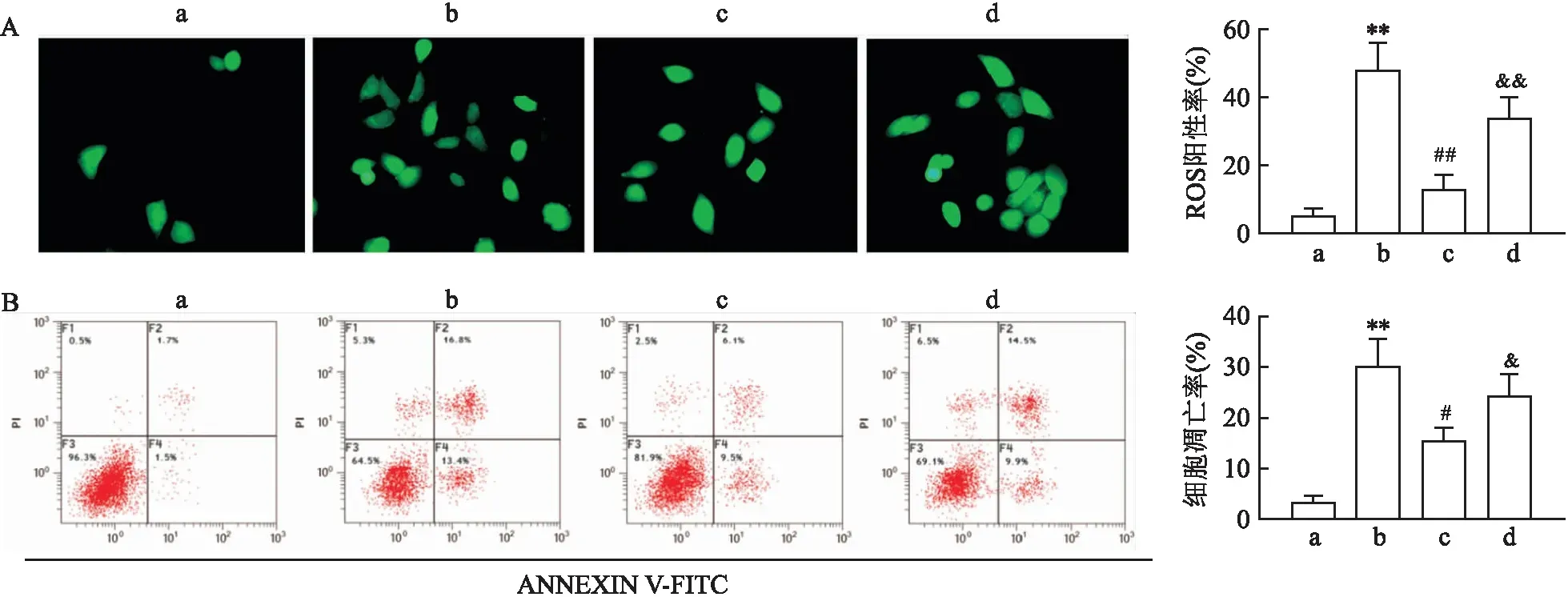
图5 灯盏花素通过Nrf2途径对H2O2诱导的ROS产生和VSMC凋亡的影响A:DCFH-DA染色检测ROS的产生 ×400;B:流式检测细胞凋亡;a:对照组;b: H2O2组;c: H2O2+Bre组;d: H2O2+Bre+ML385组;与对照组比较:**P<0.01;与H2O2组比较:#P<0.05,##P<0.01;与H2O2+Bre组比较:&P<0.05,&&P<0.01
3 讨论
IA是一种脑血管疾病,具有很高的病死率和发病率。IA病理过程包括内部弹性层板的破坏、VSMC表型的转换和细胞外基质(extracellular matrix,ECM)的重塑[9]。既往研究[10]表明Nrf-2信号途径通过调节VSMC表型和功能来抑制颅内动脉瘤形成和进展。在本研究中,通过注射弹性蛋白酶到基底池建立的IA大鼠动脉瘤壁中Nrf2的表达减少,且VSMC发生病变和炎性细胞浸润。Bre上调Nrf2的表达,减轻VSMC的病理损伤,降低大鼠IA的发生和破裂,增加大鼠生存率。此外,Bre上调IA大鼠脑动脉瘤中收缩表型标志物SM22α和α-SMA的表达[11],提示VSMC表型恢复正常。因此上述结果表明,Bre在颅内动脉瘤的形成和发展中起到保护作用,其机制可能与Nrf2的高表达有关。
既往研究[12]表明Nrf2是主要的内源性抗氧化系统之一,在正常生理条件下,kelch样ECH相关蛋白1(Kelch-like ECH associating protein1,Keap1)与Nrf2在细胞质中结合。在应激条件下,Nrf-2从细胞质转到细胞核,调节抗氧化和抗炎基因的表达[13]。Nrf-2途径的激活在IA中具有抗氧化应激和防止VSMC表型切换的保护作用[14]。Liu et al[15]研究发现Bre在CCl4诱导的急性肝损伤中可通过激活Nrf2途径及下游抗氧化酶、减少ROS产生和抑制炎症反应。本研究结果表明Bre可上调H2O2处理的VSMC中核Nrf2的表达并增加下游抗氧化酶转录水平,减少ROS的产生和细胞凋亡,并抑制VMSC中炎性细胞因子的分泌。而加入Nrf2抑制剂减弱了Bre的抗炎、抗氧化和恢复VSMC收缩表型作用。因此,Bre通过激活Nrf2途径减轻H2O2诱导的VSMC氧化损伤和表型转换。
综上所述,本研究表明Bre通过改善大鼠动脉壁病理损伤、IA发生率和存活率起到有效保护作用。体外研究表明Bre能够激活Nrf2信号,促进抗氧化酶的表达,抑制促炎性细胞因子、ROS的产生和细胞凋亡。
