过表达miR-203a-3p对脂多糖致大鼠急性肺损伤后肺纤维化的影响及其机制
2022-05-12任亦频周厚荣李亚骐
任亦频,周厚荣,李亚骐,黄 佳
急性肺损伤(acute lung injury,ALI)是由多种因素所导致的急性、进行性、缺氧性呼吸功能不全或呼吸衰竭[1]。ALI的病因多样,发病机制复杂,其中过度炎症反应已被公认是引发ALI发病的重要原因之一[2]。ALI具有较高的发病率,目前仍缺乏有效的治疗手段。ALI后肺部组织会发生成纤维细胞聚集、胶原沉积等纤维增生反应,最终形成肺间质纤维化。微小RNA(miRNAs)是由19~25个核苷酸组成的内源性小分子非编码RNA,通过转录调控下游靶基因的表达,参与细胞的增殖、分化、凋亡等多种重要的生命活动[3]。众所周知,miRNA在机体的炎症反应过程中也发挥重要作用,并且与ALI的发病密切相关[4]。研究发现,miRNA-203a-3p参与调节肺水肿[5]、脓毒性休克肺损伤[6]、肺纤维化[7]等病症,然而其具体机制尚不完全清楚。为此,本研究通过脂多糖诱导建立大鼠ALI模型,探究miR-203a-3p对大鼠ALI后肺纤维化的影响及机制,旨在为临床治疗肺损伤后肺纤维化提供潜在治疗靶点。
1 材料与方法
1.1 实验动物8周龄健康SPF级雄性SD大鼠60只,体质量(200±20)g ,购于湖南斯莱克景达实验动物有限公司,许可证编号:SCXK(湘)2019-2004。饲养环境温度23~25 ℃,相对湿度50~65%,保持自然昼夜(12 h光照/12 h黑暗)处理,自由摄食饮水。
1.2 主要试剂及仪器脂多糖(LPS)购自美国Sigma公司;miR-203a-3p 模拟物(mimic)及其阴性对照(mimic NC)和miR-203a-3p 激动剂(agomir)及激动剂对照(agomir-NC)均购自上海吉玛制药技术有限公司;白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α) ELISA试剂盒购自武汉博士德生物工程有限公司;TRIzol 提取液、Lipofectamine 2000转染试剂购自美国Invitrogen公司;反转录试剂盒、qRT-PCR试剂盒购自美国Thermo Fisher公司;PCR引物购自上海 Bio-TNT 生物公司;羟脯氨酸(HYP)含量检测试剂盒购自北京索莱宝生物科技有限公司;兔抗卵泡抑素样蛋白1(follistatin-like 1,Fstl1)抗体、β-actin抗体和辣根过氧化物酶(HRP)标记山羊抗兔IgG二抗购自美国CST公司;低温冷冻干燥离心机购自德国Eppendorf公司;石蜡切片机购自德国LEICA公司;蛋白印迹电泳仪购自美国Bio-Rad公司;荧光定量扩增PCR仪器购自美国ABI公司。
1.3 方法
1.3.1大鼠ALI后早期肺纤维化模型建立 取60只SD大鼠随机分为4组:对照组、模型组、agomir阴性对照组(agomir-NC组)和miR-203a-3p agomir组(agomir组),每组15只。参照文献[8]改良的方法构建大鼠ALI后早期肺纤维化模型,先经口气管注入含1.5 mg/kg LPS的生理盐水溶液,24 h后腹腔内注入含3 mg/kg LPS的生理盐水溶液,48 h后再经口气管注入含3 mg/kg LPS的生理盐水溶液,而对照组注入等量生理盐水。agomir-NC组和agomir组大鼠在造模前1 d及造模后1周,分别经尾静脉注射200 μl的agomir-NC和miR-203a-3p agomir,剂量为10 nmol/只。于造模后第14天处死大鼠,取材进行检测。
1.3.2肺组织病理学观察及纤维化程度的评估 取大鼠左肺上叶组织,用4%多聚甲醛固定24 h,石蜡包埋后制成4 μm厚切片,HE染色后于光学显微镜200倍视野下选取10个视野观察肺组织形态学变化,参考文献[9]对肺损伤程度进行半定量测评,总分为0~16分,分数越高表示肺组织损伤越严重。对制备的大鼠肺组织切片进行Masson染色,于光学显微镜200倍视野下选取10个视野进行观察,参照Ashcroft制定的0~5分评分法[10]对大鼠肺组织纤维化程度进行半定量测评,分数越高肺组织纤维化程度越严重。
1.3.3肺组织湿/干比重(W/D)测定 取各组大鼠右肺中叶及下叶组织100 mg,滤纸沾干表面水分,天平称湿重;然后置于烘箱中,60 ℃烘烤72 h,天平秤干重,进行湿/干质量比(W/D)计算。
1.3.4肺组织Hyp水平的测定 精确称取0.2 g新鲜的右肺组织置于玻璃管中,使用玻璃棒碾碎,加入2 ml提取液,置于100 ℃烘箱中充分消化,16 000 r/min室温离心25 min,取上清液,调整pH值至6~8,蒸馏水定容至4 ml,取上清液按照试剂盒说明书加入相应试剂,混匀后置于60 ℃水浴20 min,取200 μl溶液采用酶标仪于560 nm处测量吸光值,再根据说明书提供的公式计算肺组织中Hyp含量。
1.3.5ELISA检测大鼠肺泡灌洗液(BALF)中IL-1β、IL-6和TNF-α水平 将麻醉后大鼠仰卧固定,打开大鼠胸腔,心脏穿刺放血处死,然后结扎右侧肺门,分离出颈部气管,插入导管,2.5 ml生理盐水反复冲洗3次,收集灌洗液,于4 ℃条件下1 500 r/min离心10 min,取上清液按照ELISA试剂盒说明书检测BALF 中IL-1β、IL-6和TNF-α水平。
1.3.6qRT-PCR检测大鼠肺组织中miR-203a-3p和Fstl1 mRNA表达水平 采用TRIzol法提取大鼠肺组织总RNA,应用反转录试剂盒将RNA反转录为cDNA,以cDNA为模板,参照qRT-PCR试剂盒说明书反应体系进行qRT-PCR反应,各基因引物信息如表1所示。PCR反应条件:95 ℃,30 s;95 ℃,5 s,60 ℃,30 s,进行45个循环。miR-203a-3p以U6为内参,Fstl1以β-actin为内参,miR-203a-3p和Fstl1 mRNA相对表达水平采用2-ΔΔCt法进行计算。

表1 各基因引物信息
1.3.7Western blot检测大鼠肺组织中Fstl1蛋白表达水平 取各组大鼠肺组织加入适量RIPA裂解液充分裂解30 min,置于4 ℃条件下14 000 r/min离心10 min,取上清液,采用BCA法测定蛋白浓度。取30 μg蛋白沸水浴变性后进行10% SDS-PAGE电泳,并采用湿转法将蛋白转移至PVDF膜上,5% 脱脂奶粉室温封闭1 h,分别加入Fstl1抗体(1 ∶1 000)和β-actin抗体(1 ∶1 000),于4 ℃孵育过夜,再加入HRP标记的山羊抗兔IgG二抗(1 ∶10 000),室温孵育2 h,滴加ECL显影,并采用ImageJ软件对各条带进行灰度值分析。
1.3.8双荧光素酶报告基因实验 通过TargetScan在线软件预测miR-203a-3p与Fstl1 3′UTR区域结合位点。构建Fstl1 3′UTR野生型(WT)和Fstl1 3′UTR突变型(MUT)荧光素酶报告基因质粒。取对数生长期的293T细胞,接种于12孔板,当细胞汇合度约70%时对细胞进行分组,使用Lipofectamine 2000分别将其与mimic NC和miR-203a-3p mimic共转染至293T细胞中。转染48 h,按照试剂盒说明书要求,分别检测萤火虫和海肾荧光素酶活性,用二者比值表示荧光酶相对活性。
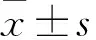
2 结果
2.1 肺组织形态学观察如图1所示,Control组大鼠肺泡形态规则,结构清晰完整,无明显蓝色胶原纤维染色;Model组和agomir-NC组大鼠肺泡腔塌陷、水肿,伴有炎症渗出物和出血,肺泡间隔变宽变厚,且蓝色胶原纤维染色明显,存在致密的胶原沉积;agomir组大鼠肺泡结构、肺泡壁增厚及水肿程度均较模型组有所改善,炎性细胞浸润及出血情况明显减少,蓝色胶原纤维染色较浅,胶原沉积减少。如表2所示,与Control组比较,Model组大鼠肺组织损伤评分及纤维化评分增加(P<0.05);与Model组比较,agomir组大鼠肺损伤评分及纤维化评分降低(P<0.05),而agomir-NC组大鼠肺损伤评分及纤维化评分差异无统计学意义(P>0.05)。
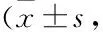
表2 各组大鼠肺组织损伤及纤维化评分分,n=15)
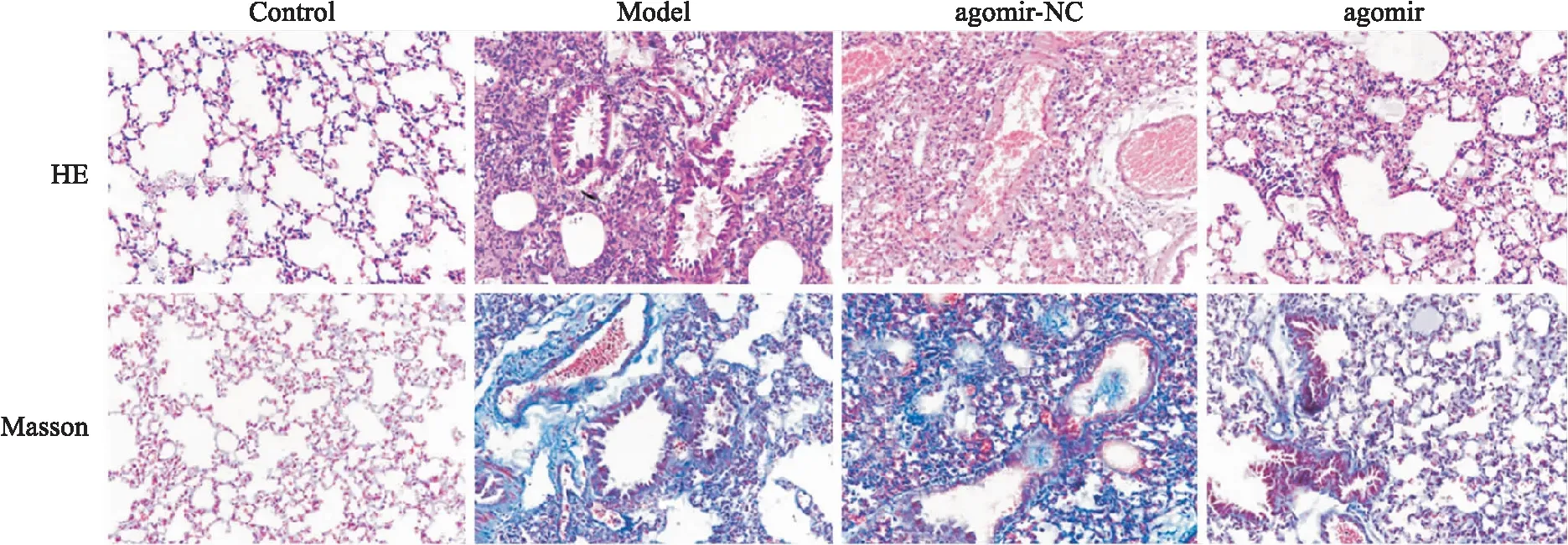
图1 肺组织HE和Masson染色 ×200
2.2 各组大鼠肺组织W/D值及Hyp水平如表3所示,与Control组比较,Model组大鼠肺组织W/D值及Hyp水平增加(P<0.05);与Model组比较,agomir组大鼠肺组织W/D值及Hyp水平降低(P<0.05),而agomir-NC组大鼠肺组织W/D值及Hyp水平差异无统计学意义(P>0.05)。
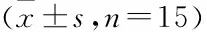
表3 各组大鼠肺组织W/D值及Hyp水平比较
2.3 各组大鼠BALF中IL-1β、IL-6和TNF-α水平如表4所示,与Control组比较,Model组大鼠BALF中IL-1β、IL-6和TNF-α水平升高(P<0.05);与Model组比较,agomir组大鼠BALF中IL-1β、IL-6和TNF-α水平降低(P<0.05),而agomir-NC组大鼠BALF中IL-1β、IL-6和TNF-α水平差异无统计学意义(P>0.05)。
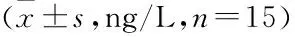
表4 各组大鼠BALF中IL-1β、IL-6和TNF-α水平
2.4 大鼠肺组织中miR-203a-3p和Fstl1表达水平如表5和图2所示,与Control组比较,Model组大鼠肺组织中miR-203a-3p表达水平降低(P<0.05),而Fstl1 mRNA和蛋白表达水平升高(P<0.05)。与Model组比较,agomir组大鼠miR-203a-3p表达水平升高(P<0.05),Fstl1 mRNA和蛋白表达水平降低(P<0.05),而agomir-NC组差异无统计学意义(P>0.05)。
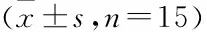
表5 各组大鼠miR-203a-3p及Fstl1 mRNA和蛋白表达水平
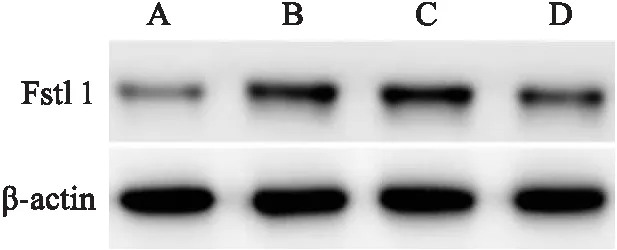
图2 Western blot检测各组大鼠肺组织中Fstl1蛋白表达水平A:Control组;B:Model组;C:agomir-NC组;D:agomir组
2.5 miR-203a-3p与Fstl1靶向关系的验证如图3所示,TargetScan软件预测miR-203a-3p与Fstl1 3′UTR区域存在结合位点。双荧光素酶报告基因实验进一步验证,与共转染mimic-NC和Fstl1-WT质粒组细胞比较,共转染miR-203a-3p mimic和Fstl1-WT质粒组细胞相对荧光素酶活性降低(P<0.05);与共转染mimic-NC和Fstl1-MUT质粒组细胞比较,共转染miR-203a-3p mimic和Fstl1-MUT质粒组细胞相对荧光素酶活性差异无统计学意义(P>0.05)。
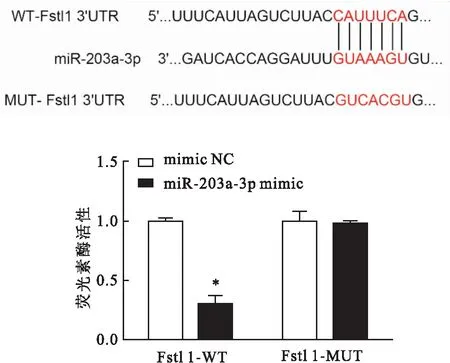
图3 miR-203a-3p与Fstl 1靶向调控关系与mimic NC组比较:*P<0.05
3 讨论
ALI是一种复杂的临床并发症,常常伴有炎症反应,微血管损伤以及肺血管和上皮细胞通透性增加,甚至可能发展为更严重的致命性急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)。ALI具有较高的发病率和死亡率,目前尚无特效的治疗方法,不仅增加社会经济负担,还严重降低患者生活质量。众所周知,过度炎症反应是诱发ALI的重要因素,有效控制过度炎症反应是治疗ALI的常用方案。LPS 是内毒素的主要成分,进入机体后可快速诱发炎症反应,导致弥漫性肺损伤,腹腔注射LPS是目前制备ALI动物模型常用的理想方法[11]。研究[12]表明,肺纤维化是ALI的关键病理过程,其病理特征是肺上皮细胞损伤、成纤维细胞增殖和细胞外基质沉淀。本研究结果显示,大鼠经LPS诱导后出现明显的肺损伤及肺纤维化现象,且BALF中炎症因子IL-1β、IL-6和TNF-α水平明显升高,肺组织W/D值及Hyp含量明显增加,提示本研究ALI后肺纤维化模型制备成功。
miRNA在ALI的发生发展中发挥重要的调控作用,吴松林 等[13]在研究中证实,miR-125b可能通过调控Notch1蛋白的表达影响脓毒症急性肺损伤中炎症因子的表达,参与其免疫炎症调控过程;Wang et al[14]发现miR-19能够减轻LPS诱导所致ALI的炎症反应。同时,也有研究[5]显示,在高原缺氧所致肺损伤模型中miR-203a-3p表达下调,并与肺微血管形成介导的肺水肿有关。Ling et al[6]研究显示,在脓毒性休克小鼠模型中 miR-203低表达,其过表达可通过靶向下调VNN1,激活AKT信号通路,从而减轻脓毒性休克肺损伤。以上提示miR-203a-3p在肺损伤过程中发挥重要作用。本研究显示,ALI组大鼠肺组织中miR-203a-3p表达水平明显降低。为了探讨miR-203a-3p在ALI过程中的作用及其对ALI后肺纤维化的影响,本研究通过尾静脉注射miR-203a-3p agomir上调ALI大鼠肺组织中miR-203a-3p表达,进一步研究结果显示,miR-203a-3p过表达后agomir组大鼠肺损伤及纤维化程度得到明显改善,肺组织W/D值及Hyp含量显著降低,同时BALF中炎症因子IL-1β、IL-6和TNF-α水平明显降低,表明miR-203a-3p过表达可显著改善ALI大鼠肺损伤及肺纤维化。
Fstl1是一种由308个氨基酸组成的分泌型糖蛋白,定位于3q13染色体上,在心血管疾病、自身免疫性疾病、肿瘤、炎症等疾病的发生、发展和转归过程中发挥重要作用。杨华 等[15]研究显示,Fstl1可以通过调节TGF-β1/Smad2/3信号通路来调控成纤维细胞活化及细胞外基质合成,具有促纤维化作用。本研究结果显示,ALI组大鼠肺组织中Fstl1 mRNA和蛋白表达水平显著升高;进一步通过Targetscan在线数据库预测,发现miR-203-3p 与Fstl1 3′UTR 存在互补序列;随后通过双荧光素酶实验报告证实,Fstl1是miR-203a-3p靶基因。因此,miR-203a-3p过表达可能通过靶向下调Fstl1表达改善LPS诱导的急性肺损伤后肺纤维化,但还需要进一步研究证实。
综上所述,本研究初步探明miR-203a-3p在ALI大鼠肺组织中低表达,其过表达可降低ALI大鼠肺组织炎症反应,改善ALI大鼠肺损伤及肺纤维化,其机制可能与靶向下调 Fstl1表达有关。因此,miR-203a-3p可能成为ALI后肺纤维化治疗的潜在靶点,但还需要更多的实验进行论证。
