非贵金属M/TiO2催化剂上甲烷和二氧化碳光催化干重整制氢
2022-05-11刘文慧刘振民王远洋
刘文慧,刘振民,王远洋
(太原科技大学化学与生物工程学院,煤矸石高值利用山西省重点实验室,山西 太原 030024)
甲烷不仅是一种重要的清洁能源,而且可作为重要的化工原料合成包括氢气在内的诸多高附加值化工产品,与此同时,未充分燃烧的甲烷和CO2的大量排放导致严重的“温室效应”,为实现我国2030年“碳达峰”和2060年“碳中和”目标,也迫切需要对其加以利用。
加大氢能利用、发展氢能经济是实现双碳目标的重要举措,由于电解水制氢能耗过大,得不偿失,化石燃料制氢因而成为最广泛采用的方式。煤或石油制氢成本很低,但废水、废气和废固的排放量很大;天然气等富含的甲烷储氢量达25%,用以制氢耗水量小,CO2排放量低,氢选择性高,对环境影响较小,是化石原料制氢路线中最理想的方式。水蒸气重整法技术成熟,但需通过吸附强化实现CO2原位脱除以提高氢产率;催化裂解法可得到较高附加值的碳材料,但催化剂易积炭失活;部分氧化法和自热重整法需要纯氧,增大了安全风险;化学链重整法可同时实现CO2分离和体系自供热,但难以控制载氧体的还原程度;干重整法可同时消除温室气体CO2和CH4,且产品气比例适宜,可直接用于费托合成或燃料电池,虽然也存在积炭问题,但不失为较优的制氢工艺[1]。
甲烷C-H键的键能高达439 kJ·mol-1,且其电子亲和能与分子极化率极低[2],使得干重整反应需在1100 K和1 MPa以上的高温高压进行,同时产物氢气活性高于甲烷,高温条件更易被过度氧化为水,从而降低产物选择性。热催化可通过外部加热提供反应所需的活化能,Singha R K等[3]制备了Pd/CeO2纳米晶体催化剂,350 ℃即可引发干重整反应,金属-载体相互作用和载体CeO2的氧化还原性是该催化剂低温活性的主要驱动力。Gangurde L S等[4]采用微波辅助水热法合成了Ru/SrTiO3催化剂,通过改善Ru分散度,获得最佳99.5%的CH4转化率,94%的CO2转化率,产物中H2与CO比为0.89。然而热催化耗能大,对设备要求高,且反应过程中易对环境造成污染和能源浪费,为此需构筑高效的光催化反应体系以实现甲烷的定向转化。
光催化反应利用光能和适宜的催化剂,通过激发产生电子-空穴对提供反应所需的化学活化能,在室温即可驱动CH4和CO2等惰性小分子活化,与高温高压的热催化不同,光催化甲烷重整(PDRM)反应条件温和(常温、常压)且过程容易控制,可较大程度上避免目标产物的过度氧化,有利于产物生成。Yuliati L等[5]报道了第一个PDRM实例,200 ℃采用Ga2O3光催化剂,实现了CH4和CO2转化为CO和H2。Shoji S等[6]报道Rh/SrTiO3负载型催化剂可在紫外光照下增强DRM反应,反应无需加热,在较低温度即可完成,这在热催化过程中无法实现,其研究表明,光生空穴用于CH4在SrTiO3上进行氧化反应,光生电子用于CO2在Rh上进行还原反应。
单纯依靠光照或反应物所提供的能量毕竟有限,通常很难达到反应所需条件,为此近年来许多研究者将光催化和热催化结合,以期达到良好催化效果。Pan F等[7-8]报道了光热催化甲烷干重整(PTC-DRM)工艺,通过在CeO2上负载Pt、掺杂Zn和原子沉积MgO涂层制得MgO/Pt/Zn-CeO2催化剂,并以集中的太阳光为能量输入,H2和CO产率分别为单独热催化DRM的9倍和3倍以上;同时设计了负载Pt、Si改性的CeO2催化剂(Pt-Si-CeO2)用于PTC-DRM,H2和CO的生成速率分别是在相同温度、黑暗条件下的5倍和2倍。但上述反应体系均采用贵金属催化剂,贵金属的稀缺性及高成本限制了其大规模应用,为此本文通过制备非贵金属M/TiO2催化剂,并用于CH4和CO2干重整光催化反应,期望得到有意义的结果,以寻找经济可行的氢气制取途径。
1 实验部分
1.1 催化剂制备
采用浸渍法制备M/TiO2催化剂(活性成份M为Ni、Co或Cu),首先采用溶胶凝胶-常压干燥法制备TiO2载体[9],再以Ni(NO3)2·6H2O、Co(NO3)·6H2O、Cu(NO3)2·3H2O为活性组份前驱体,采用四因素三水平L9(34)进行正交设计实验(见表1)。

表1 M/TiO2催化剂的L9(34)正交实验设计
称取设定量的前驱体,溶于蒸馏水或无水乙醇中,加入TiO2载体搅拌均匀后于100 ℃干燥10 h,再移入马弗炉中于设定温度焙烧4 h,待冷却后研碎过筛,称取0.05 g的60~80目粉末涂覆至L10 mm×W50 mm×δ2 mm的瓷条表面备用。
1.2 光催化干重整反应评价
M/TiO2催化剂光催化CH4与CO2干重整反应在自行搭建的光催化反应装置进行,如图1所示。
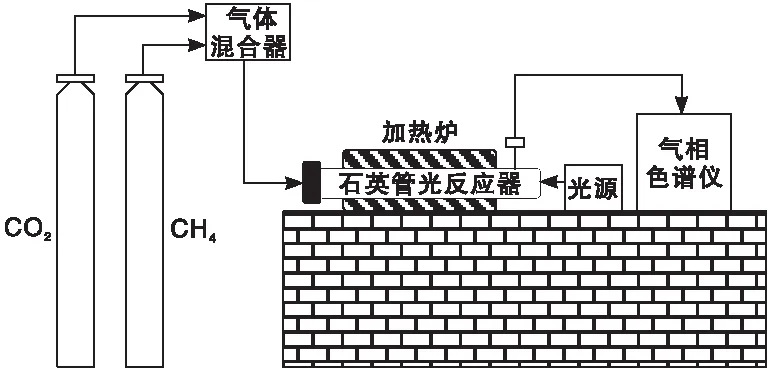
图1 光催化干重整反应装置Figure 1 Reaction device for photocatalytic dry reforming
CH4和CO2流速采用质量流量计控制,其体积比为1∶1,石英管光反应器尺寸为φ20mm×δ2mm,采用氙灯光源,以5 ℃·min-1从室温升温至750 ℃,自500 ℃起每50 ℃光照设定反应时间(见表1),以GC-950型气相色谱仪(10%FFAP/TDX-01色谱柱)在线检测产物组成,采用归一法计算CH4转化率和H2选择性。
1.3 催化剂表征
程序升温还原(TPR)采用美国麦克仪器公司的ChemiSorb 2720型化学吸附仪,称取0.1 g催化剂装入U 型管中,还原气为10%H2/Ar,以10 ℃·min-1升温至800 ℃,采用TCD 热导器检测并记录数据。X射线衍射(XRD)采用日本理学株式会社的MiniFlex 600型X射线衍射仪,Cu靶,λ=0.154 2 nm,工作电压40 KV,扫描范围5o~80o。傅里叶变换红外光谱(FT-IR)采用美国赛默飞世尔科技公司的Nicolet Is50型红外光谱仪,取适量样品平铺于检测器,以红外光束照射样品进行检测。比表面积和孔分布采用美国麦克仪器公司的ASAP-2020型物理吸附仪,采用多点BET法计算比表面积,MP法分析孔径分布,通过t-plots和αs-plots计算总孔体积。
2 结果与讨论
2.1 光催化干重整反应结果
图2为M/TiO2催化剂上光催化CH4与CO2干重整制氢反应性能。
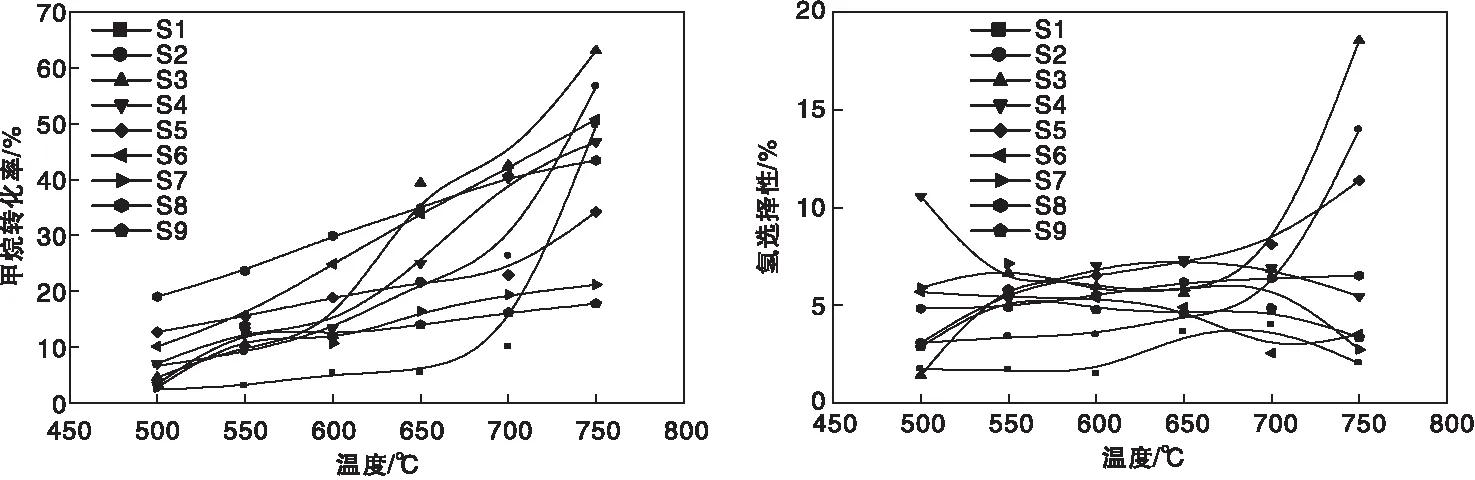
图2 M/TiO2催化剂上CH4转化率和H2选择性随温度变化趋势Figure 2 CH4 conversion and selectivity to H2 vs.temperature over the M/TiO2 catalysts
从图2可以看出,随反应温度从500 ℃升至750 ℃,各催化剂上CH4转化率均呈上升趋势,700 ℃前依次为S3>S6>S4>S8≫S2>S5>S7>S9>S1,750 ℃时S1和S2大幅跃升,变为S3>S2>S6>S1>S4>S8>S5>S7>S9;各催化剂上H2选择性整体偏低,S3、S2和S5催化剂在750℃高温时H2选择性较高,表明属于光热催化范畴。
因本研究的目标为制氢,故采用高H2选择性的750 ℃数据进行正交分析,结果见表2,Ki为各因素同一水平之和,ki为各因素同一水平的平均值,R为各因素的极差。
采用综合平衡法来确定各因素水平的最优组合[10],对因素主次和水平优劣进行综合考虑,通过分析ki值得出不同因素的最优组合,即活性组分Ni负载质量分数为6%,焙烧温度为600 ℃,反应时间为40 min。同时根据R值得出,活性成份和负载量是影响H2选择性的主要因素,焙烧温度次之,反应时间影响最小。
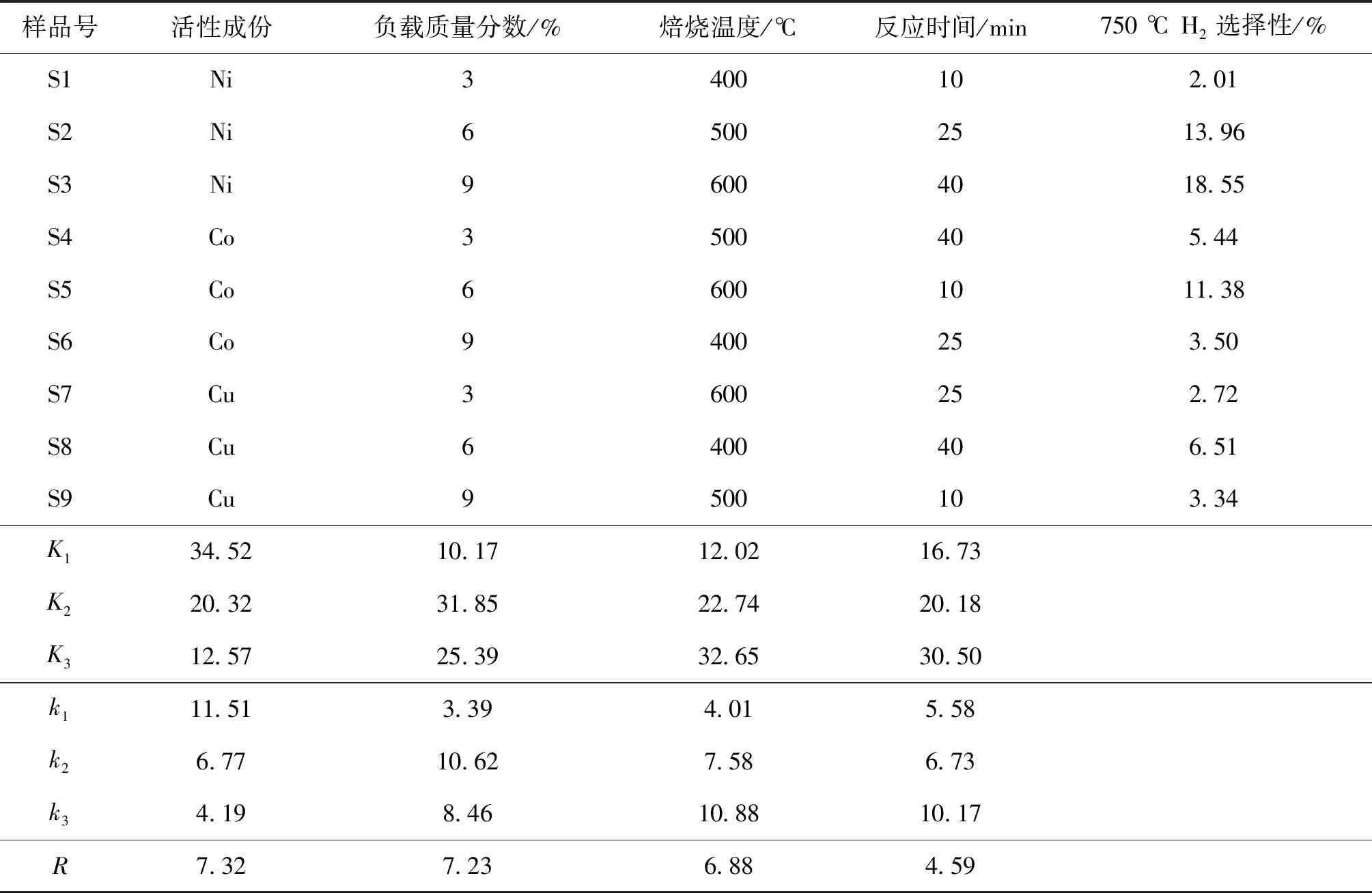
表2 M/TiO2催化剂上H2选择性的正交分析
2.2 催化剂表征结果
2.2.1 氧化还原性能
各催化剂的TPR结果如图3和表3所示。起始还原温度是衡量催化剂氧化还原的难易程度,而耗氢量是衡量催化剂氧化还原的强弱[11],从图3和表3可以看出,起始还原温度与催化剂的活性成份种类密切相关,S7~S9的Cu系催化剂还原温度最低,说明其最易被氧化还原,S1~S3的Ni系催化剂和S4~S6的Co系催化剂均在300 ℃左右,说明这两类催化剂均最难被氧化还原;耗氢量则与负载量密切相关,3%低负载量的S1、S4和S7催化剂表现为弥散的耗氢峰且耗氢量较小,说明其氧化还原性能较弱,6%中负载量的S2、S5和S8催化剂的耗氢量较高,说明其氧化还原性能较强,9%高负载量的S3、S6和S9催化剂的耗氢量更高,说明其氧化还原性能更强。
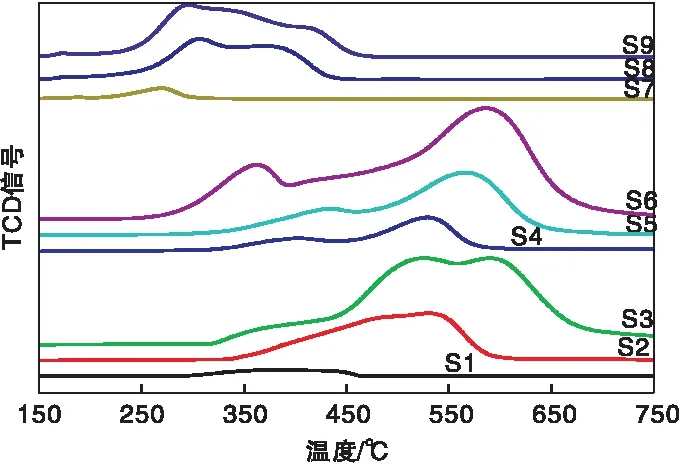
图3 M/TiO2催化剂的TPR谱图Figure 3 TPR profiles of the M/TiO2 catalysts
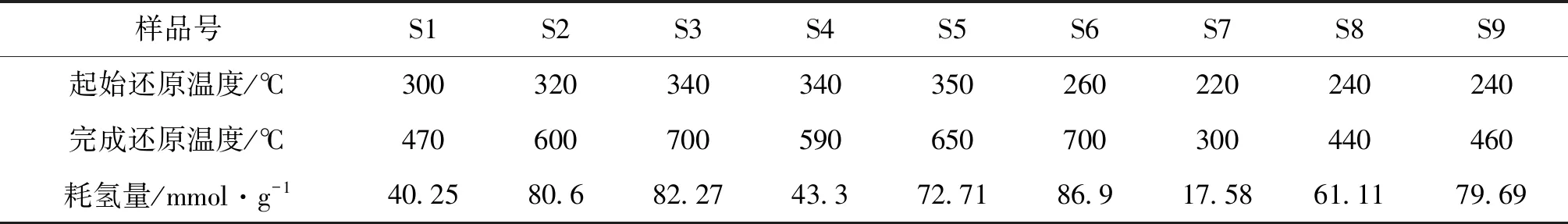
表3 M/TiO2催化剂的起始、完成还原温度和耗氢量
2.2.2 结构特征
各个催化剂的XRD如图4所示,2θ为25.2o、48.0o处的衍射峰归属于锐钛矿型TiO2,43.28o处的衍射峰归属于NiO,36.9o处的衍射峰归属于Co3O4,35.49o处的衍射峰归属于CuO。从图4可以看出,所有催化剂均显示出锐钛矿型TiO2的衍射峰,锐钛矿型TiO2相比于金红石型TiO2具有较大的比表面积和适宜的晶体结构,有利于活性成份均匀分散在催化剂表面[12],因而具有较高的催化性能。对Ni系或Cu系催化剂,随着负载量降低,NiO或CuO衍射峰均逐渐减弱,S1和S7已不明显,可能是低负载量导致单层分散所致;对Co系催化剂,三者Co3O4衍射峰则差别不大。
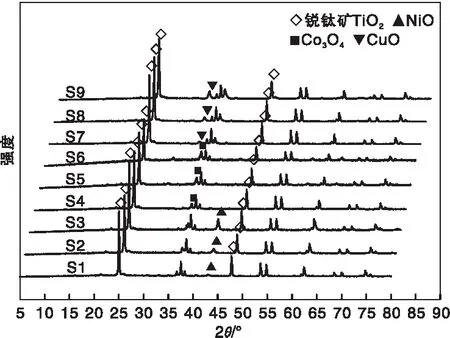
图4 M/TiO2催化剂的XRD图Figure 4 XRD pattern for the M/TiO2 catalysts
图5为各个催化剂的FT-IR谱图。
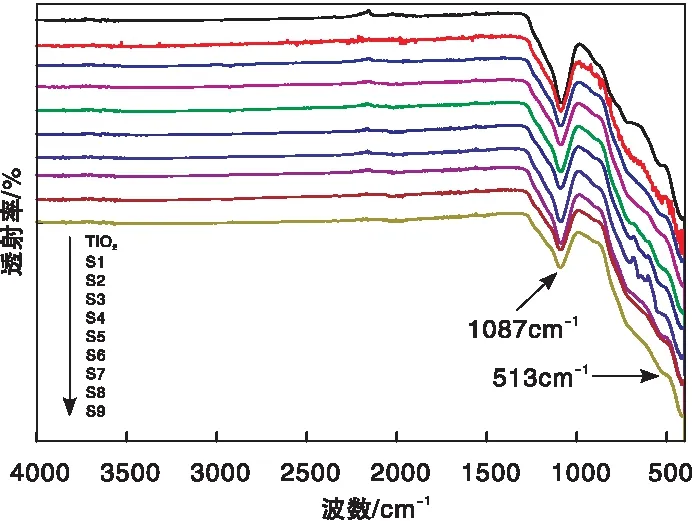
图5 M/TiO2催化剂的FT-IR谱图Figure 5 FT-IR spectra of the M/TiO2 catalysts
从图5可以看出,所有催化剂均在513 cm-1和1087 cm-1处出现特征峰,前者为TiO2中Ti-O键的特征峰,后者为SiO2中Si-O键的特征峰;S4、S5和S6在729 cm-1也有Si-O键特征峰,而负载Ni和Cu的催化剂在该处的特征峰消失。出现Si-O键特征峰是由于在TiO2载体制备过程中加入正硅酸乙酯修饰液[9],其发生水解缩合反应形成Si-O-Si键,SiO2又与-OH发生缩聚反应形成Si-O键所致[13]。
2.2.3 织构特征
S3、S6、S9催化剂和TiO2载体的孔径分布如图6所示,其孔径、比表面积和孔容数据见表4。从表4可以看出,与TiO2载体相比,负载金属后的催化剂的孔径和孔容都增大;S3和S6催化剂的比表面积较TiO2载体增加,而S9催化剂的比表面积明显减少,可能是由于Cu系催化剂容易烧结所致。

图6 S3、S6、S9催化剂和TiO2载体的孔分布Figure 6 Pore distribution of S3,S6,S9 catalysts and the TiO2 support

表4 S3、S6、S9催化剂和TiO2载体的织构数据
图6中四个样品既有小孔又有大孔,趋势基本相同。TiO2载体在3 nm的小孔较多,三个催化剂在(5~9) nm也有小孔,虽然S6在(20~100) nm的孔多于S3和S9,但S3大于100 nm的孔明显增多,说明这些大孔有助于促进干重整反应从而提高产氢性能。
2.3 制备参数对H2选择性的影响
制备参数对H2选择性的影响如图7所示。
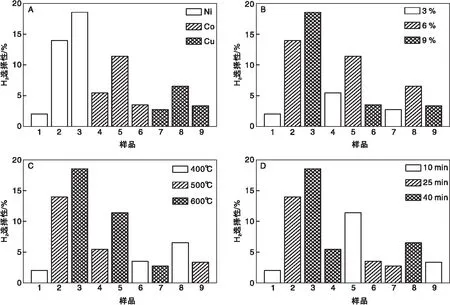
图7 制备参数对H2选择性的影响Figure 7 Histograms of the effects of preparation parameters on the selectivity to H2
2.3.1 活性成份
图7A为不同活性成份催化剂上H2选择性的柱状图,Ni系催化剂的H2选择性最高,Co系高于Cu系催化剂,均较低;至于S1性能较差的原因显然与其低负载量有关。催化剂的反应性能与活性成份的性质密切相关,Ni、Co和Cu的最外层电子排布分别为4s23d8、4s23d7和4s13d10,显然Ni和Co较难失去电子,而Cu较易失去电子,这也从其氧化还原性能上体现出来(图3),Ni系的三个催化剂的NiO还原峰起始温度均在320 ℃左右,与文献报道的NiO的还原温度(375 ℃)基本一致[14],但完全还原的温度相差较大,S1、S2和S3分别为470 ℃、600 ℃和700 ℃;Co系的三个催化剂均为双峰,尤以S6最为明显, S4和S5在约350 ℃开始还原,S4在590 ℃完成还原,S5在650 ℃完成还原,S6则在260 ℃开始还原,在700 ℃完成还原;Cu的三个催化剂系均在约230 ℃开始还原,但完全还原的温度也相差较大,S7、S8和S9分别为300 ℃、440 ℃和460 ℃(见表4)。因此高的H2选择性需要活性成份较难失去电子,同时也与其它制备参数有关。
2.3.2 负载量
图7B为不同负载量催化剂上H2选择性的柱状图,低负载量的S1、S4和S7(3%)获得低的H2选择性,中高负载量的S2、S3、S5和S8获得高的H2选择性,由于采用750 ℃的H2选择性,而所有催化剂的起始和完成还原温度均低于该温度,为此耗氢量对催化性能的影响更为重要,两类分别对应于较低和较高的耗氢量(见表4)。高负载量自然制备得到较多的金属氧化物,而较多金属氧化物自然会提供较多的活性位;至于S6和S9低的H2选择性,可能因其较低的焙烧温度所致。
2.3.3 焙烧温度
图7C为不同焙烧温度催化剂上H2选择性的柱状图,对Ni系和Co系催化剂而言,中高焙烧温度(500 ℃、600 ℃)的S2、S3、S4和S5获得高的H2选择性,而低焙烧温度(400 ℃)的S1和S6获得低的H2选择性;对Cu系催化剂因其较易失去电子,适中的焙烧温度(500 ℃)即可获得较高的H2选择性。焙烧温度对催化剂晶体结构及孔分布和比表面积均有影响,低的焙烧温度难以形成催化反应活性所需的晶相,而高的焙烧温度则易烧结从而影响孔分布和比表面积,进而影响到催化剂表面活性位的数量。前已述及,催化剂晶体结构主要受负载量影响,不再赘述。结合图6和表5可以看出,低温焙烧催化剂90 nm以下的孔较多,而高温焙烧有利于形成100 nm以上的大孔,且对Ni活性成份仍然保持很高的比表面积和孔容。
2.3.4 反应时间
图7D为不同反应时间H2选择性的柱状图,随着反应时间延长,催化剂反应活性均相应提高,S5催化剂除外,其原因可能是由于S5与最优组合催化剂的负载量(6%)和焙烧温度(600℃)一致,且为与Ni失电子能力相当的Co活性成份,而反应时间对H2选择性影响最小。
3 结 论
通过四因素三水平正交设计,采用浸渍法制备了单组分非贵金属M/TiO2催化剂,并进行CH4和CO2光催化干重整反应制氢活性评价。结果表明,在600 ℃焙烧9%Ni/TiO2催化剂上于750 ℃反应40 min,CH4转化率和H2选择性分别为63.10%和18.55%。以750 ℃的H2选择性为指标进行正交分析,得出最优组合催化剂:活性组分为Ni,负载质量分数为6%,焙烧温度为600℃,反应时间为40 min。活性成份和负载量是影响H2选择性的主要因素,焙烧温度次之,反应时间的影响最小。
结合TPR、XRD、FT-IR和BET表征结果,通过制备参数对H2选择性的影响分析表明,催化剂的反应性能与活性成份的性质密切相关,Cu容易失去电子,而Ni、Co失电子能力较弱;相较起始和完成还原温度,耗氢量对催化性能的影响更为显著,中高负载量(6%、9%)显示出较高的耗氢量;低的焙烧温度难以形成催化反应活性所需的晶相,而高的焙烧温度则易烧结从而影响孔分布和比表面积,进而影响到催化剂表面活性位的数量,高温焙烧(600℃)有利于形成100 nm以上的大孔;随着反应时间延长,催化剂的反应活性均相应提高,因而较长的反应时间(40 min)有利于获得高的H2选择性。
