金线莲分泌IAA内生真菌的筛选与鉴定及其发酵条件优化
2022-05-11陈科霖王明元尤长胜刘建福林萍李雨晴陈文亮
陈科霖,王明元,尤长胜,刘建福,林萍,李雨晴,陈文亮
(1.华侨大学 化工学院,福建 厦门 361021;2.泉州市金胜生态农业有限公司,福建 泉州 362000)
金线莲(Anoectochilusroxburghii(Wall.)Lindl)为兰科开唇兰属的一种多年生草本植物,具有清热凉血、除湿解毒的功效,以全草入药[1].金线莲含有多种生物活性化合物,如金线莲苷、多糖、黄酮和糖苷,常用于治疗肝病、糖尿病、高血脂和类风湿性关节炎[2-3].国内金线莲已被开发成各种不同剂型的产品,同时在临床上用于治疗手足口病和慢性肝炎[4].金线莲因其独特的药用和食用特性,市场需求逐年增加,但过度消费导致野生金线莲资源急剧减少.金线莲作为一种遮荫植物,对其小气候环境有着严格的要求.自然环境下,金线莲繁殖能力低,生存竞争力差[5-6];而化学肥料的长期使用,会严重影响金线莲的可食性和安全性.
植物内生真菌具有改善和促进植物生长的能力[5,7-9],是成功定居在维管植物组织中的微生物,据报道几乎在所有植物中都有分离[10].Berg等[11]发现内生菌直接影响一些植物的功能性状,如叶片营养水平、叶片寿命、比叶面积和地上部与根的比例.Cipriano等[12]在甘蔗上发现的促生菌具有固氮,促进植物激素产生的功能.李福艳等[13]筛选的3株真菌通过产生吲哚-3-乙酸(IAA)直接促进玉米幼苗生长.真菌分泌的IAA与内源植物的IAA协同反应,继而刺激植物生长.
目前,金线莲内生真菌促生菌株的研究已有报道,然而已发现的促生菌株依然有限,商业化应用菌株选择空间不多.因此,继续挖掘金线莲促生真菌资源是非常必要与迫切.本文从福建金线莲品种‘红霞’的茎中分离到一株产IAA能力较强的真菌PJ3,通过形态学特征及内部转录间隔区(internal transcribed spacer,ITS)基因序列分析进行鉴定,确定其为角担菌属,并优化其产IAA的发酵条件.
1 实验材料与方法
1.1 实验材料
1.1.1 样品来源及处理 金线莲品种‘红霞’来自福建省泉州金胜生态农业有限公司金线莲林下种植基地.从基地采集‘红霞’金线莲的完整植株,装盒,快速带回实验室,于4 ℃下保存.
1.1.2 培养基 LB液体培养基,pH=5.6~6.0;马铃薯葡萄糖琼脂培养基(PDA),pH=5.6~6.0;产IAA培养基:L-色氨酸1 g,LB液体培养基定容至1 L;初始液体培养基:蔗糖20 g,无水硫酸镁0.5 g,无水磷酸氢二钾1.5 g,无水磷酸二氢钾1.5 g,蛋白胨10 g,去离子水定容至1 L,pH=5.6~6.0.
1.2 实验方法
1.2.1 内生真菌的分离纯化 取金线莲的根、茎、叶在流水下冲洗60 min,超净台下剪成0.5~1.0 cm小段,将各组织在75%乙醇下浸泡1 min;用1%升汞分别浸泡根部8 min,茎4 min,叶2 min,将片段浸入75%乙醇浸泡1 min.最后用无菌水清洗3次,并在灭菌滤纸上风干.将切好的根、茎、叶小段分别接种于PDA培养基内,于28 ℃恒温培养,待从根、茎、叶切口处长出菌后,挑取尖端进行纯化培养[14].
1.2.2 产吲哚乙酸(IAA)真菌的筛选及能力评估 将分离纯化后的菌株接入产IAA的培养基.培养条件:温度为28 ℃,摇床转速为180 r·min-1,培养时间为5~7 d.随后将菌悬液于12 000 r·min-1下离心10 min,取2 mL上清液,并加入等体积显示剂(Salkowski 比色液).对照组:等体积未接种LB液体培养基和Salkowski比色液混合液为阴性对照,室温黑暗下静置30 min,颜色不变色为阴性,不产IAA;变成粉红色则为阳性,产IAA,可进行IAA定量测定其D(530)值,每株菌试验设置3个平行[15].分别配置0.5,1.0,5.0,10.0,15.0,20.0,25.0 μg·L-1分析纯的IAA系列浓度,并绘制标准曲线,最终IAA含量换算公式为
C=C1V1/V2.
上式中:C为样品吲哚乙酸浓度,μg·mL-1;C1为标准曲线上查得的IAA浓度,μg·mL-1;V1为样品提取液体积,mL;V2为样品反应液体积,mL.
1.2.3 菌株形态鉴定及ITS分子学鉴定 通过初步筛选,依据《真菌鉴定手册》[16]和《中国真菌志》[16]对促生效果最佳的菌株进行形态学鉴定,并进一步ITS序列分析和进化树分析.根据真核生物ITS保守序列通用引物ITS1(5′-AGAGTTTGATCCTGGCTCAGAG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)[18]送至北京擎科新业生物技术有限公司进行测序.将测定所得序列与NCBI 数据库 BLAST 同源性比对分析,选取同源性较高的模式菌株用邻接法(neighbor-joining method)构建系统发育树.
1.2.4 菌株生长曲线绘制 在初始液体培养基上培养156 h,装液量(体积分数)为20%,置于28 ℃,180 r·min-1下,初始3 d每24 h取样1次,之后每12 h取样1次,测量菌株产IAA能力,并绘制曲线确定取样时间.
1.2.5 菌株发酵条件优化 1)分别选取葡萄糖、蔗糖、乳糖作为碳源和牛肉膏、蛋白胨、酵母浸粉作为氮源,置于28 ℃,180 r·min-1下培养4 d,测量其产IAA能力,每个处理设置3个重复;2)在最佳碳源、氮源下分别添加不同质量浓度的氮源或碳源,测量其产IAA能力,确定最佳添加量,每个处理设置3个重复;3)在优化培养基上 设置不同装液量(体积分数)、pH值和摇床转速,分别测量其产IAA能力,每个处理设置3个重复.
1.2.6 正交试验设计 通过单因素试验,设计5因素4水平正交试验,确定菌种产IAA的最佳条件.表1为正交试验设计表.表1中:ρC,ρN分别为碳源和氮源的质量浓度;φ为装液量(体积分数);ω为摇床转速.

表1 正交试验因素与水平表
2 实验结果与分析
2.1 金线莲内生促生菌筛选
从‘红霞’金线莲的根、茎、叶中共分离16种内生真菌,只有PJ1,PJ3,PY2和PG5能够产IAA,如图1所示.图1中:ρIAA为IAA质量浓度.从图1可知:从茎中分离得到的PJ3产IAA能力最强,质量浓度达到(106.78±4.43)μg·mL-1,显著高于其他3个菌株.
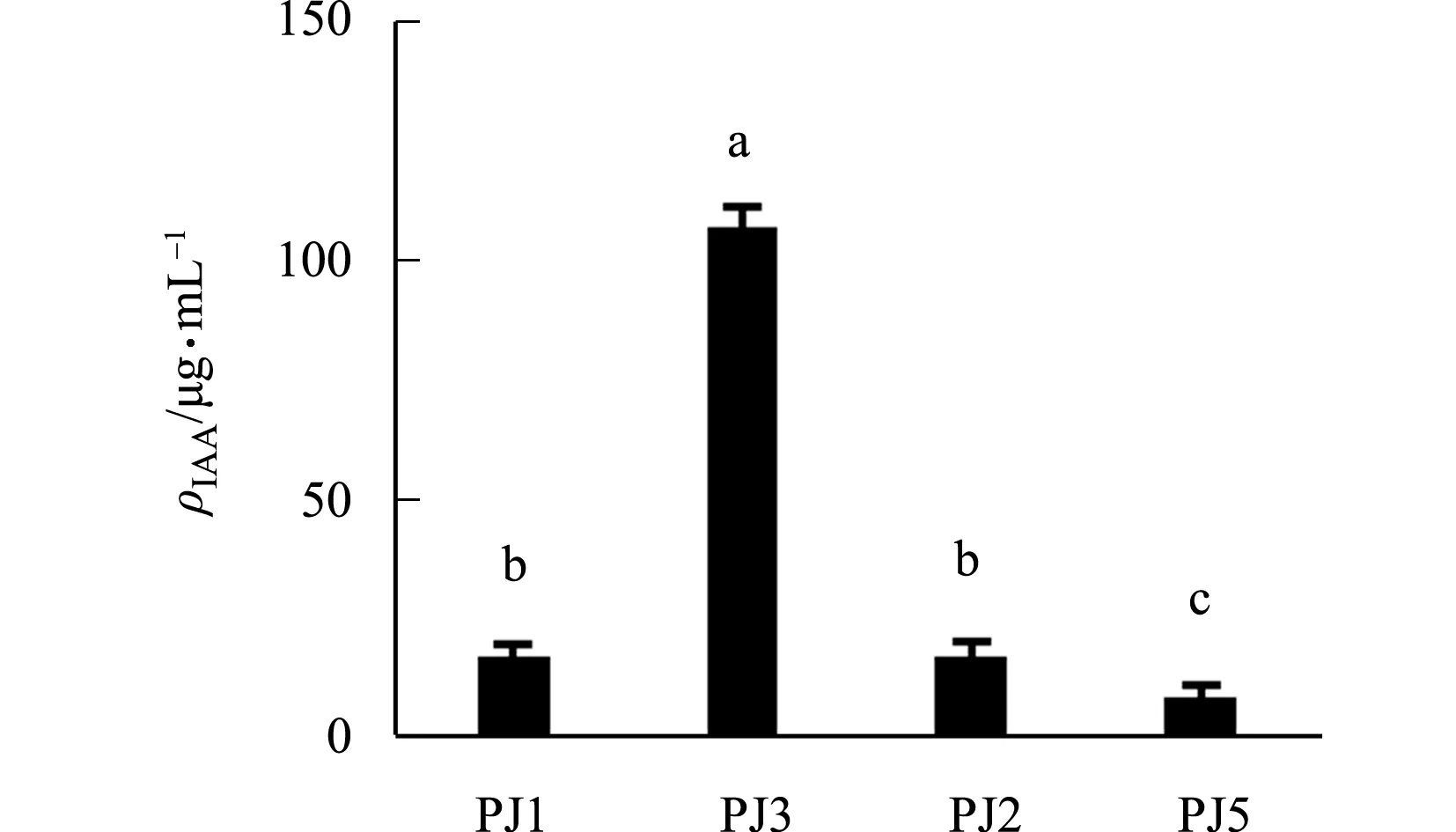
图1 金线莲内生菌产IAA能力比较
2.2 菌种鉴定
2.2.1 形态鉴定 PJ3菌株在PDA培养基上的菌落形态和光学显微结构,如图2所示.由图2可知:PJ3菌株菌落覆盖密集的白色菌丝;菌落圆形,开始是白色,随后颜色逐渐加深变黄,最后为深褐色;光学显微镜下菌丝呈树枝状分布,分生孢子球形,无色透明.
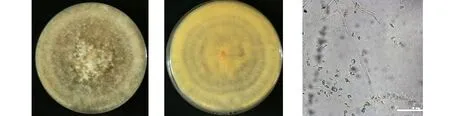
(a)菌落形态A (b)菌落形态B (c)光学显微结构
2.2.2 PJ3菌株ITS分子鉴定 PJ3菌株的ITS 扩增后进行测序,将序列提交 GenBank 获得登录号 KM387384.根据数据库搜索进行BLAST比对.结果表明:PJ3菌株ITS基因序列与Ceratobasidiumsp.AG-V具有97.96%的相似性.选择已知的20种不同角担菌属序列,利用MEGA 7.0构建PJ3菌株的系统发育树,如图3所示.从图3的结果初步鉴定,菌株PJ3为角担菌属(Ceratobasidium)中的一员.
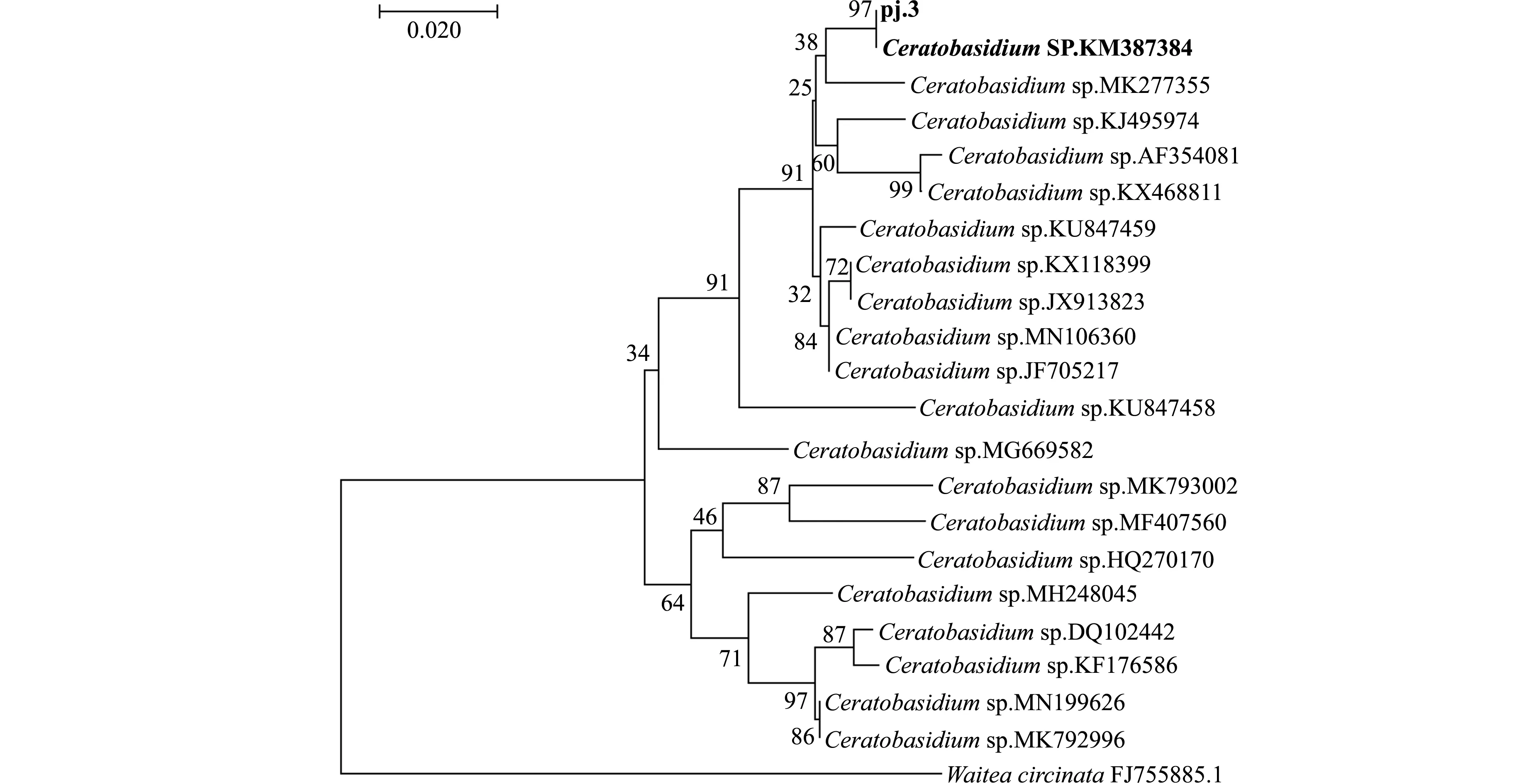
图3 基于ITS 基因序列构建的PJ3及相关菌株系统发育树
2.3 培养条件优化
2.3.1 培养时间 PJ3培养时间对菌株PJ3分泌IAA的影响,如图4所示.图4中:ρIAA为IAA质量浓度;t为培养时间.由图4可知:PJ3菌株在培养过程中,IAA质量浓度呈现先增加后稳定的趋势;从24 h到108 h,菌株快速产IAA;108 h时,PJ3菌株产IAA量达到最大值,为108.78 μg·mL-1,随后趋于稳定.因此,可以确定最佳取样时间为132 h.
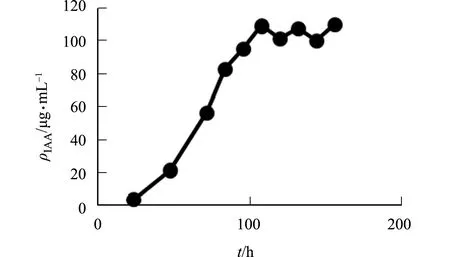
图4 菌株产IAA浓度随着培养时间变化
2.3.2 碳源和氮源 不同碳源、氮源对菌株PJ3分泌IAA的影响,如图5所示.图5中:ρIAA,ρC,ρN分别为IAA和碳源(葡萄糖)、氮源(酵母浸粉)的质量浓度.
从图5(a),(b)可知:当碳源为葡萄糖,其分泌IAA质量浓度最高,为122.61 μg·mL-1;不同葡萄糖添加量以15 g·L-1为最佳,IAA质量浓度高达124.81 μg·mL-1.从图5(c),(d)可知:当氮源为酵母浸粉时,其分泌IAA质量浓度显著高于蛋白和牛肉膏组(P<0.05),添加量为10 g·L-1时,最高达到193.36 μg·mL-1.综上所述,当碳源为葡萄糖,氮源为酵母浸粉时,菌株PJ3分泌IAA量最大.

(a)不同碳源 (b)碳源添加量
2.3.3 PJ3菌株发酵条件筛选 不同的装液量、pH值、摇床转速下,PJ3菌株分泌IAA能力如图6所示.图6中;φ为装液量(体积分数);ω为摇床转速.从图6可知:装液量为28%时,PJ3菌株分泌IAA量显著高于其他组;pH值为6时,PJ3菌株分泌IAA量最佳,IAA质量浓度为182.59 μg·mL-1;摇床转速为180 r·min-1时,PJ3菌株分泌IAA量最佳,IAA质量浓度为181.62 μg·mL-1.

(a)装液量 (b)pH值 (c)摇床转速
2.3.4 正交试验结果分析 表2为正交试验设计表,表3为正交试验结果的极差分析.表2中:ρIAA为IAA质量浓度.从表2,3可知:5个因素对PJ3菌株分泌IAA的影响顺序为 B>C>D>E>A,最佳水平组合为A1B2C2D2E2,产量为193.59 μg·mL-1.
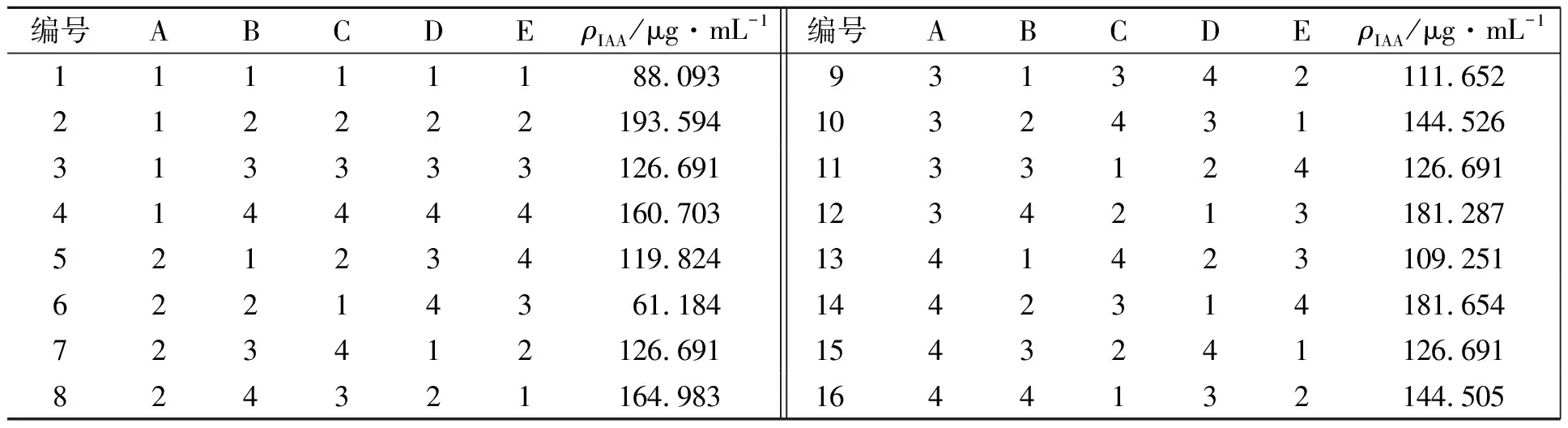
表2 正交试验设计表
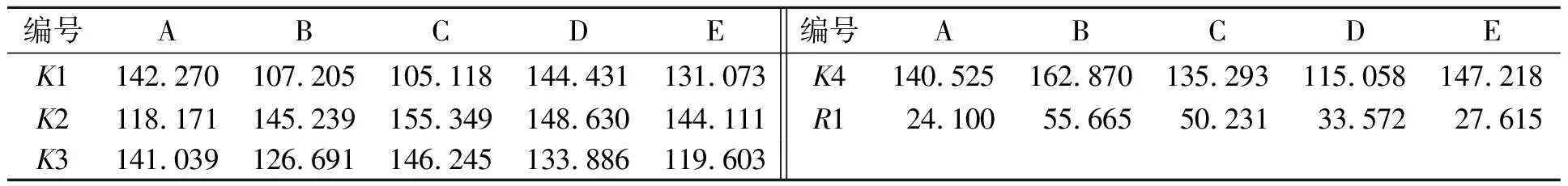
表3 正交试验结果极差分析
IAA产量方差分析结果,如表4所示.从表4可知:B因素对PJ3菌株分泌IAA的影响显著高于其他几个因素.综合可知,最佳组合为A1B2C2D2E2,即1 L发酵培养基中含葡萄糖10.0 g、酵母浸粉15.0 g、装液量(体积分数)为28%,初始pH值为5,摇床转速为180 r·min-1.
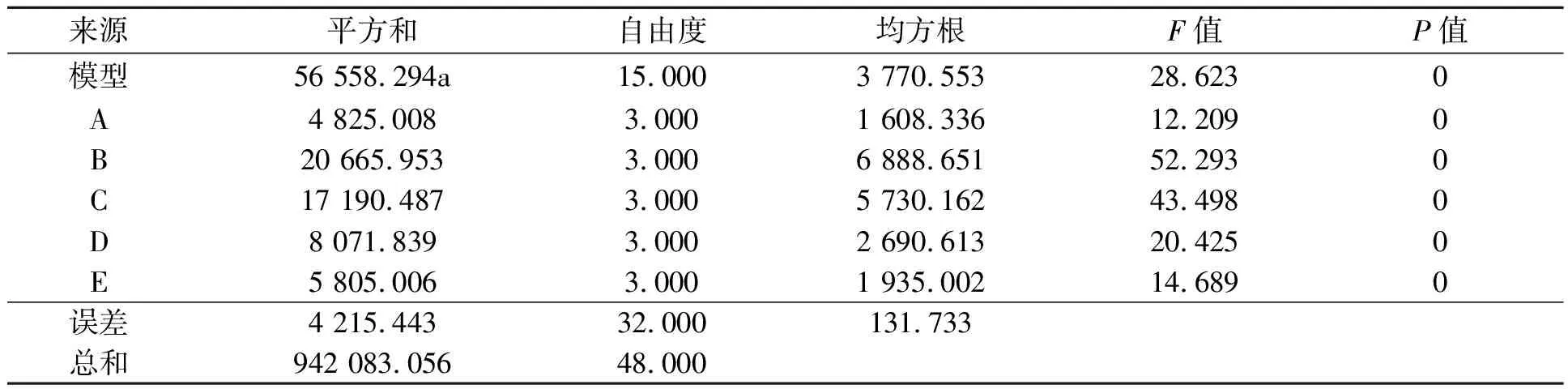
表4 IAA产量方差分析
3 讨论
植物内生菌种类多样性取决于自身和寄主种类多样性,以及寄主不同部位分布的可选性[19].目前,关于金线莲内生菌分离的报道较少,研究主要集中在金线莲组织培养优化和药物成分分析上.植物内生菌对植物本身几乎无毒,通过生物控制和生物施肥,从根系进入植物体内并行使相关功能,因此,内生菌促进植物生长将更有效[20-21].
角担菌是一大类与陆生兰花形成共生关系的兰花菌根真菌(OMF),对于种子萌发和维持兰花的自然种群至关重要[22].最近,Zhang等[22-23]发现Ceratobasidiumsp.AR2菌株和野生金线莲共培养促进了金线莲生长,并增加了黄酮类化合物和糖苷积累,但在我国关于角担菌属产IAA的能力鲜有报道.本研究从金线莲品种‘红霞’健康植株的茎中分离到1株内生真菌PJ3,经ITS序列及进化树分析鉴定菌株为Ceratobasidium.因此,推测该菌株能够促进金线莲品种‘红霞’的生长,检测发现其产IAA的特性较好,产量为106.78 μg·mL-1.
众多研究发现,优化促生菌发酵条件可以提高菌丝体生长量、IAA产量及促生效果[18].葛春辉等[15]和李引等[24]通过正交试验发现氮源是影响菌株产IAA的主要因素,Shokri等[25]也发现氮源是菌株产IAA的主要因素,并且当KNO3为氮源的IAA产率最高.本研究将PJ3产IAA产量作为重要考量指标,根据单因素试验和正交设计试验对其发酵条件进行优化,确定了菌株最优发酵条件为:葡萄糖10.0 g·L-1、酵母浸粉15.0 g·L-1、装液量(体积分数)为28%,初始pH值为5,摇床转速为180 r·min-1,试验结果比未优化前IAA产量提高了81.30%.此外,主要影响PJ3菌株产IAA的因素为氮源含量,本试验为金线莲的菌剂开发提供了一定的借鉴.
