应用UPLC-Q-TOF-MS/MS技术分析生物诱导后雷公藤悬浮细胞化学成分
2022-05-11张景红何秀枝戴培委
张景红,何秀枝,戴培委
(1.华侨大学 医学院,福建 泉州 362021;2.华侨大学 分子药物研究院,福建 泉州 362021)
雷公藤(TripterygiumwilfordiiHook.f.)属卫矛科植物,被列为福建省道地药材,具有抗炎、抗肿瘤、抑制免疫等药理作用,临床上主要用于治疗类风湿性关节炎、强直性脊柱炎、肾脏疾病、系统性红斑狼疮、自身免疫性疾病和皮肤病等疾病[1].目前,已从雷公藤中分离出380多种化学成分,主要为二萜类、三萜类和倍半萜类生物碱等.虽然利用化学提取法、化学合成法、人工栽培及半合成法都已经得到多种雷公藤类的成分单体,但是从生长年限7 a以上的雷公藤原药材中提取的雷公藤甲素质量比仅为120 mg·kg-1[2],与目前日益增长的需求相比,雷公藤新药的开发仍显得远远不足.
针对这一现状,国内外学者体外培养雷公藤悬浮细胞、发状根和不定根,并采用各种生物和非生物诱导子对系统进行调控研究,研究结果发现,生物诱导后雷公藤悬浮细胞、发状根和不定根的雷公藤甲素、雷公藤红素、雷公藤次碱、雷公藤定碱和雷公藤吉碱等活性成分的质量比大幅度提升[3-9],而其他成分的质量比提升仍旧有限.
鉴于各种雷公藤体外培养体系中其他成分的质量比较低、难以分离这一现状,本文利用超高效相色谱-四级杆-飞行时间质谱连用技术(UPLC-Q-TOF-MS/MS)和化学计量学对悬浮细胞中微量特征峰进行表征和分析,比较诱导前后悬浮细胞和培养液中化学成分的变化.
1 实验材料与方法
1.1 实验材料
1.1.1 雷公藤 雷公藤由福建省三明市汉堂生物制药股份有限公司雷公藤GAP(good argricultine practice)种植基地提供,经扦插至华侨大学医学院试验基地.
1.1.2 仪器 UPLC-Q-TOF-MS/MS(美国应用生物系统公司)
1.1.3 试剂 MS(murashige and skoog)固体培养基、6,7-V液体培养基(北京海博生物技术有限公司);茉莉酸甲酯(MeJA,质量分数≥95%)、酵母提取物(Ye,质量分数≥98%,上海晶纯实业有限公司);硝酸银(AgNO3,上海国药化学试剂有限公司);乙腈、甲醇均为色谱纯(上海麦克林试剂公司).
1.2 实验方法
1.2.1 雷公藤悬浮细胞体系的建立 选取扦插雷公藤嫩叶,分别用体积分数为75%的酒精、质量分数为0.1%的氯化汞(HgCl2)和无菌水清洗后,切成0.5 cm×0.5 cm左右的方块,接种于40 mL的MS固体培养基中.雷公藤愈伤组织培养至4代之后,将生长状态良好、质地疏松的雷公藤愈伤组织转入6,7-V液体培养基中进行悬浮细胞培养,继代培养后,加入联合诱导子(MeJA浓度为80 mol·L-1,Ye质量浓度为 1 g·L-1,AgNO3质量浓度为0.1 mg·L-1),培养期间检测指纹图谱,分析化学成分的质量比变化,待其质量比达标后,即得到诱导后雷公藤悬浮细胞体系.
1.2.2 悬浮细胞中化学成分的分离 将悬浮细胞烘干后,用适量乙酸乙酯回流提取,并合并提取液.使用旋转蒸发仪回收溶剂,残渣蒸干后,用适量的甲醇溶解.将适量甲醇溶解液和硅胶粉末混合拌样,上样,硅胶填料量为20 g.依次用200 mL不同比例的石油醚与乙酸乙酯洗脱液(石油醚∶乙酸乙酯分别为9∶1,8∶2,7∶3,6∶4,5∶5,4∶6,3∶7,2∶8,1∶9,0∶10)进行洗脱,收集10个馏分洗脱液.使用旋转蒸发仪回收溶剂,残渣蒸干后,加适量的甲醇溶解成100 μg·mL-1的溶液,经 0.22 μm微孔滤膜过滤,装于进样瓶中保存备测.
1.2.3 培养液中化学成分的分离 将培养液与等体积石油醚充分混合,重复萃取3次,再用 1/2 体积的乙酸乙酯萃取 3 次,合并萃取液,使用旋转蒸发仪回收溶剂,残渣蒸干后,用适量的甲醇溶解备用.
1.2.4 色谱分析方法 采用UPLC-Q-TOF-MS/MS分析各种提取液的化学成分,色谱柱为 Acqity Uplc BEH C18(1.7 μm);柱温为25 ℃;流动相为乙腈,流动相水梯度洗脱;流速为0.25 mL·min-1;进样量为10 μL.
流动相梯度洗脱条件,如表1所示.表1中:t为时间;w为质量分数;V为流速.
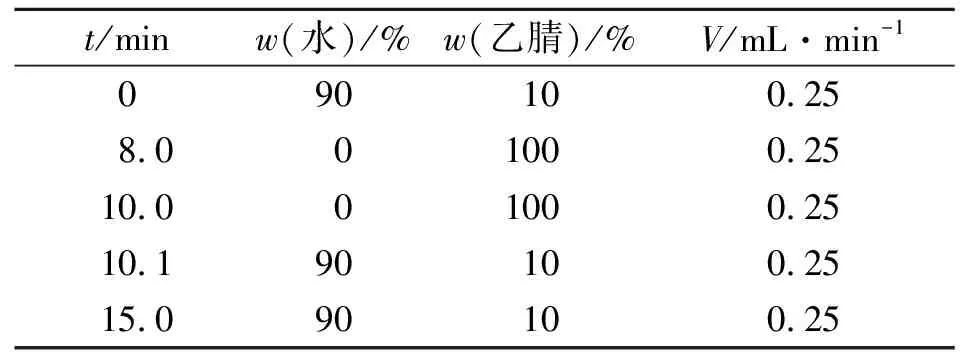
表1 流动相梯度洗脱条件
1.2.5 数据处理的方法 UPLC-Q-MS/MS的数据由Analyst软件分析,样品相似度、聚类、共有峰等由ChemPattern软件(北京科迈恩科技有限公司)分析.根据解卷积色谱峰提供的化合物特征碎片离子信息,自动匹配不同样品所表征的成分.以化合物的色谱分离信息(色谱峰保留时间)为主,结构信息(化合物的解卷积质谱)为辅,匹配化合物的质谱信息.
2 实验结果与分析
2.1 悬浮细胞和培养液指纹图谱的建立
悬浮细胞和培养液的总离子流叠加色谱,如图1所示.图1中:4-67-0-PYY为诱导0 d的培养液;4-67-0-XF为诱导0 d的悬浮细胞;4-67-5-PYY为诱导5 d的培养液;4-67-5-XF为诱导5 d的悬浮细胞;4-67-7-PYY为诱导7 d的培养液;4-67-7-XF为诱导7 d的悬浮细胞;4-67-9-PYY为诱导9 d的培养液;4-67-9-XF为诱导9 d的悬浮细胞;I为强度.
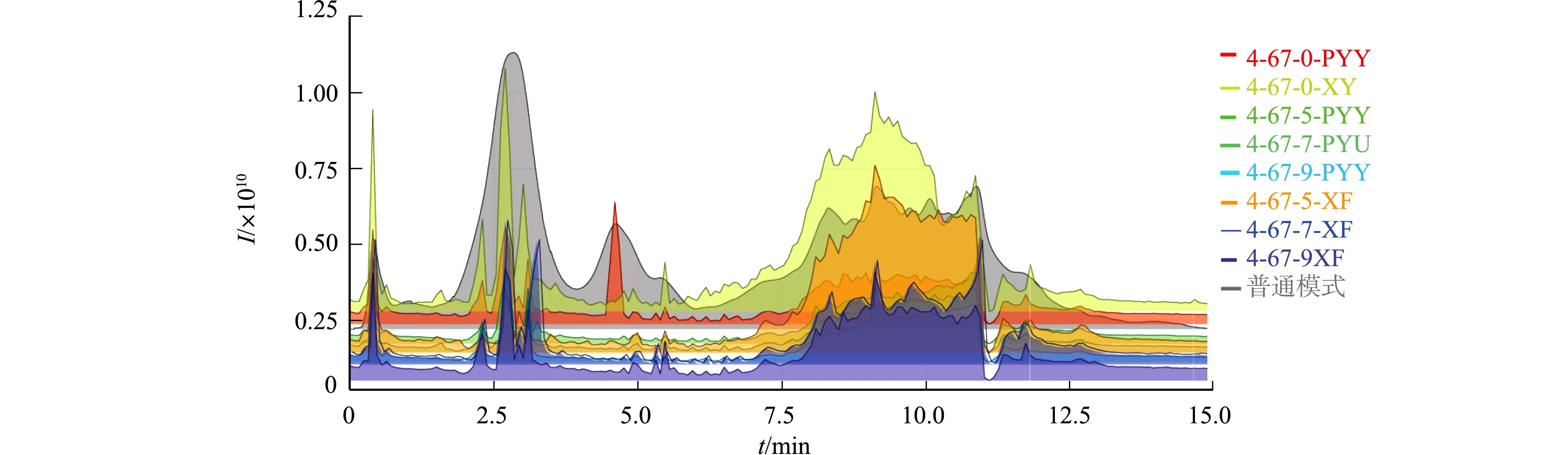
图1 悬浮细胞和培养液的总离子流叠加色谱
悬浮细胞和培养液的总离子流共有模式色谱,如图2所示.由图2可知:共有模式图谱得到554个共有峰的质谱指纹图谱;诱导后的悬浮细胞及其培养液的色谱峰群峰密集;诱导后峰面积增幅较大;诱导后化学成分群从悬浮细胞向培养液流动,生物诱导促进了多种化学成分的溶出和积累.

图2 悬浮细胞和培养液的总离子流共有模式色谱
2.2 相似度、聚类(HCA)分析和主成分分析(PCA)
悬浮细胞和培养液的总离子流差异性分析,如图3所示.图3中:1为诱导0 d的培养液;2为诱导0 d的悬浮细胞;3为诱导5 d的培养液;4为诱导7 d的培养液;5为诱导9 d的培养液;6为诱导5 d的悬浮细胞;7为诱导7 d的悬浮细胞;8为诱导9 d的悬浮细胞.
实验通过ChemPattern软件中夹角余弦法计算各样品相似度,并与共有模式进行比较,如图3(a)所示.由图3(a)可知:2号样品的相似度为0.95,与共有模式有较强相似性,而其余样品的相似度比共有模式低;3,4,5,6,7,8号样品的相似度一致;1号样品的相似度比其余样品偏低.

(a)相似度
各样品聚类分析的检测结果,如图3(b)所示.图3(b)中:样品分为3类,第Ⅰ类包含4,3,5,6,7,8号6个样品,第Ⅱ、Ⅲ类均包含1个样品,分别为1,2号;s为距离.由图3(b)可知:诱导后的悬浮细胞及其培养液中的次生代谢产物有密切的化学亲缘关系,但是与诱导前的化学关系疏远.
各样品主成分分析结果,如图3(c)所示.图3(c)中:S为得分.由图3(c)可知:PC1累积方差为90.02,PC2累积方差为100.00,因此,样品间100%的差异满足数据分析要求,说明诱导前后悬浮细胞和培养液中主成分变化较大,具有显著的差异.诱导后.不论是悬浮细胞还是培养液,其化合物的种类和质量比都有很大的不同,相似度差异明显.
2.3 悬浮细胞和培养液中化学成分的变化
通过对雷公藤离体培养体系中的质谱指纹图谱的比对,鉴定了104种化学成分,70个共有峰,其中,悬浮细胞共有成分有44种,已鉴定的有33种,而培养液中共有成分有26种,已鉴定的有19种.诱导后,在悬浮细胞和培养液中化学成分均发生较大的变化.
在悬浮细胞中,雷公藤甲素的质量比提高了1.24倍,而雷公藤内酯乙、山海棠酸衍生物1、TH1、雷公藤甲素衍生物2、雷酚内酯、雷公藤甲素衍生物1和雷酚新内酯的质量比则分别提高了7.41,6.50,6.07,5.85,3.63,1.59,1.13倍,其m/z值分别为224,278,678,701的未鉴定成分的质量比分别提高了2.88,1.57,4.04,6.27倍.在培养液中,诱导子能有效提高31种化合物的质量比,已鉴定的萜类有11种,分别为雷公藤甲素、雷公藤红素、雷公藤甲素衍生物5、雷公藤甲素衍生物2、棓儿茶酸(gallocatechin)、雷酚萜甲醚衍生物1、TH1、TH5、齐墩果酸、儿茶素和雷酚萜;已经鉴定的生物碱有1种,为雷公藤酸C;未鉴定的化合物有19种,其m/z值分别为223,227,246,278,287,301,309,339,362,374,383,464,475,481,539,566,685,700,905.
在悬浮细胞中,雷公藤甲素衍生物1、雷酚新内酯、wilformine A的质量比分别提高了2.05,2.18和1.08倍;在培养液中,m/z值为224的未鉴定成分的质量比升高最显著,提高了8.11倍,而m/z值为409和701的未鉴定成分的质量比分别升高了1.01和2.14倍.说明诱导促进了多种代谢产物从悬浮细胞中转移,无论从化合物的类别或种类上都与悬浮细胞有很大的差异,培养液中也出现了各种代谢产物的积聚和变化.经过共有峰比对和并参阅参考文献[10-13],可以得到部分共有峰的化学信息确认和分析,如表2所示.
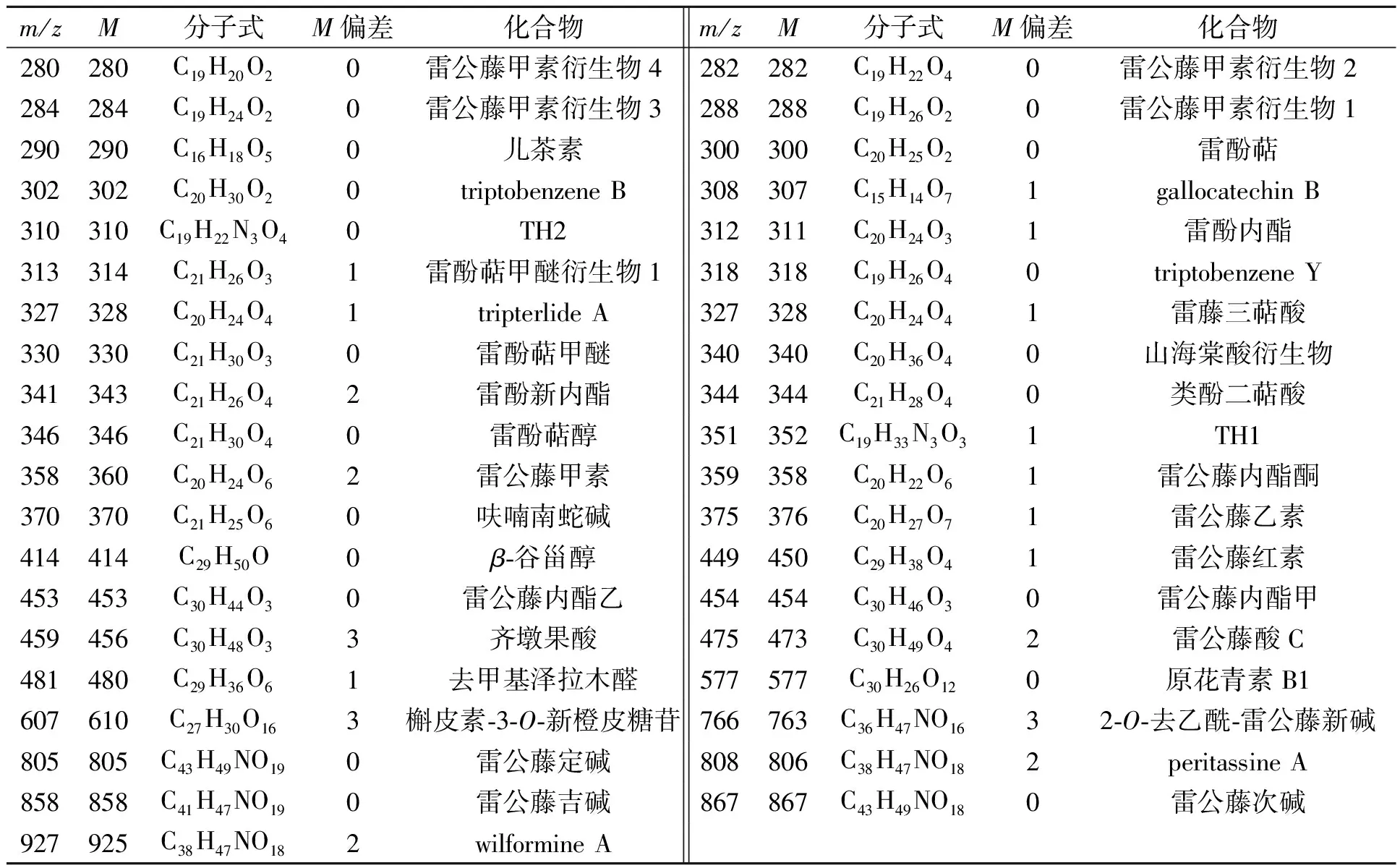
表2 部分共有峰的化学信息确认和分析
3 结论
利用UPLC-Q-TOF-MS/MS[14-15]和化学计量学[8]成功建立了含有554个共有峰的质谱指纹图谱.以往对雷公藤悬浮细胞中的色谱分析大多以雷公藤甲素、雷公藤吉碱和雷公藤次碱3种化学成分为主,涉及的种类和数量均较少[16-17].Zeng等[13]利用液相和质谱联合的分析方法,确定18种雷公藤药材中的化学成分.刘超等[10]利用UPLC-Q-TOF-MS/MS建立雷公藤叶片的指纹图谱,结合化学计量学进行PCA分析,鉴定了23种与昆明山海棠叶片差异的代谢物.但是鲜有对雷公藤离体细胞培养体系进行全成分、全景式的指纹图谱鉴定和分析,可能是因为雷公藤药材生长周期长达20 a,许多活性成分质量比极低.生物诱导和体外培养技术成功提高雷公藤中活性成分的质量比,将雷公藤类指纹图谱表征的化学成分数量从23种,提高到554种,这对于整体挖掘雷公藤类整体活性成分、建立雷公藤离体培养体系的评价标准都是有积极意义的.
通过对诱导前后悬浮细胞的化学成分分析,发现诱导子对悬浮细胞本身的固有成分有促进和积聚作用,例如,悬浮细胞诱导后,可增加19种成分,其中,已知成分共有10种,萜类产物共有7种,分别为棓儿茶酸、雷酚萜甲醚、tripterinin、雷酚萜、TH5、雷酚萜甲醚衍生物1和雷公藤红素;而生物碱类成分则有3种,包括wilformine A、雷公藤酸C和wilforsinine B.另外,未鉴定成分有9种,其m/z值分别为222,246,339,409,453,685,579,679和701.雷公藤内酯乙、山海棠酸衍生物1、TH1和雷公藤甲素衍生物1的质量比分别提高了7.41,6.50,6.07,1.59倍,m/z值为453,224,278,678,701的未鉴定化合物质量比分别提高了7.40,2.88,1.57,4.04,6.27倍.结合化学计量学分析和UPLC-Q-TOF-MS/MS,对雷公藤离体培养体系中的多种化学成分进行分析和表征,这不仅为雷公藤的整体化学成分的表征提供了有益的思路,也为雷公藤的活性成分评价和药效基础的研究提供了理论依据和技术方法.
诱导后,培养液中化学成分种类也变得极为丰富,部分产物的质量比极大地提高,特别是部分水不溶解的次生代谢产物从悬浮细胞中发生代谢流,从而转移积聚到培养液中.诱导子促进了18种化合物在培养液中的快速积累,已鉴定的萜类成分有11种,分别为雷公藤甲素、雷公藤红素、雷公藤甲素衍生物5、雷公藤甲素衍生物2、棓儿茶酸、雷酚萜甲醚衍生物1、TH2、TH5、齐墩果酸、儿茶素和雷酚萜;已鉴定的生物碱有1种,为雷公藤酸C;未鉴定的化合物有6种,其m/z值分别为227,246,278,339,685,579.目前未见到相关诱导子可以同时对18种萜类和生物碱进行调控.诱导子不仅对未知的代谢产物调控非常显著(m/z值为224和701产物的质量比分别提高了8.22,8.14倍),而且可以提高已知成分包括雷公藤甲素衍生物1、雷酚新内酯和雷公藤甲素衍生物4的质量比(分别提高了2.05,2.22和1.16倍).这是因为这些成分质量比较低,难于分离,且生物诱导子可以调控特殊的代谢酶,启动代谢酶调控代谢流的快速流动,次生代谢产物从悬浮细胞中发生代谢流,转移积聚到培养液中.实验也发现部分成分存在诱导子抑制现象,这可能与诱导子对不同代谢酶的调控机制不同有关.试验不仅为雷公藤活性成分的挖掘提供了有效的技术方法,而且为解决雷公藤类药材野生资源匮乏的问题提供了有意义的探索,具有一定的实际应用价值.
