基于降低氧化应激损伤探究解毒益智方改善APP/PS1阿尔茨海默病小鼠神经毒性作用机制
2022-05-11王田野张鹏起朱晓婷冯丽娜王嘉乐崔婷婷黎明全
王田野 张鹏起 朱晓婷 冯丽娜 王嘉乐 崔婷婷 黎明全
(长春中医药大学 1中医学院,吉林 长春 130017;2附属第三临床医院脑病中心三疗区;3中西医结合学院)
阿尔茨海默病(AD)临床主要症状为学习、认知及记忆力下降甚至丧失〔1〕,其发病受诸多因素影响,目前最为主流的学说为β淀粉样蛋白(Aβ)沉积。Aβ沉积可受多种因素调控,其中氧化应激状态可对其沉积造成影响,如因应激状态产生大量活性氧(ROS)〔2〕,使大多数抗氧化剂酶活性减弱,诱发多种产物,进一步引发后续恶性级联反应如神经元细胞总体数量减少、形态萎缩、能量代谢异常、线粒体功能异常,最终使Aβ沉积,导致机体出现认知障碍和衰老等〔3〕。本课题组多年来一直从事AD的临床研究及基础研究,创新提出“髓虚毒损”是AD发病的病机关键〔4〕,并结合“上下交损,当治其中〔5〕”创立解毒益智方(JDYZF),在临床应用多年,疗效显著。课题组认为AD病机为肾精亏虚,脑髓难以充养,气血津液不能循行,瘀毒内生,神机失用,发为本病〔6〕。解毒益智方由黄连、益智仁、川芎、地龙、龟板胶、山萸肉、酒大黄七味药按比例(1∶2∶1∶1∶1∶1∶1)组成。黄连,泻火燥湿解毒〔6〕;益智仁,充养脑髓、固摄肾精,配伍山茱萸,补益肝肾阴精,配伍龟板胶,补肾中元阳,三药阴阳同补,加之补益肝阴,气血充盈,使元神得以充养;酒大黄与黄连相合共奏清上焦火热之功,亦有活血化瘀之能;川芎和地龙,走窜之性共同发挥活血行血通络功效,使神清语明。七药配伍,标本兼治,既补益虚损,又祛瘀生新,从而治疗AD〔7,8〕。
JDYZF中多糖混合物是通过上调氧化应激相关基因寿命调控因子(daf-16)、热休克因子(HSF)-1的表达量实现对线虫的神经毒性保护作用〔9〕,降低AD CL4176线虫瘫痪率并延长其寿命。但JDYZF对于AD双转基因鼠在氧化应激调控机制的相关研究尚未开展。本研究采用淀粉样前体蛋白β/早老素(APP/PS)1双转基因AD小鼠为实验动物,以JDYZF为干预手段,探究JDYZF对AD小鼠的空间学习记忆能力的影响,明确JDYZF通过调控机体的氧化应激水平对AD小鼠神经毒性起到保护作用。
1 材料与方法
1.1材料 JDYZF由黄连(拉丁名:Coptis chinensis Frach.,批号190802);益智仁(拉丁名:Fructus Alpinae Oxyphyllae.,批号 045200303);地龙(拉丁名:Pheretima aspergillum.,批号 C20053007);山茱萸(拉丁名:Cornus officinalis,批号 494191101);酒大黄(拉丁名:Radix Et Rhizoma Rhei,批号 494191101);龟板胶(拉丁名:Chinemys reevesii,批号 494191101);川芎(拉丁名:Rhizoma Chuanxiong,批号 494191101)组成,中药饮片均由吉林省宏检大药房有限公司提供。多奈哌齐(卫材药业有限公司,批号 2012045)购于长春中医药大学附属第三临床医院。谷胱甘肽过氧化物酶(GSH-Px,南京建成生物工程研究所有限公司,A003-1);超氧化物歧化酶(SOD,南京建成生物工程研究所有限公司,A005-1);试剂盒丙二醛(MDA,南京建成生物工程研究所有限公司,A001-3)。PCR引物设计(上海生物工程股份有限公司)。Morris水迷宫操作系统(安徽淮北正华生物仪器设备公司,ZH0065);万分之一电子天平(Sartorius 公司,BT125D);生物显微镜(Nikon公司,CI-L)。
1.2实验方法
1.2.1动物实验与分组 APP/PS1双转基因AD小鼠40只(SPF 级4月龄,雄性)、野生型 C57BL/6小鼠10只,均购于南京君科生物科技股份有限公司〔许可证号:SCXK(苏)2020-0009〕。动物在适应性饲养〔温度(25±1)℃,相对湿度(60±5)%,自由摄食水,12 h~12 h明暗交替〕7 d后,随机将双转基因AD小鼠分为4组,模型组(n=10)、多奈哌齐组(n=10)、JDYZF低剂量组(n=10)、JDYZF高剂量组(n=10),C57BL/6小鼠(n=10)为空白组。多奈哌齐组给予浓度0.45 g/kg盐酸多奈哌齐,低、高剂量组分别给予10 g/kg及20 g/kg的JDYZF,空白组和模型组分别给予等体积生理盐水,连续灌胃8 w。动物实验操作均获得长春中医药大学实验动物伦理委员会批准。
1.2.2Morris水迷宫实验 实验前APP/PS1双转基因鼠进行行为学训练(4个象限入水后,记录小鼠在120 s内找到站台所需要时间,即逃避潜伏期),每只动物每天固定时间训练一次,连续训练4 d后,将平台撤去,进行空间探索实验,记录其运行轨迹及在120 s内动物穿台次数、目标象限停留时间。
1.2.3动物取材 水迷宫实验结束48 h后,摘眼球取血并置于1.5 ml EP管中,4 000 r/min,4℃离心获取血清,-80℃ 储存。灌流后冰上断头取脑获取小鼠两侧的海马组织,部分放入液氮保存,余下放置于-80℃待测。由于小鼠脑组织较小,每组随机取样品进行荧光定量PCR实验,一部分样品进行相关免疫组化实验,余下样品4℃ 保存于40 g/L多聚甲醛,进行病理切片实验。
1.2.4组织病理学检查 用10%的多聚甲醛固定新鲜的脑组织,经过石蜡包埋后切成4~5 μm的冠状切片并进行苏木素-伊红(HE)染色,在光镜下观察海马及皮层神经元的病理学变化。
1.2.5氧化指标检测 将小鼠海马组织用磷酸盐缓冲液(PBS)分别制成10 g/L的匀浆液(组织重量占匀浆液的比例为10%),样品准备完毕后用二喹啉甲酸(BCA)蛋白浓度测定试剂盒测定蛋白浓度,根据试剂盒指示说明测定小鼠海马组织匀浆上清液中SOD、GSH-Px及MDA的水平。
1.2.6免疫组化分析 将4℃保存于40 g/L多聚甲醛的海马组织取出,按照常规方法脱水并去除石蜡,将切片置于修复盒(柠檬酸抗原修复缓冲液)中,微波炉内进行抗原修复,自然冷却后,置于洗涤液中洗涤,3% H2O2溶液室温避光孵育25 min,3%牛血清白蛋白(BSA)均匀覆盖组织,室温封闭30 min。分别滴加SIRT1抗体(1∶500)、核基因-红系2相关因子(Nrf)2抗体(1∶200)、血红素氧合酶(HO)-1抗体(1∶1 000)4℃孵育过夜,滴加辣根过氧化物酶(HRP)标记山羊抗鼠二抗于37℃中孵育1 h,二氨基联苯胺(DAB)反应10 min显色后蒸馏水冲洗。后苏木素复染,冲洗,脱水,透明,封片后,于3DHISTECH切片扫描仪成像(阳性细胞呈现棕褐色或棕黄色)。
1.2.7Real-time PCR实验 通过Real-time PCR 检测小鼠海马区SIRT1、Nrf2、HO-1的mRNA的表达量。将小鼠海马组织放入液氮预冷的玻璃匀浆器中,加入Trizol裂解液冰上充分研磨后,离心取上清,加入三氯甲烷充分混匀后静置提取上清后加入异丙醇沉淀,4℃ 12 000 r/min离心10 min,弃上清,再次加75%乙醇洗涤后,离心弃上清,溶解RNA,55℃孵育5 min,依据试剂盒将总mRNA 逆转录为cDNA后进行PCR扩增,相应引物详见表1,按照反应条件:94℃,10 min;40×(94℃,15 s;59℃,15 s;72℃,30 s),进行荧光定量PCR,靶基因进通过2-ΔΔCt法计算相对表达水平。
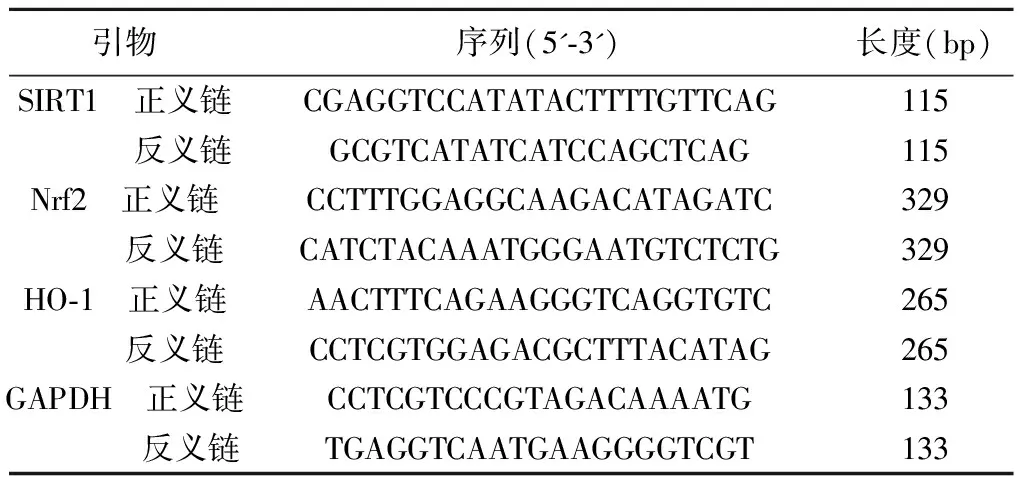
表1 引物序列
1.3统计学方法 采用SPSS26.0软件进行单因素方差分析。
2 结 果
2.1JDYZF对空间学习记忆能力的影响 模型组逃避潜伏期较空白组显著增加,穿越平台次数、目标象限停留时间均较空白组显著减少(P<0.05,P<0.01)。JDYZF高、低剂量组及多奈哌齐组小鼠逃避潜伏期、穿越平台次数、停留目标象限时间均较模型组显著改善,其中JDYZF低剂量组效果优于JDYZF高剂量组(P<0.05,P<0.01),见表2。

表2 各组Morris水迷宫实验结果
2.2JDYZF对海马CA1区神经元形态的影响 如图1所示,与空白组相比,模型组海马CA1区神经元细胞排列疏松,细胞体积缩小,细胞核紧缩,神经元细胞数量减少;JDYZF治疗后,神经细胞排列较为紧密,细胞核仁清晰,染色质丰满,数量明显增多,且JDYZF低剂量组与多奈哌齐组效果较为显著。
2.3JDYZF对氧化应激水平的影响 与空白组比较,模型组海马组织中总 SOD及GSH-Px活性显著下降(P<0.05),MDA含量明显增加(P>0.05);与模型组相比,给予不同剂量的JDYZF及盐酸多奈哌齐后,小鼠血清中SOD及GSH-Px显著增加,MDA表达量显著降低,其中多奈哌齐组和JDYZF低剂量组作用更优(P<0.05)。见表3。
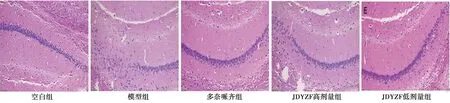
图1 JDYZF对APP/PS1小鼠海马CA1区神经元形态的影响(HE,×200)

表3 JDYZF对SOD、MDA、GSH-Px的影响
2.4JDYZF对海马组织SIRT1、Nrf2、HO-1免疫组化影响 与空白组相比,模型组中抗氧化蛋白SIRT1、Nrf2、HO-1的阳性细胞数明显减少;与模型组相比,JDYZF低剂量组、高剂量组及多奈哌齐组增加了SIRT1、Nrf2、HO-1的阳性细胞数,其中以JDYZF低剂量效果最为明显。见图2~4、表4。
2.5JDYZF对APP/PS1小鼠海马组织中 Nrf2、SIRT1、HO-1的mRNA表达水平的影响 与空白组比较,模型组 Nrf2、SIRT1、HO-1的mRNA 表达水平明显下降(P<0.05);与模型组比较,多奈哌齐组、JDYZF低、高剂量组SIRT1、HO-1、Nrf2 mRNA 表达水平均升高,除JDYZF高剂量组HO-1 mRNA外,差异均有统计学意义(P<0.05,P<0.01)。见表4。

图2 各组海马SIRT1免疫组化染色结果(×40)
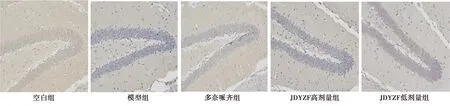
图3 各组鼠海马Nrf2免疫组化染色结果(×40)
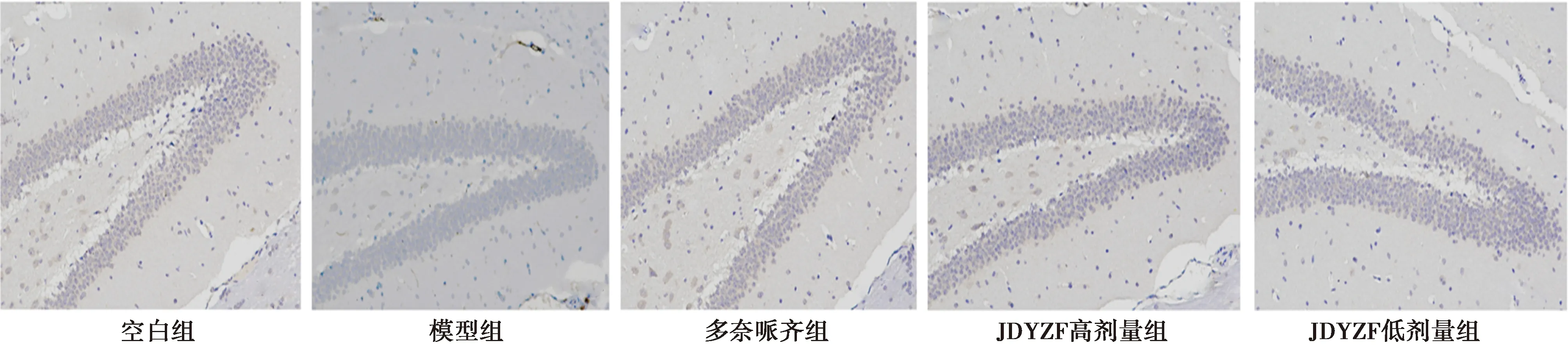
图4 各组海马HO-1免疫组化染色结果(×40)
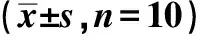
表4 各组SIRT1、HO-1、Nrf2阳性面积比率及mRNA比较
3 讨 论
AD作为一种不可逆的神经退行性疾病,其主要的临床表现为学习记忆功能的逐渐丧失及运动逐步减缓。机体的氧化应激失衡是AD发病的重要因素之一,AD患者体内自由基活性氧(ROS)水平升高,会加速细胞膜脂质过氧化〔10〕,导致细胞膜损伤及神经元细胞死亡进而加速AD发生及发展。
本研究Morris水迷宫实验表明JDYZF可以起到改善AD小鼠的学习和记忆能力。有研究表明,SOD及GSH-Px可清除体内多余的ROS,抑制其过度生成和积累,改善AD小鼠认知功能〔11〕。本实验验证JDYZF可通过提高对APP/PS1小鼠海马组织抗氧化能力起效。而Keap1/Nrf2信号通路对机体氧化应激反应具有一定调控作用,该信号通路的激活对延缓AD发病及对病情发展起重要作用。研究表明〔12〕AD模型小鼠海马组织中Nrf2,下游的抗氧化酶HO-1、NOQ1等mRNA水平降低,与Aβ淀粉样蛋白沉积相关。研究表明〔13〕AD患者脑中Nrf2的含量远低于正常人含量水平。向AD模型小鼠的海马组织中注射编码Nrf2的病毒载体可提高Nrf2、HO-1的mRNA表达量,明显改善小鼠的空间学习记忆能力〔14〕。另一项野生型和Nrf2缺陷型小鼠胚胎神经干细胞的体外试验研究表明〔15〕:Nrf2基因过表达能够减轻Aβ诱导的神经毒性,而Nrf2缺陷型干细胞中Aβ诱导的神经毒性明显加重。上述研究均表明Nrf2能够提高神经元细胞的抗氧化能力、对Aβ诱导的神经毒性具有保护作用,延缓AD进程。SIRT1可以将Nrf2快速激活,是Nrf2的上游调节因子〔16〕。SIRT1作为Nrf2的上游蛋白,是沉默信息调节因子(Sirtuins)家族的一员,可通过去乙酰化修饰降低ROS水平,促进神经元细胞存活,在AD发病和治疗中发挥重要保护作用〔17〕。
AD病变最常累及的部位为海马组织,其主要负责信息存储,与学习能力及记忆力呈正相关〔18〕,AD发生后,海马组织可出现老年斑〔19〕、神经元纤维缠结〔20〕和神经元大量丢失等。本实验结果提示JDYZF可能激活了SIRT1/Nrf2/HO-1信号通路,从而对AD小鼠海马组织的氧化应激损伤起到保护作用。同时,这一结果在APP/PS1小鼠海马组织的免疫组化实验中得到验证。JDYZF可通过调节SIRT1/Nrf2/HO-1信号通路对抗AD小鼠中氧化应激水平失衡起效。
