lncRNA SLC8A1-AS1在脓毒症大鼠心肌组织中的表达及其对心肌细胞凋亡和炎症因子分泌的影响
2022-05-11刘枫张韩李彦明王勇鲁雪丽
刘枫 张韩 李彦明 王勇 鲁雪丽
(河南大学淮河医院 1重症医学科,河南 开封 475000;2心血管内科)
ExpressionoflncRNASLC8A1-AS1inmyocardialtissueofsepsisratsanditseffectonmyocardialcellapoptosisandsecretionofinflammatoryfactors
LIUFeng,ZHANGHan,LIYan-Ming,etal.
DepartmentofCriticalCareMedicine,HuaiheHospitalofHenanUniversity,Kaifeng475000,Henan,China
【Abstract】ObjectiveTo investigate the expression of lncRNA SLC8A1-AS1 in myocardial tissue of sepsis rats and its effect on myocardial cell apoptosis and secretion of inflammatory factors.MethodsqRT-PCR method was used to detect the expression level of SLC8A1-AS1 in myocardial tissue of sepsis rats. Cardiac H9C2 cells were divided into Control group,LPS group(LPS was used to induce treatment),Vector+LPS group(negative control vector was transfected,LPS was used to induce treatment),SLC8A1-AS1+LPS group(SLC8A1-AS1 overexpression vector was transfected,LPS was used to induce treatment),SLC8A1-AS1+LPS+PMA group(transfected with SLC8A1-AS1 overexpression vector,NF-κB signal activator and LPS induction treatment).Cell proliferation was detected by MTT colorimetry,cell apoptosis was detected by flow cytometry,the levels of IL-1β,IL-6 and TNF-α secreted by cells were detected by ELISA,the expression of C-Caspase-3 and p65 protein in cells level changes were detected by Western blot.ResultsThe expression level of SLC8A1-AS1 in myocardium of sepsis rats was significantly decreased(P<0.05). Compared with the Control group,the proliferation activity of cardiomyocytes in the LPS group was significantly decreased,the apoptosis rate was significantly increased,the secretion of IL-1β,IL-6 and TNF-α were significantly increased,and the expression of C-Caspase-3 and p65 proteins in the cells were significantly increased(P<0.05).Compared with the Vector+LPS group,the proliferation activity of cardiomyocytes in the SLC8A1-AS1+LPS group was significantly increased,the apoptosis rate was significantly decreased,the secretion of IL-1β,IL-6 and TNF-α were significantly decreased,and the expression of C-Caspase-3 and p65 proteins in the cells were significantly decreased(P<0.05).Compared with the SLC8A1-AS1+LPS group,the proliferation activity of cardiomyocytes in the SLC8A1-AS1+LPS+PMA group was significantly decreased,the apoptosis rate was significantly increased,the secretion of IL-1β,IL-6 and TNF-α were significantly increased,and the expression of C-Caspase-3 and p65 proteins in the cells were significantly increased(P<0.05).ConclusionsThe expression of SLC8A1-AS1 is decreased in myocardial tissue of sepsis rats,up-regulation of SLC8A1-AS1 could reduce cardiomyocyte apoptosis and secrete inflammatory factors by inhibiting NF-κB signaling.
【Keywords】 Sepsis;Cardiomyocytes;SLC8A1-AS1;Inflammation;Apoptosis
脓毒症是由于微循环障碍、细胞凋亡等多种原因引起的全身多个脏器功能异常的疾病,凝血异常、心血管反应失调、内皮功能障碍是脓毒症的常见特征,心脏是脓毒症最常见的受损器官之一,约有一半的脓毒症患者伴有心肌损伤〔1〕。脂多糖(LPS)是常见的体外诱导脓毒症心肌细胞损伤的诱导因子,心肌细胞分泌炎症因子和过度凋亡是脓毒症心肌损伤发生的关键机制〔2〕。lncRNA是长度超过200 nt的长链非编码RNA,其通过RNA的形式调控多个生理活动,如细胞凋亡、新陈代谢、血管再生、心脏老化、胚胎发育等〔3〕。研究报道表明,lncRNA与缺氧复氧心肌损伤、脓毒症心肌损伤、糖尿病心肌病等心脏疾病有关〔4〕。研究发现,lncRNA SLC8A1-AS1在心肌梗死中表达下调,而上调SLC8A1-AS1改善心脏功能,减少炎症因子释放,缩小心肌梗死面积,SLC8A1-AS1可能是心肌损伤的保护因子〔5〕。现阶段对SLC8A1-AS1在脓毒症心肌细胞损伤中的作用尚不清楚。本实验首先检测了脓毒症大鼠心肌组织中SLC8A1-AS1表达水平,并以LPS诱导体外构建脓毒症心肌细胞模型,探讨SLC8A1-AS1在脓毒症心肌细胞炎症因子分泌和细胞凋亡中的作用,为靶向分子治疗脓毒症心肌损伤提供方向。
1 材料与方法
1.1材料 清洁级SD大鼠购自郑州大学实验动物中心,体重180~200 g,雌雄各半。大鼠心肌H9C2细胞购自深圳市拓普生物科技有限公司;肿瘤坏死因子(TNF)-α含量检测试剂盒购自深圳市科润达生物工程有限公司;酶切含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)-3抗体购自北京百奥莱博科技有限公司;白细胞介素(IL)-6含量检测试剂盒购自武汉艾美捷科技有限公司;RNA反转录试剂盒购自大连TaKaRa;IL-1β含量检测试剂盒购自上海研谨生物科技有限公司;p65抗体购自美国Santa Cruz Biotechnology;阴性对照表达载体(pcDNA)、SLC8A1-AS1过表达载体(pcDNA-SLC8A1-AS1)均由武汉金开瑞生物工程有限公司构建。
1.2脓毒症心肌损伤大鼠模型构建 Model组大鼠按照下述方法构建模型〔6〕:用10%水合氯醛麻醉大鼠,将大鼠仰卧置于操作台上,消毒,于大鼠的前腹部中线行3 cm剖腹手术,将腹腔打开,分离盲肠,以3.0无菌丝线结扎盲肠,并用16号针头将结扎位置对穿2次,挤压盲肠,观察穿孔位置出现少量粪便时,将盲肠返回,缝合,关腹,将切口消毒。Normal组大鼠不做穿刺,其余同Model组。最后每组剩余9只。各组大鼠在造模后24 h,再次以水合氯醛麻醉,处死,打开胸腔,留取心肌组织。
1.3qRT-聚合酶链反应(PCR)检测脓毒症大鼠心肌组织中SLC8A1-AS1表达 利用Trizol试剂分别提取心肌组织中的总RNA,以RNA反转录试剂盒获得第1条cDNA,反转录体系如下:1 μl的总RNA、1 μl的5×gDNA Eraser Buffer、1 μl的gDNA Eraser、6 μl的无RNA酶水,放在42℃孵育2 min。继续在上述体系中添加4 μl的5×PrimerScript Buffer、1 μl的RT Primer mix、1 μl的PrimerScript RT Enzyme mixI、10 μl的Reaction mix before,最后添加RNase free dH2O至20 μl,放在37℃孵育15 min,放在85℃孵育5 s,置于4℃保存。取cDNA,配制如下体系:2 μl的上游和下游引物、5 μl的cDNA模板、0.4 μl的DYE II、10 μl的2×SYBR RT-PCR mix,最后添加ddH2O至20 μl。置于PCR仪中,设置程序为:95℃ 30 s(预变性),95℃ 5 s(变性),60℃退火延伸,循环40次。结果以甘油醛-3-磷酸脱氢酶(GAPDH)作为参照,以2-△△Ct法计算SLC8A1-AS1表达水平。
1.4细胞转染和分组 心肌H9C2细胞分为以下4组:(1)Control组:正常培养;(2)LPS组:在实验0 h时用10 μg/ml的LPS处理培养;(3)Vector+LPS组:在实验前12 h,在细胞中转染阴性对照表达载体,然后在实验0 h时,用10 μg/ml的LPS处理培养;(4)SLC8A1-AS1+LPS组:在实验前12 h,在细胞中转染SLC8A1-AS1过表达载体,然后在实验0 h时,用10 μg/ml的LPS处理培养。细胞转染方法按照Lipofectamine 2000转染试剂说明书进行。取培养12 h以后的各组细胞,按1.3方法检测SLC8A1-AS1表达变化。
1.5方法
1.5.1四甲基偶氮唑蓝(MTT)比色法检测细胞增殖 将心肌细胞按1.4分组方法接种到96孔板中,每个孔内接种104个细胞,细胞培养12 h后,在每孔中添加10 μl的MTT溶液,继续放在37℃孵育4 h。将上清溶液弃掉,加入100 μl的二甲基亚砜溶液,在37℃孵育10 min。检测490 nm的OD值。计算细胞存活率。
1.5.2流式细胞术检测细胞凋亡 收集培养12 h后各组细胞,将细胞用磷酸盐缓冲液(PBS)反复洗涤2次。用PBS将细胞密度调整为1×106个细胞/ml。取1 ml的细胞悬浮液,1 000 r/min离心10 min,将上清弃掉,PBS洗涤1次,添加300 μl的结合缓冲液,添加5 μl的Annexin V-FITC,于室温结合20 min,继续加入5 μl的碘化丙啶(PI),在室温反应20 min。添加200 μl的结合缓冲液,用流式细胞仪检测。
1.5.3酶联免疫吸附试验(ELISA)检测IL-1β、IL-6、TNF-α水平 收集培养12 h后各组细胞培养液上清,分别用ELISA检测培养液上清中IL-1β、IL-6、TNF-α含量,步骤完全按照IL-1β含量检测试剂盒、IL-6含量检测试剂盒、TNF-α含量检测试剂盒的说明书进行。
1.5.4Western印迹检测酶切Caspase-3、p65蛋白表达变化 培养12 h后各组细胞中添加放射免疫沉淀试验(RIPA)裂解液,放在冰上充分裂解20 min,15 000 r/min离心10 min,吸取上清溶液转移至新的EP管中,放在-80℃保存。根据二喹啉甲酸(BCA)蛋白浓度检测试剂盒测定蛋白含量。根据常规方法制备10%分离胶和5%浓缩胶。在蛋白样品中添加1/5体积的6×上样缓冲液,放在100℃孵育10 min。每个孔内添加40 μg的蛋白样品。在浓缩胶中采用70 V的电压电泳,30 min后,肉眼可见蓝色染料进入到分离胶,此时将电压调整为100 V继续电泳,观察蓝色染料进入到分离胶的底部后,停止电泳。将聚偏氟乙烯(PVDF)膜放在甲醇中浸泡1 min。设置100 V的电压电泳2 h。将PVDF膜放在5%牛血清白蛋白溶液中,于室温结合1 h。将PVDF膜放在一抗溶液中,在4℃孵育过夜。PVDF膜放在二抗溶液中,在室温结合1 h。按照电化学发光(ECL)。用Image J分析条带的灰度值。内参为GAPDH,以灰度值计算目的蛋白相对表达变化。二抗按照1:2 000稀释,酶切Caspase-3、p65一抗按照1∶800稀释。
1.5.5核转录因子(NF)-κB信号激活剂佛波酯(PMA)对SLC8A1-AS1影响心肌细胞的作用检测 取转染SLC8A1-AS1过表达载体的心肌细胞,用10 μg/ml的LPS和1 μmol/L的NF-κB信号激活剂PMA处理培养,记为SLC8A1-AS1+LPS+PMA组,以SLC8A1-AS1+LPS组为参照,用1.5.1方法检测细胞增殖,1.5.2方法检测细胞凋亡变化,1.5.3方法检测细胞分泌的IL-1β、IL-6、TNF-α水平,1.5.4方法检测细胞中酶切Caspase-3、p65蛋白表达变化。
1.6统计学分析 采用SPSS21.0软件进行t检验、单因素方差分析。
2 结 果
2.1SLC8A1-AS1在脓毒症大鼠心肌组织中表达下调 Model组大鼠心肌组织中SLC8A1-AS1表达水平(0.51±0.05)显著低于Normal组(1.00±0.12,t=11.308,P<0.001)。表明SLC8A1-AS1在脓毒症大鼠心肌组织中表达下调。
2.2SLC8A1-AS1过表达载体上调脓毒症心肌细胞模型中SLC8A1-AS1表达水平 与Control组心肌细胞中SLC8A1-AS1表达水平(1.00±0.10)相比,LPS组(0.42±0.06)显著降低(P<0.05)。与Vector+LPS组心肌细胞中SLC8A1-AS1表达水平(0.43±0.05)相比,SLC8Al-AS1+LPS组(1.25±0.13)显著升高(P<0.05)。表明脓毒症心肌细胞模型中SLC8A1-AS1表达下调,而SLC8A1-AS1过表达载体明显上调脓毒症心肌细胞模型中SLC8A1-AS1表达水平。
2.3上调SLC8A1-AS1对脓毒症心肌细胞模型细胞增殖活性和凋亡影响 与Control组比较,LPS组心肌细胞存活率显著降低,细胞凋亡率显著升高,酶切Caspase-3蛋白表达水平显著升高(P<0.05)。与Vector+LPS组比较,SLC8A1-AS1+LPS组心肌细胞存活率显著升高,细胞凋亡率显著降低,酶切Caspase-3蛋白表达水平显著降低(P<0.05)。见图1、图2、表1。表明脓毒症心肌细胞模型细胞增殖活性降低,细胞凋亡增多,而上调SLC8A1-AS1明显提高脓毒症心肌细胞模型细胞增殖活性,减少细胞凋亡。

1~4:Control组,LPS组,Vector+LPS组,SLC8A1-AS1+LPS组,图3同图1 Western印迹检测酶切Caspase-3蛋白表达

图2 流式细胞术检测细胞凋亡变化
2.4上调SLC8A1-AS1对脓毒症心肌细胞模型炎症因子分泌影响 与Control组比较,LPS组心肌细胞分泌的IL-1β、IL-6、TNF-α水平显著升高(P<0.05)。与Vector+LPS组比较,SLC8A1-AS1+LPS组心肌细胞分泌的IL-1β、IL-6、TNF-α水平显著降低(P<0.05)。见表1。表明脓毒症心肌细胞模型细胞分泌炎症因子增多,而上调SLC8A1-AS1明显抑制脓毒症心肌细胞模型分泌炎症因子。

表1 上调SLC8A1-AS1后脓毒症心肌细胞模型存活率、凋亡率和酶切Caspase-3蛋白、IL-1β、IL-6、TNF-α水平
2.5上调SLC8A1-AS1对脓毒症心肌细胞模型NF-κB信号影响 与Control组心肌细胞中p65蛋白表达水平(0.20±0.15)相比,LPS组(0.76±0.07)显著升高(P<0.05)。与Vector+LPS组心肌细胞中p65蛋白表达水平(0.75±0.05)相比,SLC8A1-AS1+LPS组(0.41±0.04)显著降低(P<0.05)。见图3。表明脓毒症心肌细胞模型NF-κB信号被激活,而上调SLC8A1-AS1明显抑制脓毒症心肌细胞模型NF-κB信号激活水平。
2.6NF-κB信号激活剂对上调SLC8A1-AS1影响脓毒症心肌细胞模型增殖、凋亡和炎症因子分泌的作用 与SLC8A1-AS1+LPS组比较,SLC8A1-AS1+LPS+PMA组心肌细胞中p65蛋白表达水平显著升高,细胞存活率显著降低,细胞凋亡率显著升高,细胞中酶切Caspase-3蛋白表达水平显著升高,细胞分泌的IL-1β、IL-6、TNF-α水平显著升高(P<0.05)。见图4,表2,图5。表明NF-κB信号激活剂逆转上调SLC8A1-AS1影响脓毒症心肌细胞模型增殖、凋亡和炎症因子分泌的作用。

图3 Western印迹检测上调SLC8A1-AS1对脓毒症心肌细胞模型中p65蛋白表达影响

图4 流式细胞术检测细胞凋亡

表2 NF-κB信号激活剂处理前后上调SLC8A1-AS1的脓毒症心肌细胞模型存活率、凋亡率及细胞中p65、酶切Caspase-3蛋白水平和细胞分泌的IL-1β、IL-6、TNF-α水平
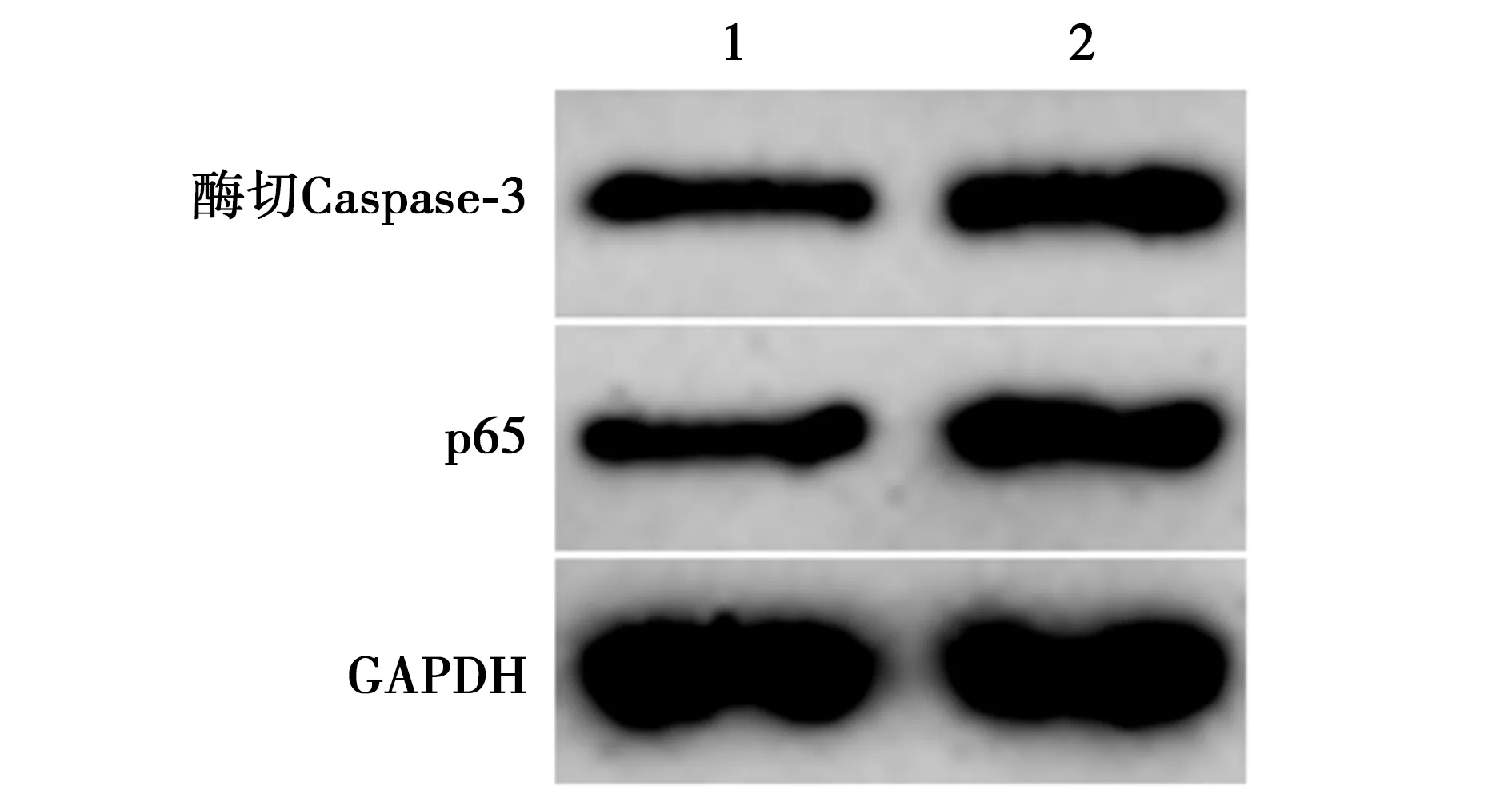
1~2:SLC8A1-AS1+LPS组、SLC8A1-AS1+LPS+PMA组图5 Western印迹检测p65、酶切Caspase-3蛋白表达
3 讨 论
lncRNA与细胞生长、细胞凋亡、炎症等有关〔7〕。研究证实,lncRNA调控人类疾病进展,并且lncRNA有望成为疾病治疗的分子靶点〔8〕。心肌损伤是造成心脏功能异常的关键,其也受到lncRNA的调控作用〔9〕。有研究显示,SLC8A1-AS1在心肌梗死动物模型中表达下调,而上调SLC8A1-AS1能减轻心肌损伤,减少梗死面积,抑制炎症〔5〕。
脓毒症是一种全身系统疾病,其死亡率和发病率均极高,心功能障碍、心肌抑制等是脓毒症患者常见的并发症,心肌损伤也是诱导多个器官衰竭的关键因素〔10〕。研究显示,脓毒症心肌细胞释放大量的炎症因子如IL-1β、IL-6、TNF-α,这些炎症因子一方面可加重炎症反应,促进炎症损伤,另一方面还可激活细胞凋亡,促进心功能损伤〔11,12〕。细胞凋亡是一个极为复杂的过程,其中Caspase蛋白家族广泛参与细胞凋亡调控过程,Caspase蛋白家族成员较多,在正常情况下以没有活性的酶原形式存在,只有被活化后才可诱导细胞凋亡发生〔13~15〕。Caspase-3是Caspase凋亡反应中下游因子,酶切Caspase-3能不可逆激活细胞凋亡〔16,17〕。本研究结果表明,LPS诱导的体外脓毒症心肌细胞模型凋亡率增加,细胞中酶切Caspase-3蛋白表达减少,细胞分泌的IL-1β、IL-6、TNF-α增多,而上调SLC8A1-AS1能减弱LPS对心肌细胞的上述作用,说明SLC8A1-AS1有抑制体外脓毒症心肌细胞模型凋亡和炎症因子释放的作用。
lncRNA发挥作用的机制较为复杂,目前尚未完全阐明,其可通过作用于下游基因或信号通路的转导而发挥多重生物学功能〔18~20〕。NF-κB作用复杂,具有多向转录调节作用,在哺乳动物体内广泛存在,参与免疫反应、肿瘤生长、炎症反应、细胞凋亡等多个过程〔21〕。NF-κB家族庞大,其中p65是NF-κB信号发挥作用的关键亚单位〔22〕。研究显示,NF-κB过度激活加重心肌细胞损伤,而抑制NF-κB信号能够减弱心肌损伤〔23,24〕。
