姜黄素抗胃癌研究进展
2022-05-11张琳王金玮尹丽包子威英锡相张纯刚
张琳,王金玮,尹丽,包子威,英锡相,张纯刚
(辽宁中医药大学药学院,辽宁 大连 116620)
姜黄素是从植物中提取的多酚类天然产物,从姜科植物姜黄的根茎中分离得到[1],为二酮类化合物(结构式见图1)。除了可以作香料,在阿玉吠陀医学和中医中,姜黄素作为膳食补充剂用于治疗炎症性疾病已有5 000多年的历史。姜黄素还具有很强的免疫调节、抗炎、抗氧化、抗感染、抗诱变和抗癌的药理作用。

图1 姜黄素化学结构式
胃癌是一种常见且高度致命的疾病,可发生在胃的任何部位。因此,要提出合理且有效的应对胃癌的治疗方法是切中时弊的。目前标准的治疗还只是手术切除,在适当的情况下也可以使用化疗和放疗,但我们都知道放化疗对人体的危害以及患者愈后的生活质量都是极其不好的,很多患者的精神状态也会因此而颓废。所以我们渴望一种温和且有效的中药治疗方法,由于姜黄素抗癌特性突出且毒性很低,近年来引起了人们普遍的关注。已有众多临床前研究表明姜黄素可能具有抗胃癌的作用,有关姜黄素的临床试验处于初步阶段。目前对姜黄素已有的研究表明,其通过不同信号通路对胃癌细胞产生的作用如图2所示。
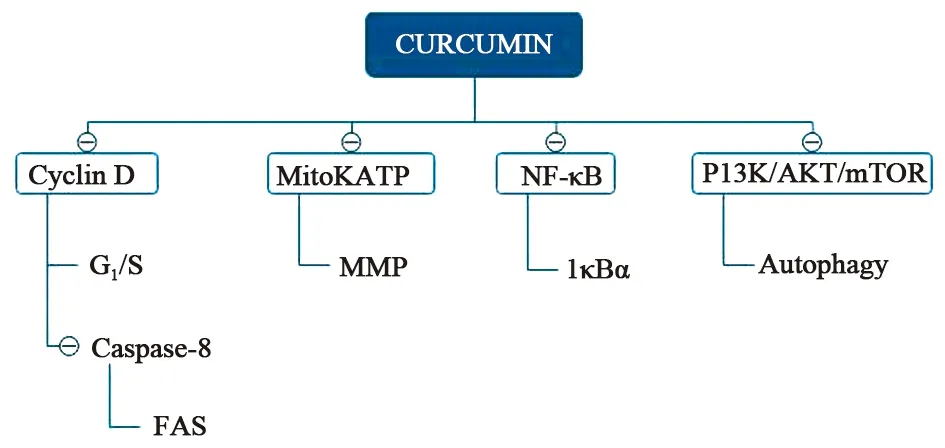
图2 姜黄素抗胃癌的机制
1 姜黄素抗胃癌作用机制
1.1 抑制增殖和侵袭 细胞增殖是生物体生长发育、生存和繁殖下一代的基础,任何细胞都有增殖的性质,无论是正常细胞还是肿瘤细胞,姜黄素选择性地对胃癌细胞通过不同途径抑制其增殖。癌症细胞的自噬可以影响胃癌的增殖,自噬是细胞消化自身细胞器后与溶酶体结合将内源性底物消除的过程,具有高度的进化保守性[2]。Li等[3]研究发现姜黄素对胃癌细胞株BGC-823、SGC-7901和MKN-28的抑制作用呈不同程度的时间和剂量依赖性。其中MKN-28细胞对姜黄素最敏感(IC50=16.17 μmol·L-1),SGC-7901对姜黄素最耐受(IC50=50.45 μmol·L-1),而BGC-823对姜黄素敏感度适中(IC50=37.58 μmol·L-1)。虽然这两个研究中姜黄素对胃癌细胞的增殖都呈现抑制作用,但是作用机制却不同。另外有一些研究发现姜黄素是一种ATP竞争性抑制剂,Cai等[4]采用不同浓度姜黄素对BGC823细胞模型处理不同时间,发现G1期细胞百分率比对照组高10%,而S期细胞则相应地下降了15%,表明姜黄素能够抑制cyclin D1 的mRNA和蛋白表达,进一步阻碍细胞从G1期向S期转移从而抑制细胞的繁殖。Sun等[5]认为姜黄素能抑制SGC-7901细胞的繁殖是由于细胞中miR-34a的表达,从而影响Bd-2、CDK4和cyclin D1的表达。同时他们进一步证明姜黄素通过抑制细胞周期的G0/G1~S期,抑制SGC-7901细胞中Bd-2、CDK4和cyclin D1的表达来抑制SGC-7901细胞的增殖。
1.2 诱导凋亡及调控凋亡相关的基因 细胞凋亡是程序性细胞死亡,是一种对细胞有好处的行为,目的是处理掉对生物体有坏处的细胞。线粒体的主要功能是进行细胞的氧化供能,除此之外还是细胞凋亡的调控中心。Cao等[6]报道姜黄素的使用会使HT-29细胞和AGS细胞系中胞质细胞色素C的升高和线粒体BCL-2蛋白表达显著减少进而导致细胞凋亡,其机制是姜黄素下调了AGS和HT-29细胞系的线粒体膜电位(MMP)并导致线粒体损伤。Xue等[7]报道了姜黄素促进SGC-7901细胞凋亡的机理与CAO一样,同样是MMP的降低,由于Bax/Bcl-2比值显著上调导致线粒体介导的细胞凋亡的诞生,Liu等[8]的报道与Xue一致。Liang等[9]报道姜黄素诱导BGC-823细胞凋亡与活性氧(ROS)的生成有关。线粒体是ROS的一个主要出处,ROS是正常细胞氧代谢的副产物。因此,我们可以看出线粒体与细胞凋亡有着密切的联系,通过调控线粒体的氧含量和膜电位的变化可以诱导GC细胞的凋亡。
1.3 逆转耐药 获得性耐药是长时间使用同一种药物产生的,即在药物未使用时人体对该药物表示敏感,但在药物应用一段时间后体内就会表现出对该药适应的变化即耐药的产生。细胞凋亡的阻滞是肿瘤细胞耐药的主要原因,姜黄素可以抑制抗凋亡基因的表达[10]以及NF-κB的激活。报道称[11]NF-κB是一个转录因子,如果将其激活可以使肿瘤产生耐药性,而IκBα-NF-κB的抑制剂,能够减少药物抗性,为进一步开发5-氟尿嘧啶和姜黄素联合治疗作为逆转GC获得性耐药和诱导GC细胞死亡的新方法提供了理论依据。Yu等[12]则研究了姜黄素联合化疗药物抑制胃癌SGC-7901细胞的效果,他们发现使用化疗药物依托泊苷或阿霉素在抑制SGC-7901细胞的同时还会激活NF-κB通路,产生药物抗性。
2 剂型
姜黄素具有水溶性小,水不稳定的特点,这导致血清和组织中姜黄素浓度不足,所以生物利用度和临床疗效很低。因此科学家们致力于通过修饰剂型改善其溶解度、生物利用度、跨膜通透性;延长其血浆半衰期;实现靶向给药以增强疗效。
2.1 纳米微粒 纳米微粒在姜黄素的剂型中有很广泛的应用,科学家们通过将不同的亲水性载体包载姜黄素制成复合给药系统,该系统粒径小,载药能力强。将其运送到胃时,由于胃液呈酸性,此时纳米微粒会靶向释放出姜黄素作用于胃部,因此改善其生物利用度低的特点[13-14]。潘洪明等[15]以聚氰基丙烯酸正丁酯为载体,采用乳化聚合法包载姜黄素制成纳米微粒,将其作用于人胃癌MGC-803细胞,研究细胞的增殖抑制、细胞周期的下调以及促进凋亡的情况。Bhawana等[16]用聚甲基丙烯酸甲酯-聚乙二醇/氧化锌这种生物纳米复合材料作为药物载体,可携带大量姜黄素。MTT检测法发现姜黄素纳米微粒在较高浓度下能诱导胃癌AGS细胞几乎全部死亡,机制是cyclin D1的表达下调、G1/S期的比例降低。该纳米材料有羧酸基团构成,这些羧酸基团可能在酸性缓冲溶液中发生缩合,导致药物连接减弱,因此姜黄素从纳米材料中迅速释放出来,提高姜黄素的生物利用度。
2.2 片剂 FDDS是一种漂浮给药系统,具有缓释特性。Shishu等[17]用揉捏法制备姜黄素β-环糊精包合物,采用湿法制粒将其制备成胃漂浮片,通过改变羟丙基纤维素和填充剂的含量可以获得适宜的浮力。该制剂具有较强的漂浮性和膨胀性,能最大限度地释放姜黄素,提供药物的持续释放,以提高药物的溶解度和生物利用度,有针对性的更好治疗胃癌。
2.3 NLCs NLCs是一种新型的脂质纳米颗粒,它是固体脂质和液体脂质与空间不相容的混合物,具备高载药量、连续释放的优点。依托泊苷是一线的抗肿瘤药,但由于其溶解度大,生物半衰期短以及耐药等性质限制了其应用,姜黄素有逆转耐药的性质,所以Hong等[18]采用溶剂注入技术制备了依托泊苷-姜黄素脂质纳米颗粒,将其作用于人胃癌SGC-7901细胞,结果发现其半数抑制浓度(IC50)相比单独使用两种药物低得多,不同浓度的NLCs均能抑制细胞生长且呈剂量依赖性。
2.4 纳米乳 纳米乳是纳米技术应用在药物递送系统的例子,纳米乳的比表面积大,粒径约为1~100 nm,而且稳定性好,生物利用度高;纳米乳能改善不溶性药物的溶解度,具有缓慢释放和定位给药的作用。Guerrero等[19]采用溶剂置换法制备了姜黄素纳米乳,该制剂的收率为95%,经体外实验检测其对人胃癌AGS细胞具有细胞毒性,且不影响正常细胞。将纳米乳制成冻干粉,不仅易于保存,同时还具有稳定性好、不易污染的特点。
2.5 微球、微囊 微囊化主要以高分子材料为基础,通过包覆液体或固体药物形成核-壳微胶囊。同时,药物也可以溶解在高分子材料中形成微米级的固体球或胶囊。有报道显示,黏膜表面可以作为潜在的作用点,药物通过纳米载体释放在黏膜表面。虽然口腔给药仍是最有利的给药途径,但只有少数胃肠道黏液黏附载体能显著提高药物在体内的生物利用度。Suwannateep等[20]设计了这样一种微囊:以乙基纤维(EC)为单聚载体或以甲基纤维素和乙基纤维素(ECMC)混合而成的二聚载体采用溶剂置换法制成了姜黄素微囊(C-EC或C-ECMC),该微囊对癌细胞有明显的细胞毒性。这种微囊的外表面有许多的羟基,可以很好地分散在水中。经检测,C-EC球与胃黏膜结合良好,缓慢释放姜黄素进入血液循环;相比之下,C-ECMC球的黏附效果不如C-EC球,而且口服之后,观察到姜黄素浓度最高的是C-EC球。
3 展望
由于姜黄素是一种中药,本身又具有毒性和副作用低的特点,所以姜黄素是一种极具前景的胃癌替代疗法[21]。姜黄素在癌症发展的不同阶段通过激活自噬和阻滞细胞周期抑制增殖,下调NF-κB和mitoKATP通路以及蛋白表达抑制凋亡,但是姜黄素溶解度差、代谢迅速、口服生物利用度低降低了其治癌效果,因此临床上的治疗效果仍没达到理想状态。本文将姜黄素与药物递送系统如纳米颗粒结合以增强效果,但像纳米颗粒这种载体的价格昂贵,即便我们能实现靶向给药,但大多数患者却无法承担费用。姜黄素疗效的研究策略是合成修饰,研究表明[22],已经制备的姜黄素类似物(如联苯二氟酮EF24)具有抗胃癌作用,EF24可以通过上调ROS,激活内质网应激来诱导胃癌细胞凋亡,显示了这种方法的巨大潜力。
