GluA2亚基内吞阻滞穿膜环肽CMT-3Y的设计合成与评价
2022-05-10严志祥韩帅陈积祝青晔董铭心
严志祥 韩帅 陈积 祝青晔 董铭心
(1 青岛大学基础医学院特种医学系,山东 青岛 266021; 2 青岛大学药学院; 3 青岛大学附属青岛市妇女儿童医院麻醉科)

Tat序列可介导生物大分子进入细胞,并有生物相容性高、毒副作用低等优点。但是Tat的递送效率,特别是从内吞小泡逃逸的效率亟待提高[5];同时,在体内应用时还面临血浆耐受性差的问题[6-7]。解决Tat等细胞穿膜肽(CPPs)的缺陷一直是多肽药物领域的研究热点。有研究结果显示了一系列两亲性CPP的环肽,其胞浆递送效率高达7.5%~121.0%(相比之下Tat为2.0%),这些环状CPP直接与质膜磷脂结合,通过内吞作用进入哺乳动物细胞内,然后从内吞小泡体内有效释放[5,7-8]。两亲性CPP设计原则包括:引入机体内酶不能识别的非天然氨基酸以及D型氨基酸,从而能够提高多肽的稳定性;引入含脂肪族侧链的非天然氨基酸,降低多肽药的极性,提高多肽药物穿透能力;增加一定长度的聚乙二醇(PEG)修饰,既可提高多肽药膜渗透性和稳定性,同时又能将CPP与活性基团拉开一定距离以保持多肽药物的活性,但随着PEG的延长,会导致相对分子质量过大,不利于维持药物的穿膜效率。本研究在环状CPP的设计中引入含脂肪族侧链非天然氨基酸、D型氨基酸和长度最短的聚乙二醇(miniPEG),设计GluA2亚基内吞阻滞穿膜环肽CMT-3Y,旨在提高3Y的穿膜能力、神经保护活性和血浆稳定性。
1 材料与方法
1.1 材料和设备
各种Fmoc保护的氨基酸(L/D)、非天然氨基酸以及合成所需的原料均购于北京偶合试剂有限公司,反相高效液相色谱(RP-HPLC)为安捷伦1220(分析型)和1260(制备型)、PC-12(高分化)细胞系购自于北京中科质检生物技术有限公司,MDCK-MDR1细胞系购于青旗(上海)生物技术发展有限公司,CCK8试剂购于上海翊圣生物科技有限公司。
1.2 实验方法
1.2.1CMT-3Y和阴性对照3Y的合成及表征方法CMT-3Y和阴性对照3Y均采用文献报道的固相合成方法合成[8]。用RP-HPLC 1260对合成的多肽进行纯化,色谱柱为Positisil反相C18(半制备型)5 μm,4.6 mm×250 mm,流量为3 mL/min,色谱条件:水相为去离子水+体积分数0.000 5的三氟乙酸(TFA);有机相为乙腈+体积分数0.000 5的TFA,在体积分数0.1~0.7乙腈中梯度洗脱,时间为35 min,检测波长为280 nm。称量纯肽质量并计算肽分离收率,肽分离收率=实际纯化量/理论纯化量。用RP-HPLC 1220分别分析阴性对照3Y和CMT-3Y的粗肽和纯肽的色谱纯度表征,色谱柱为Positisil OSD-P反相C18(分析型)5 μm,4.6 mm×250 mm,流量为1 mL/min,色谱条件与纯化的相同,在体积分数0.1~0.9的乙腈中梯度洗脱,时间为32 min,检测波长为280 nm。用质谱表征阴性对照3Y和CMT-3Y的相对分子质量。
1.2.23Y、Tat-GluA2-3Y和CMT-3Y穿膜效率评价方法 将MDCK-MDRI细胞以1.7×105个铺入Transwell板小室顶端(AP侧)中,在AP侧加入含体积分数0.1胎牛血清的DMEM培养基,然后将Transwell板置于37 ℃、含体积分数0.05 CO2的培养箱中培养,分别在第1、3、5、7天采用相关文献报道的方法[9]用电阻仪测量电阻值,并且在Transwell板AP侧加入400 μL终浓度为20 mg/L的荧光黄,与细胞共同孵育3 h后,在激发光波长为427 nm、发射光波长为536 nm处用酶标仪检测荧光黄的吸光度(A)值。通过荧光黄的表观渗透系数(Papp)值和电阻值来评估模型的紧密连接性,当培养至第7天细胞紧密连接性良好时,分别将阴性对照组3Y、阳性对照组Tat-GluA2-3Y以及实验组CMT-3Y用HBSS缓冲液配制成500 mg/L的浓度。取400 μL各组药物分别加入至培养7 d且电阻值符合要求的Transwell板小室AP侧的细胞中,同时Transwell板基底侧(BL侧)加入600 μL HBSS缓冲液,与细胞共孵育3 h,从BL侧取样并采用RP-HPLC检测各药物渗透浓度,各组实验重复3次,结果取均值,计算各组Papp值。
将阴性对照组3Y、阳性对照组Tat-GluA2-3Y以及实验组CMT-3Y用HBSS缓冲液各配制成500 mg/L的质量浓度。取100 μL各组药物加入至平行人工膜渗透模型(PAMPA)的上方(AP侧),在基底侧(BL侧)加入370 μL HBSS缓冲液,避光室温孵育3 h,然后取BL侧液体进行RP-HPLC检测,实验重复3次,结果取平均值,同时计算各组药物的Papp值。
1.2.33Y、Tat-GluA2-3Y和CMT-3Y神经保护活性评价方法 将PC-12细胞以4×103个/孔铺入96孔板中,在含体积分数0.10胎牛血清的DMEM、37 ℃、含体积分数0.05 CO2培养箱中培养24 h。将细胞分为空白组(只加入配Glu用的溶剂)、模型Glu组、药物组(分别为0.001、0.010、0.050、0.100、1.000 mmol/L阴性对照组3Y、阳性对照组Tat-GluA2-3Y和实验组CMT-3Y),用文献报道的方法构建Glu诱导的PC-12细胞神经兴奋损伤模型[10],同时各组给予各浓度药物进行处理。模型构建24 h后各孔加入20 μL CCK8共孵育2 h,在波长450 nm处用酶标仪检测各组细胞的吸光度(A)值,实验重复5次,结果取均值,计算不同浓度下各组细胞存活率和半数最大效应浓度(EC50)。
1.2.4Tat-GluA2-3Y和CMT-3Y在不同时间点体外血浆中的稳定性评价方法 采用相关文献报道的方法[11]进行体外血浆稳定性评价,将Tat-GluA2-3Y和CMT-3Y分别用去离子水配制成10 g/L的浓度,分别取100 μL两组多肽加入100 μL的大鼠血浆中使其终浓度为5 g/L,置于37 ℃烘箱中孵育0、0.5、1.0、2.0、4.0,6.0、12.0、24.0 h。每组实验重复3次,结果取均值,比较不同时间Tat-GluA2-3Y和CMT-3Y的酶降解率。
1.3 统计学方法
2 结 果
2.1 3Y合成结果
3Y(Ac-YKEGYNVYG-NH2,结构式见图1A)在以去离子水(含体积分数0.000 5的TFA)-乙腈溶液(含体积分数0.000 5的TFA)60∶40为流动相情况下出峰,粗肽色谱纯度为88.53%,纯化以后色谱纯度则为98.54%(见图1B),3Y分离收率为59.8%。3Y理论相对分子质量为1 133.50,测得相对分子质量为1 133.61(见图1C),两者相对分子质量一致。

A:3Y结构式,B:3Y的RP-HPLC图谱,C:3Y质谱图
2.2 CMT-3Y的合成结果
CMT-3Y序列见图2A,结构见图2B。在以去离子水(含体积分数0.000 5的TFA)-乙腈溶液(含体积分数0.000 5的TFA)70∶30为流动相情况下出峰,粗肽色谱纯度为69.54%,纯化后色谱纯度为99.36%(图2C),分离收率为46.06%,CMT-3Y理论相对分子质量为2 317.168,测得相对分子质量为2 317.156(图2D),两者相对分子质量一致。

A:CMT-3Y序列(&代表L-2-萘丙氨酸,#代表miniPEG),B:CMT-3Y结构图,C:CMT-3Y的RP-HPLC图,D:CMT-3Y质谱图
2.3 穿膜活性评价
2.3.1MDCK-MDR1跨膜转运模型的可靠性评价MDCK-MDR1跨膜转运模型在培养第7天时的电阻为(305.09±3.56)Ω·cm2(图3),荧光黄渗透评价测得Papp值为3.57×10-7cm/s,在第1、3、5天的荧光黄渗透评价的Papp值分别为1.03×10-2、2.34×10-4、4.98×10-5cm/s,说明MDCK-MDR1在第7天能够形成紧密连接良好的致密单层,可以用于药物穿膜评价。
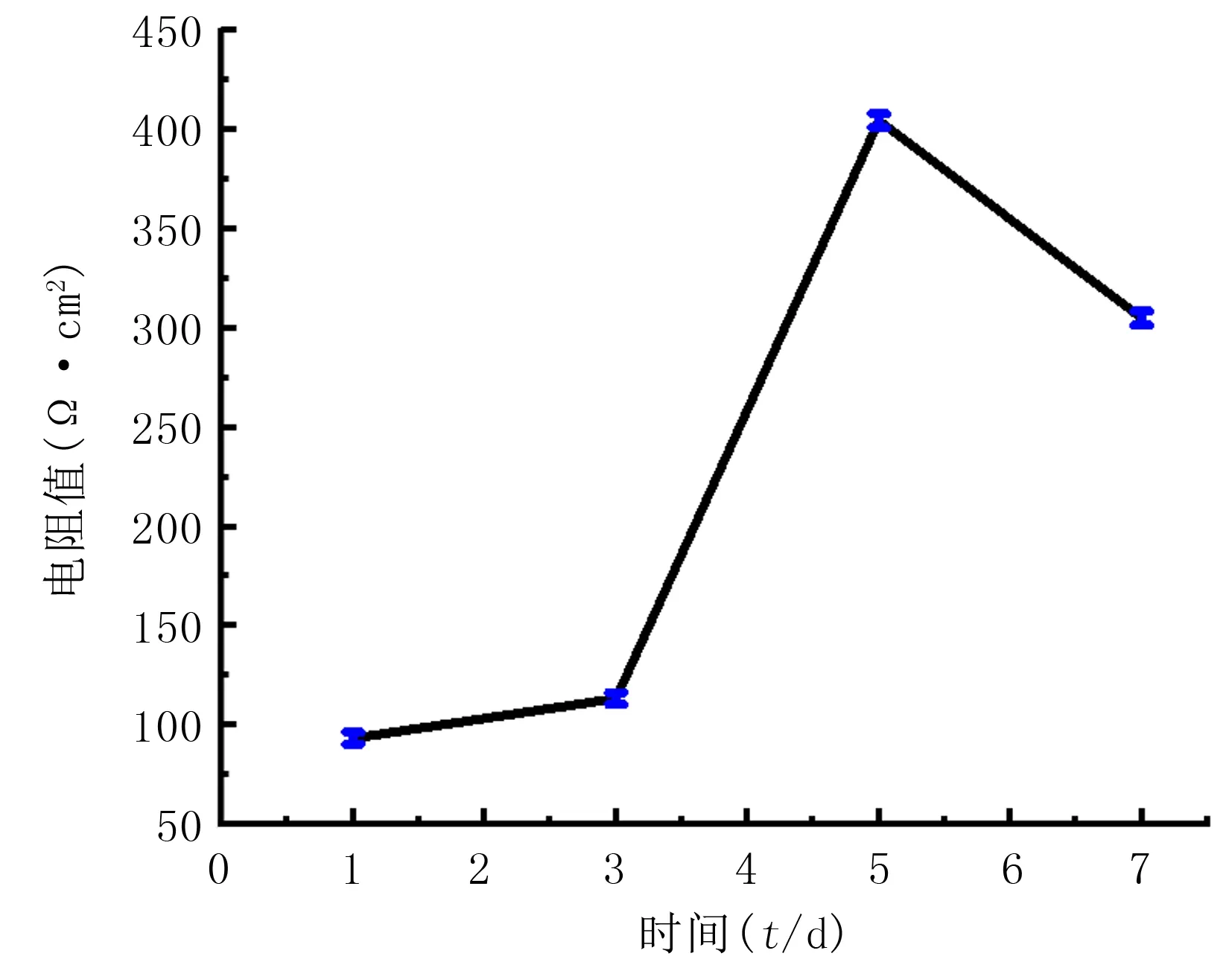
图3 不同时间点MDCK-MDR1细胞在Transwell板中的电阻参数
2.3.23Y、Tat-GluA2-3Y和CMT-3Y的穿膜效率评价结果 在MDCK-MDR1跨膜转运模型上Tat-GluA2-3Y的Papp值为(2.56±0.05)×10-5cm/s,CMT-3Y为(9.33±0.03)×10-5cm/s,CMT-3Y的穿膜效率约是Tat-GluA2-3Y的3.6倍,两者间比较差异具有显著统计学意义(t=170.57,P<0.01);在PAMPA模型上Tat-GluA2-3Y的Papp值为(3.55±0.06)×10-5cm/s,CMT-3Y的值为(9.59±0.03)×10-5cm/s,CMT-3Y的穿膜效率约是Tat-GluA2-3Y 2.7倍,两者间比较差异有显著意义(t=138.80,P<0.01)。3Y在两个模型上通过RP-HPLC均未检测出。
2.4 不同浓度的Tat-GluA2-3Y、CMT-3Y和3Y的神经保护活性评价
析因设计的方差分析结果显示,药物浓度、组别、浓度和组别的交互作用对模型Glu组、空白组、Tat-GluA2-3Y组、CMT-3Y组和3Y组的细胞存活率有明显影响(F浓度=94.54,F组间=108.67,F交互=31.15,P<0.01);且随着药物浓度的上升,Tat-GluA2-3Y和CMT-3Y组的细胞存活率也随之提高(F=31.46、65.49,P<0.01),而3Y组不同浓度间的细胞存活率差异无显著性(P>0.05);模型Glu组中细胞的存活率为(10.57±4.81)%,空白组为(100±0.04)%,3Y组与模型Glu组间细胞存活率比较差异无显著意义(P>0.05),而空白组、Tat-GluA2-3Y组和CMT-3Y组与模型Glu组间细胞存活率比较差异均有显著统计学意义(P<0.01),其中CMT-3Y组的细胞存活率高于Tat-GluA2-3Y组(P<0.05)。见表1。此外,Tat-GluA2-3Y组的EC50值为(50.62±3.60)μmol/L,CMT-3Y组为(35.53±5.47)μmol/L,两者EC50值比较差异具有显著统计学意义(t=4.60,P<0.05)。

表1 Glu诱导损伤的PC12细胞在Tat-GluA2-3Y、CMT-3Y和3Y中的存活率
2.5 Tat-GluA2-3Y和CMT-3Y不同时间点血浆稳定性比较
重复测量设计的方差分析结果显示,时间、组别、时间和组别交互作用对血浆中酶降解率具有明显影响(F时间=40 742.07,F组别=38 998.63,F交互=9 323.67,P<0.01);且随着血浆孵育时间的延长,Tat-GluA2-3Y组和CMT-3Y组在血浆中酶降解率随之升高(F组内=17 702.36、58 347.85,P<0.01);各时间点Tat-GluA2-3Y组酶降解率高于CMT-3Y组,差异均具有统计学意义(F=21.75~914 199.40,P<0.01)。见表2。

表2 Tat-GluA2-3Y和CMT-3Y在血浆中酶降解率比较
3 讨 论
多肽药物具有高生物活性、高专一性和低毒性等优点,在临床应用广泛[12]。然而,线性多肽的首尾端有游离的氨基和羧基,且极性较高,因此线性多肽具有半衰期短和透膜性差等缺陷。环肽可降低药物的极性及封闭裸露的氨基和羧基,从而提高药物的穿膜能力和血浆稳定性,是多肽药物研究热点。本研究设计并合成了环化的两亲性CPP的CMT-3Y,结果显示,该环肽提高了药物的穿膜效率、神经保护活性和血浆稳定性,为多肽修饰提供了研究的思路。
本研究中采用的MDCK-MDR1细胞系是以人源MDR1基因稳定转染MDCK细胞而成,该细胞系能够表达极性化的P-gp蛋白,常用于构建评价化合物穿透血脑屏障和肠道黏膜能力的体外快速筛选模型[9]。本研究结果显示,用MDCK-MDR1细胞构建穿膜模型时,电阻值在第5天达到了高峰,为(425.21±4.45)Ω·cm2,随后呈下降趋势,第7天时电阻值达(305.09±3.56)Ω·cm2,电阻值变化情况与目前相关的研究结果一致[9]。研究表明,当电阻值>150 Ω·cm2时,细胞已形成了紧密连接性[13]。本研究MDCK-MDR1跨膜转运模型电阻值在第5天已达标准,但荧光黄Papp值仍超过2×10-6cm/s,未达到相关研究报道的标准[14],当第7天时荧光黄的Papp值为3.57×10-7cm/s(<2×10-6cm/s),才符合实验要求。MDCK-MDR1跨膜转运模型在细胞完成分化、形成致密单层且电阻值符合要求的条件下可以用于穿膜评价,该模型在第2~3天即可形成致密单层,但细胞完成分化则需要6~7 d[9]。本研究中荧光黄的Papp值在第7天时达到标准,MDCK-MDR1跨膜转运模型可用于穿膜评价。
本研究结果显示CMT-3Y的穿膜效率是Tat-GluA2-3Y的3~4倍,穿膜效率大幅提高但增加的倍数不及文献报道的结果[15]。文献报道环状CPP偶联的货物为荧光素,相对分子质量相对较小,且其穿膜效率检测是通过统计环状CPP偶联的荧光素货物在细胞内的发光值,该检测方式不能够模拟药物在体内的穿膜情况。而本研究采用的MDCK-MDR1跨膜转运模型不仅能评价药物的胃肠道穿膜能力,还能评价穿透血脑屏障的能力,可更好地模拟药物在体内穿膜情况;此外,PAMPA是由带负电的磷脂双分子层组成,可更好地模拟药物在体内被动转运的能力,是药物穿膜能力筛选的有力模型。
多肽药物的穿膜效率受到多种因素的影响。一方面,会受到多肽药物极性大小的影响,本研究通过RP-HPLC检测的结果显示,CMT-3Y的极性小于Tat-GluA2-3Y。CMT-3Y上环两亲性CPP与Tat相比,环两亲性CPP中含有非极性侧链的非天然氨基酸,降低了多肽向细胞膜迁移过程中的吉布斯自由能,进而提高了多肽药物被动转运能力。另一方面,Tat和采用的环两亲性CPP均含有一定数目带正电荷的精氨酸,其与细胞膜表面产生的静电作用使细胞膜变薄,能够通过主动摄取的方式瞬时穿透细胞膜[16]。而将CPP环化后能够降低其与细胞膜结合的熵损失[17],故环化后的两亲性CPP穿膜效率更高。此外,CPP氨基酸数目亦能影响多肽药物的穿膜效率,本研究CMT-3Y中的CPP中有7个氨基酸,而Tat-GluA2-3Y的Tat有11个氨基酸,因此CMT-3Y的氢键受体和氢键供体数目较少。相关研究表明药物氢键受体和氢键供体数目越少,其穿膜效率越高[18-19]。
高分化状态的PC-12细胞能够表达神经元的表型,高分化状态的PC-12细胞也表达AMPA受体的A2亚基[20]。此外,本研究中的空白组细胞存活率与模型Glu组比较差异具有显著性,说明PC-12细胞的神经兴奋性损伤是由Glu介导的,与相关研究结果一致[10],故高分化状态的PC-12细胞可用于本研究的细胞活性评价。本研究中CMT-3Y的EC50值低于Tat-GluA2-3Y,说明CMT-3Y具有较高的神经保护活性。本研究结果显示,药物的活性大小与穿入细胞的药量有关,一方面,Tat-GluA2-3Y和CMT-3Y的活性基团相同,但CMT-3Y穿透细胞的能力更强,因此CMT-3Y的神经保护活性优于Tat-GluA2-3Y;另一方面,在一定范围内药物浓度越高,穿入细胞的药物含量越多,Tat-GluA2-3Y和CMT-3Y神经保护活性也随之增强。CMT-3Y的活性高与其稳定性高也有关,在细胞内稳定存在,活性片段能够更好地发挥生物活性。此外,本研究中CMT-3Y的CPP与活性基团的距离要大于Tat-GluA2-3Y,相关研究表明,CPP与活性基团保持一定的距离能够提高多肽药物的活性[8]。
本研究结果显示,随着时间的延长Tat-GluA2-3Y以及CMT-3Y在血浆中酶降解率均会上升,但是Tat-GluA2-3Y在血浆中12 h降解了约95%,而CMT-3Y在24 h才降解了约57%,表明CMT-3Y的血浆稳定性更好。一方面,环肽通过限制构象,增强了多肽的刚性,增大反应间原子的距离,减少识别氨基和羧基的特定蛋白酶的水解;另一方面,CMT-3Y中含有3个D型氨基酸和1个非天然氨基酸,血浆中的酶主要识别L型氨基酸,不能识别D型氨基酸和非天然氨基酸。相关研究表明,将L型氨基酸转变为D型氨基酸,能够提高药物的稳定性[21];此外,一定长度下的PEG修饰在提高血浆稳定性方面也发挥着效应,PEG能够改变多肽的理化性质,封闭多肽的正电荷,防止血浆蛋白与多肽结合,提高其稳定性[22]。
综上所述,CMT-3Y依靠其含有脂溶性侧链基团以及较短的多肽链等优势使穿膜效率高于Tat-GluA2-3Y。此外,CMT-3Y引入了非天然氨基酸、D型氨基酸、PEG以及环化的两亲性CPP,从而能够避免血浆中一些酶的水解,提高了CMT-3Y的血浆稳定性。由于CMT-3Y的高穿膜效率、高稳定性以及环状CPP与活性基团保持有一定距离,从而使CMT-3Y具有较高的神经保护活性。本研究可为多肽药物的修饰改造提供思路和数据支持。
利益冲突声明:所有作者声明不存在利益冲突。
ConflictsofInterest: All authors disclose no relevant conflicts of interest.
作者贡献:严志祥、韩帅、陈积、祝青晔和董铭心参与了研究设计;严志祥、董铭心参与了论文的写作和修改。所有作者均阅读并同意发表该论文。
Contributions: The study was designed byYANZhixiang,HANShuai,CHENJi,ZHUQingye, andDONGMingxin. The manuscript was drafted and revised byYANZhixiangandDONGMingxin. All the authors have read the last version of the paper and consented submission.
