4-1BB、CD8在口腔扁平苔藓组织中的表达研究
2022-05-10张雪莲管翠强金恩龙
张雪莲,管翠强,,金恩龙
口腔扁平苔藓(oral lichen planus,OLP)是口腔黏膜慢性炎症性疾病,可同时发生在口腔多个部位,病损表现多样,相互交错转变。根据黏膜状况,OLP病损分为糜烂型及非糜烂型,糜烂型OLP伴有自发痛、刺激痛,给患者造成困扰[1]。目前OLP发病机制主要分为抗原特异性和非特异性两种,其中前者涉及CD8+T细胞的异常活化及其针对上皮基底细胞的杀伤作用[2]。4-1BB作为T细胞共刺激靶点,优先靶向CD8+T细胞[3],促进CD8+T细胞的增殖[4]。4-1BB可能通过调节CD8+T细胞进而参与OLP发生发展。本研究拟检测OLP中4-1BB、CD8在OLP组织中的表达,探讨两者与OLP临床病理特征的相关性,阐明可能的发病机制。
1 材料与方法
本研究经山西医科大学口腔医院伦理学委员会审批(伦理号:2020sL004),所有研究对象均被告知研究内容并签署知情同意书。
1.1 病例收集
选取2019年9月—2021年4月就诊山西医科大学第一医院口腔科,并经病理确诊为OLP的患者31例,纳入OLP组,其中男14例,女17例。纳入标准:参考卫生部规划教材《口腔黏膜病学》第5版OLP诊断标准,结合OLP临床表现和组织病理学检查确诊为OLP患者。排除标准如下:①3个月内使用过糖皮质激素、免疫抑制剂等相关药物者;②患有可能影响免疫功能的口腔疾病或免疫系统性疾病;③患有肿瘤或其他全身系统性疾病;④某些药物、残根残冠或银汞充填物引起的苔藓样反应;⑤其他原因不能完成实验者。
同期选取15例在山西医科大学第一医院口腔颌面外科行埋伏阻生齿拔除术的健康志愿者作为对照组,其中男8例,女7例,均经HE染色证实上皮及固有层未见无明显病理改变。
1.2 调查内容与方法
采用统一的调查表,由受试者本人当场填写并回收。调查内容包括:①症状评估,采用直观模拟标尺法[5](visual analogue scale,VAS)评估患者疼痛程度,将疼痛程度记为1~10分。②体征评估,采用OLP网纹-糜烂-溃疡疾病活动积分(reticulum-erosion-ulcer,REU)[6]对疾病活动性进行评分,REU评分系统将病损分为三型,依据部位将口腔分为10个区,各部位REU评分相加之和记为REU计分,详见表1。③心理状况,焦虑状况以焦虑自评量表(self-rating anxiety scale, SAS)[7]为准;抑郁状况以抑郁自评量表(self-rating depression scale, SDS)[8]为准。④牙石,由口腔科专业医生检查为准。⑤检查残根、残冠及尖锐牙尖情况。⑥饮食习惯,是否喜食辛辣食物,水果蔬菜摄入频率(每周0~2次为偶尔,大于2次为经常)。⑦睡眠情况,熬夜[9]指不因失眠引起的23时后仍未进入睡眠状态的现象;失眠[10]指每周失眠>3 d,病程>3个月。⑧消化系统疾病,胃炎、便秘。⑨生活习惯,吸烟、饮酒。

表1 REU评分系统Tab.1 REU score system
1.3 主要试剂
兔抗4-1BB多克隆抗体(爱博泰克,中国武汉),兔抗CD8α单克隆抗体、HRP羊抗兔二抗、DAB显色试剂盒(Cell Signaling Technology,美国),Leica显微镜(Leica,德国),科研及病理玻片扫描分析系统(3D Histech,匈牙利)。
1.4 实验方法
对照组切取埋伏阻生齿远中切口周围正常黏膜组织,OLP组切取病损明显部位黏膜组织。将切取的新鲜组织标本固定,脱水,石蜡包埋,常温保存。石蜡切片经HE染色后使用光学显微镜证实诊断。OLP诊断标准:固有层浅层出现以淋巴细胞为主的带状浸润,基底角质形成细胞液化变性,无上皮异型增生。在OLP上皮最薄部分评价基底细胞损伤程度等级[11]:0级,无损伤;1级,基底细胞间出现分离;2级,基底细胞偶有细胞质空泡化;3级,基底细胞出现液化变性。
1.5 染色结果分析
免疫组织化学法染色:用PBS缓冲液代替一抗作为阴性对照。组织连续切片,脱蜡、入水,封闭,抗原修复,血清封闭,加入4-1BB(1∶200)、CD8(1∶100)一抗,4 ℃孵育过夜,取出后加入二抗孵育30 min,DAB显色,复染,脱水、透明、封片。
每张切片计数5个高倍视野中的CD8阳性细胞数,取平均值作为CD8计数最终结果。
对4-1BB进行半定量分析,每张切片随机选取观察5个高倍视野(high power field, HPF),计算阳性细胞平均百分比后计分:0分为[0,1%];1分为(1%,25%];2分为(25%,75%];3分为(75%,100%]。染色强度计分:0分(无着色),1分(淡黄色),2分(棕黄色),3分(棕褐色)。以两计分的乘积判断染色结果:0~2分为阴性(-),3~5分为弱阳性(+),6~8分为阳性(++),9~12分为强阳性(+++),其中+~+++为阳性表达。
1.6 统计学分析
采用SPSS 23.0软件对数据进行统计学分析,连续性变量使用平均值±标准差或中位数表示;分类变量使用频数(百分比)表示。计量变量的多组比较使用单因素方差分析或Kruskal-WallisH检验;分类变量应用卡方检验;Spearman检验各连续性变量的相关性;卡方检验分析等级变量的相关性。P<0.05为差异有统计学意义。
2 结 果
2.1 基本资料分析
OLP组患者共31例,平均年龄(45.4±13.1)岁。其中糜烂型患者15例,男5例,女10例,平均年龄(40.8±14.2)岁;非糜烂型患者16例,男9例,女7例,平均年龄(49.8±10.8)岁。对照组患者共15例,平均年龄(48.4±12.7)岁。统计分析表明,OLP组和对照组年龄、性别的差异均无统计学意义(年龄t=0.543,P=0.465;性别t=0.271,P=0.603)。
两组基本临床资料比较发现失眠、焦虑、局部机械刺激因素(残根、残冠、尖锐牙尖)及喜食辛辣是OLP发生的相关因素(P<0.05),见表2。
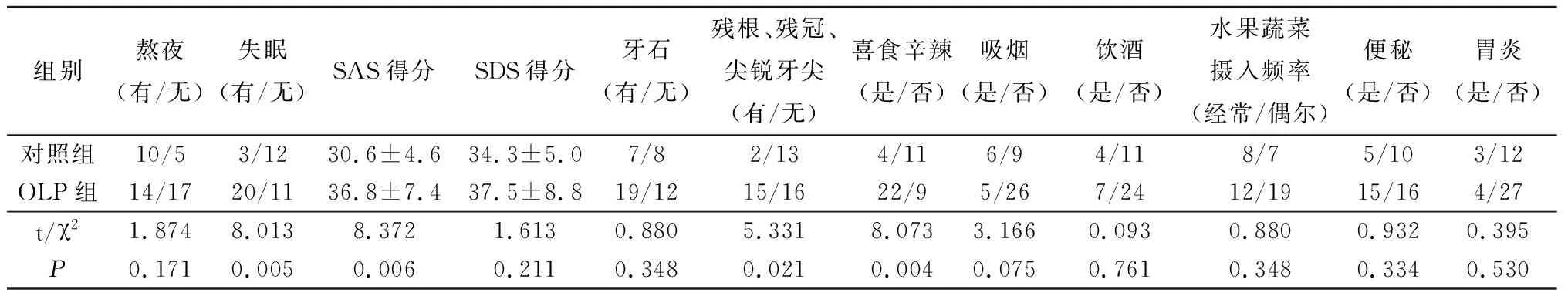
表2 OLP组与对照组临床资料比较
2.2 CD8与4-1BB的表达
对照组患者未表达CD8(图1A),但OLP组31例患者中均可以检测到CD8+T细胞浸润,大部分位于固有层浅层(图1B~C),偶见上皮内CD8+T细胞浸润。依据免疫组化结果,使用均值作为分界值,CD8分界值为246个/HPF,其中CD8+T细胞高密度浸润为13例,低密度浸润为18例。糜烂组中CD8+T细胞高密度浸润有12例,非糜烂组仅1例,糜烂组中CD8+T细胞浸润程度高于非糜烂组,差异具有统计学意义(χ2=11.431,P=0.035)。
在31例OLP患者中,有23例4-1BB为阳性,阳性率为74.19%。4-1BB主要位于固有层深层(图1D~E),在部分血管内皮上也观察到了4-1BB。统计分析显示:OLP组4-1BB的表达高于对照组,差异有统计学意义(χ2=17.091,P<0.001);糜烂组中4-1BB阳性表达率为86.67%,非糜烂组为62.50%,4-1BB在糜烂组中的表达高于非糜烂组,差异具有统计学意义(χ2=11.390,P=0.040)。
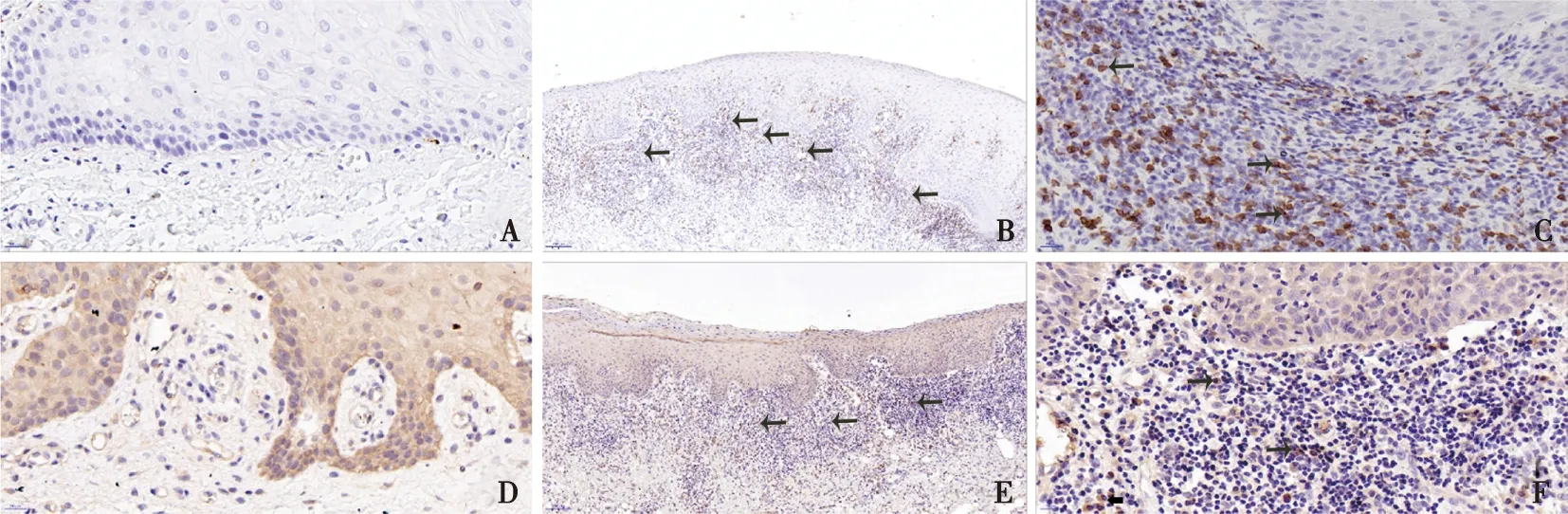
A:CD8在正常组织中的表达( ×400);B:CD8在OLP组织中的表达( ×100);C:CD8在OLP组织中的表达( ×400);D:4-1BB在正常组织中的表达( ×400);E:4-1BB在OLP组织中的表达( ×100);F:4-1BB在OLP组织中的表达( ×400);黑色箭头为阳性表达细胞
2.3 CD8与4-1BB与临床病理特征之间的关系
比较不同分型OLP患者临床病理特征后发现糜烂型OLP患者REU评分、VAS评分、基底细胞损伤程度均高于非糜烂型患者,且结果具有统计学意义(P<0.05)(表3)。
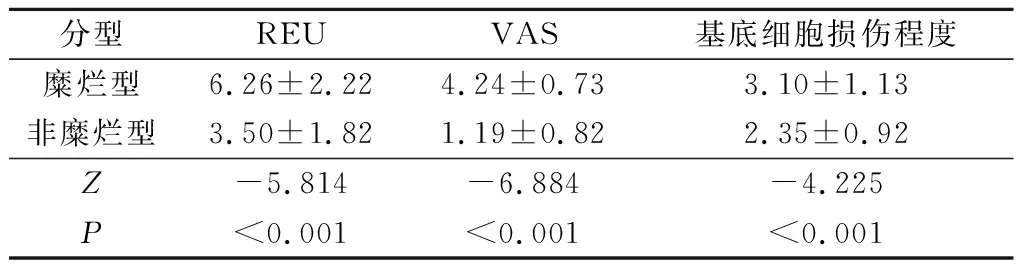
表3 不同分型OLP患者REU评分、VAS评分、基底细胞损伤程度比较Tab.3 Comparison of REU scores, VAS scores, and the degree of basal cell injury in different types of OLP
Spearman相关分析发现,4-1BB与CD8表达呈正相关(r=0.389,P=0.031)。CD8、4-1BB与VAS评分、REU评分分别呈正相关(P<0.05),CD8浸润程度与基底细胞损伤程度呈正相关(P<0.05)(表4),但CD8、4-1BB与年龄、性别、心理状况、牙石、口腔局部机械刺激(残根、残冠及尖锐牙尖)饮食习惯、生活习惯、消化系统疾病、睡眠习惯无相关性(P>0.05)。

表4 CD8、4-1BB与临床病理特征的相关性分析Tab.4 Correlation analysis of CD8 and 4-1BB with clinicopathological characteristics in OLP
3 讨 论
OLP病因复杂,研究表明OLP与免疫、心理、感染、内分泌等多种因素有关。本研究通过比较OLP患者与健康对照组的临床因素,发现失眠、焦虑、局部机械刺激因素及喜食辛辣可能是OLP发生的相关因素,这与郭梦瑶等[12]的发现类似。社会心理因素不仅是OLP发病的危险因素,还与OLP复发有关[13-14],配合心理疏导有助于缓解病情。持续的辛辣饮食刺激及残根、残冠、尖锐牙尖的长期机械刺激对口腔黏膜造成微小创伤,加重炎症浸润,影响局部血液微循环。对OLP患者应定期随访,同时引导患者建立健康的生活习惯,改善患者心理状态。
研究发现,CD8+T细胞介导的免疫毒性应答在感染、自身免疫、肿瘤中发挥重要作用[15]。本研究中OLP患者局部组织中CD8+T细胞数量增加,且在糜烂型OLP多于非糜烂型。Sun等[16]使用流式细胞术检测外周血中T细胞表达水平,发现重型糜烂型OLP患者外周血CD8+T细胞数目多于非糜烂型OLP患者。这表明在不同临床类型OLP中,CD8表达会出现差异,CD8对临床病情可能具有指导意义。本实验发现,临床症状体征评分越高,基底细胞损伤程度越重,固有层CD8+T细胞数量越多。此外,Enomoto等[17]发现与鳞状上皮内CD8+T细胞低密度组相比,上皮内CD8+T细胞呈高密度浸润组的细胞毒性免疫应答更加完善,病情更倾向缓解。
为了进一步检测淋巴细胞功能状态,本实验检测了4-1BB的表达。4-1BB又称CD137,与其配体4-1BBL是一对正向共刺激信号,两者作用后触发双向信号传导,即4-1BB通过募集TNFR相关因子(TRAF)1和TRAF2,激活JNK/SAPK通路,诱导IL-2、IFN-γ、Bcl-xL和Bfl-1分泌,促进T细胞增殖,保护其免于凋亡[17];4-1BBL反向信号传导,激活NF-κB、Src /Akt通路、Src/mTOR/p70S6K通路,促进抗原提呈细胞的成熟,驱动促炎因子的产生[18],诱导强效的免疫应答。本研究发现,与正常组织相比,OLP中4-1BB表达上调,且在糜烂型OLP中表达高于非糜烂型,这表明4-1BB的异常活化可能与OLP的发生发展有关。4-1BB的高表达表明OLP的免疫微环境以促炎反应为主,这与Wei等[19]的结论一致。
REU评分系统较单纯糜烂与非糜烂分组更能体现口腔各部位病损状况[20]及临床病情的严重程度。本研究进一步探讨CD8、4-1BB是否与病情进展及病理特征有关,发现两者与REU、VAS评分存在相关性,CD8与基底细胞损伤程度呈正相关,这与OLP可能是CD8+T细胞介导的针对上皮细胞的毒性免疫应答假说一致[1]。很多学者研究4-1BB在自身免疫疾病及肿瘤免疫中的作用,发现4-1BB通过增强T细胞的Th1/Tc1极化[21],促进CD8+T细胞、NK细胞的增殖以及CD8+T细胞旁观者的活化与增殖[22],重振PD-1介导的耗竭CD8+T细胞活力[23]等多种途径增强CD8+T细胞介导的细胞毒性免疫应答,加重组织损伤。本实验结果表明4-1BB与CD8表达呈正相关,猜测4-1BB通过多种途径促进固有层中CD8+T细胞异常聚集继而加重组织损伤与临床病情。本课题组将通过体内及细胞研究进一步验证两者间的关联。
综上所述,OLP患者局部组织中4-1BB表达升高,且其与CD8+T细胞浸润程度呈正相关,4-1BB可能通过调控CD8+T细胞数目及效应功能参与OLP的发生发展。
