TiO2负载MnFeOx催化剂的制备及常温催化氧化甲醛性能研究*
2022-05-09孙月吟顾名扬徐笠芮赵云霞陈敏东
朱 杰,孙月吟,顾名扬,徐笠芮,黄 琼,2,3,杨 波,2,3,赵云霞,2,3, 陈敏东,2,3
(1. 南京信息工程大学 环境科学与工程学院,南京 210044;2. 南京信息工程大学 江苏省大气环境与装备技术协同创新中心,南京 210044;3. 南京信息工程大学 江苏省大气环境监测与污染控制高技术研究实验室,南京 210044)
0 引 言
随着国家工业的迅速发展,自然资源的过度开发与利用,人类的活动已对大气环境造成了不可估量的污染与破坏。挥发性有机物(VOCs)是大气环境的主要污染物,严重威胁了人类健康,国家已经在“十二五规划”中把开展VOCs的防治工作作为大气污染联防联控工作的重点[1]。甲醛作为VOCs的代表,是一种无色气体,在标准大气压下具有强烈刺激性气味。HCHO的来源有很多,主要包括油漆、纺织品、印刷材料、装饰材料、杀虫剂、黏合剂以及机动车尾气等[2]。HCHO具有毒性高,危害大等特点,已经被世界卫生组织确定为致癌和致畸物质之一,我国每年因甲醛而死亡的人数高达十几万[3],因此我们亟需研究一种有效去除室内甲醛污染物。消除甲醛的方法主要有吸附法,生物法、光催化氧化法以及常温催化氧化法等[4]。其中常温催化氧化法能在室温下利用催化剂将空气中的O2分解为高活性的氧自由基,这些氧自由基与甲醛发生反应生成CO2和H2O,这种方法具有去除效率高,适用范围广,设备简单,无二次污染等优点[5],因此被认为是去除甲醛污染最有潜力的方法之一。

为解决贵金属催化剂存在的问题,现在许多研究小组将目光集中在非贵金属催化剂的开发上,并使用了大量的材料来对其进行研究,例如MnO2、CeO2、Co3O4、ZrO2等等[13]。Liu等[14]用葡萄糖(GLC)与蔗糖(AC)作为修饰材料合成MnO2催化剂,室温下处理高浓度甲醛(244 mg/m3)。1 h内,GLC-MnO2的甲醛去除率为93.5%,AC-MnO2的甲醛去除率为83.4%。而在低浓度甲醛0.5和1.0 mg/m3,空速600 000 mL/(g·h)的条件下,GLC-MnO2的甲醛去除率分别可以达到92%和89%。Tang[15]用共沉淀法制备了一种在常温下可以完全氧化甲醛的MnOx-CeO2混合氧化物催化剂,当Mn/(Mn+Ce)的摩尔比例为0.5时可以获得最高的甲醛催化氧化活性,通过对催化剂的表征发现MnOx-CeO2固溶体提高了在低温下的还原性,从而在氧化甲醛的反应中显示出较高活性,与此同时,Pt的掺杂有利于催化活性的提高。Fan等[16]用NH3·H2O,KOH,NH4HCO3,K2CO3和KHCO3作为沉积剂制备Co3O4催化剂。KHCO3-Co3O4催化剂甲醛完全转化的温度最低,且在40~140 ℃温度段,它对甲醛的催化效率也远远高于其他4种沉淀剂,分析表明KHCO3-Co3O4含有最高的Co3+/Co2+和Oads/Olatt摩尔比,促进甲醛催化氧化。Huang等[17]用阳极电沉积法合成一系列CoxMn3-xO4纳米片,61 mg/m3甲醛在空速120 000 mL/(g·h)的条件下甲醛完全转化所需要的温度排序为Co0.65Mn2.35O4(100 ℃)
常温催化剂在室温下对甲醛具备极佳的催化氧化性能,但催化剂受到载体及金属氧化物的类型,金属的分散性、尺寸、形貌及价态等因素的影响,因此开发低成本、操作安全、环境友好的常温催化剂处理室内低浓度甲醛仍面临巨大的挑战。本文以钛酸四丁酯为材料,通过溶胶-凝胶法制备TiO2载体,以Mn(NO3)2和Fe(NO3)3为活性前驱,通过浸渍、蒸发、烘干、焙烧的方法制备MnFeOx/TiO2催化剂,实验中考察MnFeOx的负载量、摩尔比、焙烧温度等因素对催化剂性能的影响,同时对催化剂的稳定性能进行研究,利用BET、SEM、XRD、H2-TPR等技术对催化剂进行微观表征和分析,探索催化剂中金属氧化物的价态、晶型、材料的结构、形貌与催化剂常温催化氧化甲醛性能间的规律,为解决室内甲醛污染物提供帮助。
1 实 验
1.1 催化剂的制备
1.1.1 TiO2载体的制备
溶液A:13.8 mL钛酸四丁酯+16.2 mL乙醇和丙三醇(1∶1)混合溶液;
溶液B:16.2 mL乙醇和丙三醇(1∶1)混合溶液+6.4 mL乙酸+0.38 g碳酸铵;
混合搅拌溶液B,并将溶液B缓慢滴入正在磁力搅拌的溶液A中,滴定完成后,继续搅拌10 min,室温陈化2 d直至形成凝胶,80 ℃烘箱烘干后研磨细分状,放入马弗炉中,450 ℃焙烧8.5 h,制得TiO2载体。
1.1.2 MnFeOx的负载
称取0.051 g Fe(NO3)3·9H2O于烧杯中,加入0.029 mL50%Mn(NO3)2溶液,并加入20 mL去离子水,混合搅拌至固体颗粒物溶解,再称取2 g上述的TiO2粉末加入溶液中,混合均匀后置于磁力搅拌器上加热搅拌,直至烘干,再置于烘箱中80 ℃,2 h干燥,研磨细分状置于马弗炉中450 ℃,3 h焙烧,制得MnFeOx/TiO2催化剂(MnFeOx的负载量为1%(质量分数),n(Mn)∶n(Fe)=1∶1)。其他MnFeOx负载量(2%、5%、10%、20%、30%)(质量分数),Mn/Fe摩尔比(n(Mn)/n(Fe)=4∶1、2∶1、1∶2、1∶4),焙烧温度(250、350、550和650 ℃)催化剂均采用上述方法制得。
1.2 催化剂性能评价
催化剂性能评价在600 mm×600 mm×600 mm的密闭、含盖的玻璃反应装置中进行,通过反应器中甲醛浓度的变化来测定催化剂的催化活性。首先将38%的甲醛溶液滴加8滴在培养皿上,置于玻璃反应装置中,待其挥发3 min后,立即取出该培养皿,并用甲醛分析仪(PPM-400ST)在线测试玻璃反应器中甲醛的浓度,使其浓度保持在1.1 mg/m3左右(若反应器中的甲醛浓度偏高,打开玻璃反应器的盖子使其散发一部分;若反应器中的甲醛浓度偏低,则继续放入含有甲醛溶液的培养皿),接着将均匀铺有1 g催化剂粉末的另一培养皿放入玻璃反应器中,并用凡士林将玻璃反应器密封,当反应器中的甲醛浓度稳定后,用甲醛分析仪(PPM-400ST)连续3次在线测试甲醛初始浓度(甲醛的初始浓度一般在1.0~1.1 mg/m3间),随后每隔12 h测量反应器中甲醛的浓度3次,考察48 h内甲醛浓度的变化结果。由于反应器中甲醛浓度较低,催化剂催化氧化甲醛后产生的CO2量也较少,无法达到气相色谱的检测限,因此本实验只测试反应器中的甲醛浓度来考察催化剂的催化氧化性能。
1.3 催化剂的表征
为考察催化剂微观结构在催化反应过程的作用,采用XRD-6100衍射分析仪对催化剂进行XRD检测,扫描过程选用。Cu靶射线管,扫描速率为4°/min,2θ衍射角范围为10°~80°;为获得催化剂的比表面积、孔径大小及其分布情况,采用以N2吸附的AutosorbiQ-AG-MP 表面积分析仪对催化剂进行检测;采用日本Hitachi公司生产的SU1510扫描电镜检测分析样品表面形貌;氢气程序升温还原(H2-TPR)检测在50~900 ℃范围内进行,升温速率为15 ℃/min,采用AutoChem 2920仪器(Micromeritics, USA),TCD检测器;氧气程序升温脱附(O2-TPD)检测在50~800 ℃范围内进行,升温速率为15 ℃/min,与H2-TPR在同一台仪器上检测;原位红外光谱检测在Thermo Fisher 6700仪器上进行,在室温下用流动的N2对催化剂进行1 h原位反应预处理,然后将反应气体混合物(80×10-6HCHO/N2和HCHO/O2)在室温下以30 mL/min的流速导入DRIFT池,光谱采集范围为4 000~800 cm-1,在4 cm-1分辨率下累计扫描64次。
1.4 数据处理
MnFeOx/TiO2催化剂常温催化氧化甲醛转化率按如下公式计算:
式中:Ct表示每12 h后反应器内气态甲醛的浓度;C0表示反应器内起始的甲醛浓度。反应器内气态甲醛浓度每12 h测试3次,取平均值。气态甲醛质量浓度直接由甲醛分析仪(PPM-400ST)读出。
2 结果与讨论
2.1 催化剂常温催化氧化活性
2.1.1 MnFeOx/TiO2催化剂常温催化氧化性能
为考察MnFeOx/TiO2催化剂常温催化氧化性能,研究在同一条件下进行了一组对比实验。实验中MnFeOx负载量为10%(质量分数),n(Mn)/n(Fe)=1∶1,焙烧温度为450 ℃,焙烧时间3 h,培养皿直径为Φ90 mm,材料的用量为1 g。为防止玻璃反应器漏气对实验结果产生影响,实验进行了一组空白对照实验。由图可知,在不放任何催化剂的情况下,玻璃反应器仅仅只有16.9%的甲醛气体浓度下降,可能是由于吸附或温度原因造成,同时甲醛浓度在后期趋于稳定不再下降,说明反应器的密封性良好。研究发现活性炭对甲醛有一定的吸附作用,48h内甲醛的转化率为55.0%,实验制备的纯TiO2对甲醛的转化率仅有31.5%,而将MnFeOx负载到TiO2上后,催化剂的活性大幅度提高,48 h内将浓度为1.006 mg/m3的甲醛降低至0.172 mg/m3,甲醛的转化率达到82.9%,实验结果表明MnFeOx/TiO2催化剂对甲醛具有良好的常温催化氧化活性。

图1 MnFeOx/TiO2催化剂常温催化氧化甲醛及对比实验图Fig 1 Catalytic oxidation of formaldehyde by MnFeOx/TiO2 catalyst at room temperature and its comparative experimental diagram
2.1.2 Mn/Fe摩尔比对MnFeOx/TiO2催化剂性能的影响
图2为MnFeOx负载量为10%(质量分数),焙烧温度为450 ℃,焙烧时间3 h,培养皿直径为Φ90 mm,研究考察了Mn/Fe摩尔比对MnFeOx/TiO2催化剂催化氧化甲醛性能的影响。随着Mn/Fe摩尔比的增加,催化剂对甲醛的转化率不断增加,当n(Mn)∶n(Fe)=4∶1时,催化剂的催化活性最高,48 h内可将浓度为1.022 mg/m3甲醛降至0.089 mg/m3,甲醛转化率可达91.3%,其中前24 h内甲醛的转化速度较快,24 h的甲醛转化率达到72.8%。而当n(Mn)∶n(Fe)=1∶4时,催化剂的催化活性最差,48 h内对甲醛的转化率仅仅只有59.2%。

图2 Mn/Fe摩尔比对MnFeOx/TiO2催化剂氧化性能的影响Fig 2 The effect of Mn/Fe molar ratio on the oxidation performance of MnFeOx/TiO2 catalyst
2.1.3 催化剂涂覆面积对催化剂性能的影响
当1.0 g催化剂粉末平铺在直径为Ф90 mm的培养皿上时,由于培养皿的表面积比较大,1.0 g的粉末并不能完全铺满培养皿,这会导致甲醛与催化剂的接触面积不能保证完全相等,因此实验将1.0 g催化剂粉末平铺在直径为Φ60 mm的培养皿中,图3为同一催化剂平铺在两种规格的培养皿中,考察催化剂涂覆面积对甲醛去除效果的影响。
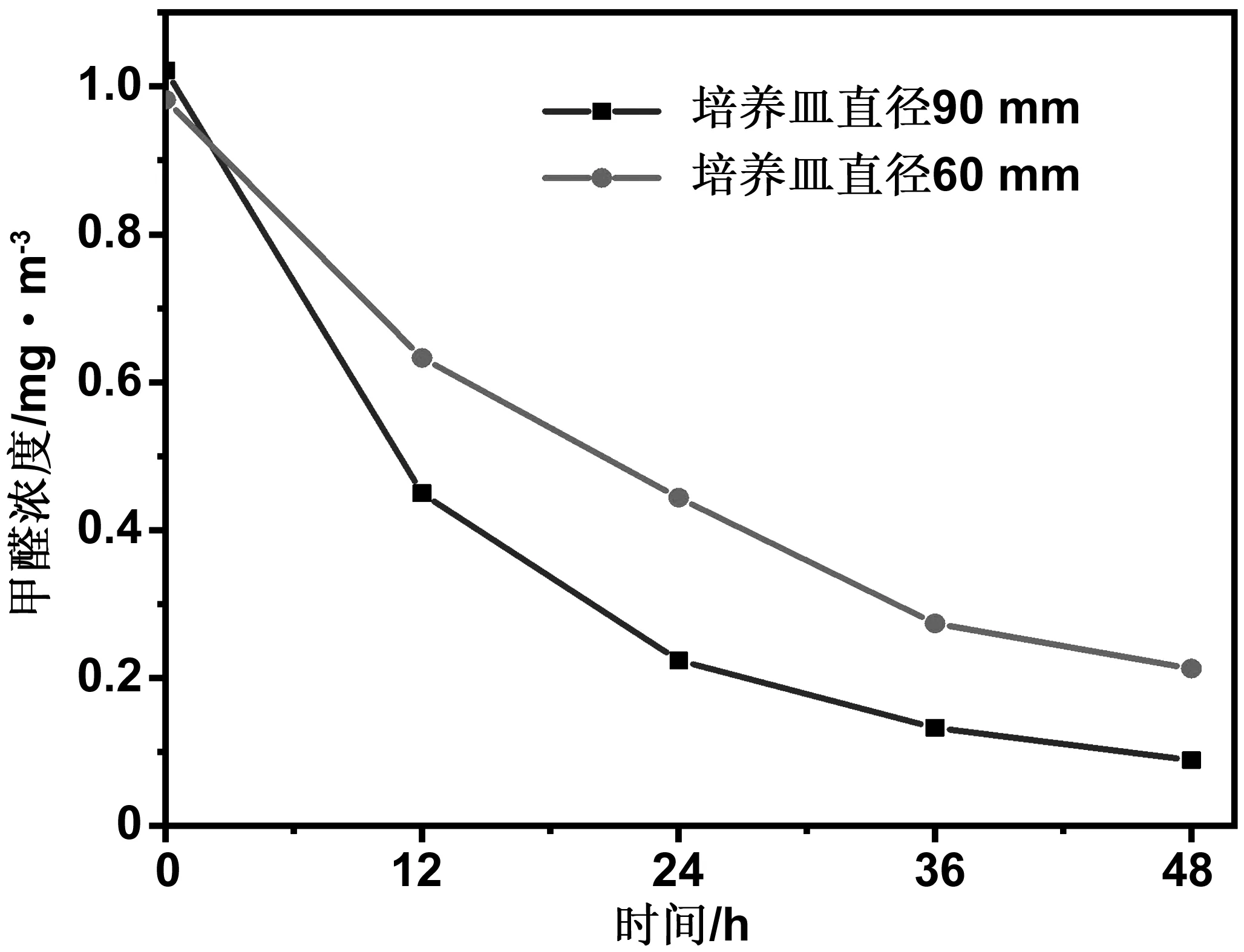
图3 催化剂涂覆面积对MnFeOx/TiO2催化剂氧化性能的影响Fig 3 The effect of catalyst coating area on the oxidation performance of MnFeOx/TiO2 catalyst
图3中MnFeOx在TiO2上的负载量为10%(质量分数),n(Mn)∶n(Fe)=4∶1,焙烧温度为450 ℃,焙烧时间3 h,考察催化剂与甲醛涂覆面积对催化剂催化氧化甲醛性能的影响。由图可知,催化剂涂覆面积越大,催化剂对甲醛的转化率越高。当1.0 g催化剂粉末均匀涂覆在直径为90 mm的培养皿上时,催化剂48 h内对甲醛的转化率为91.3%,而将同等催化剂粉末涂覆在直径为60 mm的培养皿上时,催化剂48 h内对甲醛的转化率只有78.2%。由此可知,涂覆面积对催化剂催化氧化甲醛转化率影响较大。
2.1.4 焙烧温度对催化剂性能的影响
图4中MnFeOx在TiO2上的负载量为10%(质量分数),n(Mn)∶n(Fe)=4∶1,焙烧时间3 h,培养皿直径Φ60 mm,考察焙烧温度对催化剂催化氧化甲醛性能的影响。由图可知,当焙烧温度不超过350 ℃时,随着焙烧温度的增加,甲醛转化率不断增加,当焙烧温度超过350 ℃时,随着焙烧温度的增加,甲醛转化率不断下降。当焙烧温度为350 ℃时,催化剂的常温催化效果最佳,48h内将浓度为0.992 mg/m3的甲醛降低至0.123 mg/m3,其中前24 h内甲醛浓度下降较快,24 h内甲醛的转化率达到64.4%,随着时间的推移,甲醛浓度下降逐渐减缓,48 h内甲醛的转化率为87.6%,而当焙烧温度为650 ℃时,催化剂的效果最差,48 h内甲醛的转化率仅有58.1%,催化剂的最佳焙烧温度为350 ℃。

图4 焙烧温度对MnFeOx/TiO2催化剂氧化性能的影响Fig 4 The effect of calcination temperature on oxidation performance of MnFeOx/TiO2 catalyst
2.1.5 MnFeOx负载量对催化剂性能的影响
图5中n(Mn)/n(Fe)=4∶1,焙烧温度为350 ℃,焙烧时间3 h,培养皿直径Φ60 mm,考察MnFeOx的负载量对催化剂催化氧化甲醛性能的影响。由图可知,金属氧化物的负载量对催化剂的性能影响很大。当MnFeOx的负载量为1%(质量分数)时,甲醛的转化率较低,48 h内将浓度为1.062 mg/m3的甲醛降低至0.616 mg/m3,甲醛转化率仅有42.1%,当MnFeOx的负载量为2%(质量分数)时,催化剂的催化活性得到大幅度提升,但48h内也仅将浓度1.049 mg/m3的甲醛降低至0.311 mg/m3,甲醛转化率为70.3%,继续提高MnFeOx负载量至10%(质量分数),此时催化剂的催化活性最好,48h内甲醛的转化率达到87.6%,再继续增加MnFeOx的负载量,甲醛的转化率不再提高,这是因为随着负载量的持续增加因团聚其比表面积逐渐降低,负载量为10%(质量分数)MnFeOx显示出最大的比表面积,达到249.8 m2/g,因此认为MnFeOx的最佳负载量为10%(质量分数)。

图5 负载量对MnFeOx/TiO2催化剂氧化性能的影响Fig 5 The effect of loading on the oxidation performance of MnFeOx/TiO2 catalyst
2.1.6 催化剂的稳定性测试
为测试催化剂的稳定性,我们将同一催化剂在同一条件下连续测试5次,考察催化剂稳定性。
图6中选用催化剂的n(Mn)∶n(Fe)=4∶1,MnFeOx负载量为10%(质量分数),焙烧温度为350 ℃,焙烧时间3 h,培养皿直径Φ60 mm,考察催化剂的催化活性是否稳定。由图可知,前两次内,催化剂的催化活性下降不是很明显,48 h内甲醛的转化率基本可以维持在85%左右,随着测量次数的增加,催化剂吸收的水分也逐渐增加,催化剂的抗水性较差,导致催化剂的催化活性下降,5次后催化剂48 h的甲醛转化率下降至69.0%。

图6 MnFeOx/TiO2催化剂稳定性测试结果Fig 6 Stability results of MnFeOx/TiO2 catalyst
2.2 催化剂的表征分析
2.2.1 XRD分析
图7为干燥后的MnFeOx/TiO2催化剂经250、350、450、550、650 ℃焙烧后的XRD图谱。由图可知,无论焙烧温度的高低,XRD衍射图中都没有发现铁的特征衍射峰,说明催化剂中铁负载均匀,尺寸均一,纳米颗粒小,且铁纳米颗粒没有发生团聚。当MnFeOx/TiO2催化剂经250和350 ℃焙烧后,样品的衍射峰较宽,说明催化剂粉体的粒径较小,衍射峰强度较小,说明此时含有无定型粉体。随着焙烧温度升高到450和550 ℃时,样品的衍射峰从宽峰逐渐变成尖峰,说明样品中晶体的结晶度随着焙烧温度的升高而增大,粒径增大,同时我们在2θ为25.34°、48.14°和53.96°处发现锐钛矿相TiO2的特征衍射峰(PDF 75-1166)。继续升高到650 ℃时,样品在2θ为27.44°、36.13°、41.24°、54.37°、56.65°和69.03°处出现金红石相TiO2的特征衍射峰(PDF 75-1757),同时还在32.92°处出现了Mn2O3的特征衍射峰(PDF 78-0390)。结合XRD表征结果和催化剂的活性测试结果表明金红石相TiO2不利于催化剂的催化氧化甲醛。

图7 不同焙烧温度下MnFeOx/TiO2催化剂的XRD图谱Fig 7 XRD patterns of MnFeOx/TiO2 catalysts at different calcination temperatures
2.2.2 SEM分析
用扫描电镜(SEM)对不同焙烧温度下的MnFeOx/TiO2催化剂进行观察,扫描图谱如图8所示。图8中(a)、(b)、(c)、(d)和(e)为不同催化剂在放大倍数为5000×下的图片,由图可知,MnFeOx/TiO2催化剂粉末表面颗粒以无规则形态存在,大小不一,分布不均匀且表面粗糙,随着焙烧温度的升高,催化剂中块状物减少,结构愈加疏松,导致催化剂的活性降低。图中(b)和(f)为同一催化剂在放大倍数为5000×和100000×下的图片,当放大倍数为100000×时,我们观察到催化剂表面富有大量类似球状的颗粒物,表面结构蓬松,且部分发生团聚,此为活性组分MnFeOx。锰铁氧化物负载在TiO2载体上后,形成了丰富的微孔,从而提供了更多的吸附位,使得甲醛分子吸附在上面形成吸附态,并且能够进一步与锰铁氧化物发生催化氧化反应,降低甲醛的浓度。

图8 不同焙烧温度下MnFeOx/TiO2催化剂的SEM图谱Fig 8 SEM spectra of MnFeOx/TiO2 catalysts at different calcination temperatures
2.2.3 比表面积分析
实验对不同负载量所制备的MnFeOx/TiO2催化剂的比表面积及孔容孔径进行了分析,如表1所示。研究发现,不同负载量所制备的MnFeOx/TiO2催化剂的比表面积、孔体积和平均孔径不尽相同,其比表面积的大小依次为10%(质量分数)MnFeOx/TiO2>5%(质量分数)MnFeOx/TiO2>2%(质量分数)MnFeOx/TiO2>20%(质量分数)MnFeOx/TiO2>30%(质量分数)MnFeOx/TiO2>1%(质量分数)MnFeOx/TiO2。当锰铁氧化物的负载量为10%(质量分数)时,催化剂的比表面积最大,达到249.8 m2/g,较大的比表面积会提供较多的活性位点,因此在此负载量下的MnFeOx/TiO2催化剂展现出最佳的催化活性。当MnFeOx负载量提高到20%(质量分数)和30%(质量分数)时,催化剂的比表面积不仅没有增大反而逐渐减小,因此催化剂的催化活性不再上升。

表1 催化剂的比表面积、孔体积及平均孔径Table 1 The specific surface area, pore volume and average pore diameter of the catalyst
2.2.4 H2-TPR和O2-TPD分析
图9(a)为不同MnFeOx摩尔比的MnFeOx/TiO2催化剂的H2-TPR曲线图,图中催化剂的MnFeOx负载量为10%(质量分数),焙烧温度为450 ℃,焙烧时间为3 h。从图中可以看出,不同摩尔比的样品均能清楚地看到MnFeOx混合氧化物的两个还原峰,这两个还原峰分别对应的应该是MnO2到Mn2O3和Mn2O3到MnO的还原。随着Mn含量的增加,还原峰的温度不断降低,还原峰的面积不断减少,表明催化剂消耗的H2量逐渐减少,氧化锰的含量增加会加速催化剂表面氧的转移,促进MnO2还原为Mn2O3,Mn2O3还原为MnO。n(Mn)∶n(Fe)=4∶1样品还原峰的温度最低,表明此时催化剂的氧化能力最强,催化氧化性能最好。

图9 MnFeOx/TiO2催化剂的H2-TPR(a)和O2-TPD(b)图Fig 9 H2-TPR (a) and O2-TPD (b) diagrams of MnFeOx/TiO2 catalyst

2.2.5 原位红外光谱分析
室温下催化剂在HCHO/N2和HCHO/O2环境中甲醛吸附和氧化的原位红外光谱如图10所示。结果表明,除了在HCHO/O2环境中2 340 cm-1处出现吸附CO2的峰[22],其他无氧和有氧环境下原位红外光谱的振动峰基本相似。这说明甲醛氧化所产生的CO2在有N2存在的环境中可以被吸附,而在有氧环境中由于O2占用了催化剂表面的活性位点而直接扩散到空气中。3 660 cm-1处的峰是结构羟基OH伸缩振动ν(OH),当甲醛开始吸附时,峰强随着吸附时间的增加而减小,说明表面吸附的HCHO解离消耗了OH基团,当OH基团被耗尽时,吸附在表面的HCHO解离反应就结束了[23]。3 240、1 560、1 460和1 360 cm-1处对应的峰分别为甲酸盐C-H伸缩振动ν(CH)、COO非对称伸缩振动ν(COO)、CH弯曲振动δ(CH)和COO对称伸缩振动νs(COO)[24]。2 840和1 060 cm-1处的对应的峰是由二氧亚甲基(DOM)的C-H伸缩振动ν(CH)和CO伸缩振动ν(CO)引起的。当HCHO开始吸附时,甲酸盐和DOM在5 min内快速析出,峰值的强度逐渐增大,当吸附时间超过20 min后,峰值强度逐渐减缓,表明甲醛在催化剂表面的吸附和氧化是有限的,实验过程中DOM的产生表明催化剂表面的活性氧不足以对甲醛进行更加深层次的氧化[25-27]。3 480 cm-1处的宽带峰是H2O对称伸缩和非对称伸缩振动与氢键叠加形成的H2O缔合峰,这种峰的形成表明催化剂催化氧化HCHO的过程中会产生H2O,H2O会进一步参与HCHO在催化剂表面的吸附解离过程[28]。1 660和3 710 cm-1处的吸附峰是由催化剂表面吸附的H2O和表面羟基的弯曲振动产生的[29]。对比图10(a)和(b)光谱,厌氧和好氧环境中HCHO的吸收峰几乎相同,说明氧气不能补充吸附甲醛分解所消耗的催化剂表面的活性氧。原位红外光谱分析的表征结果表明催化剂催化氧化甲醛的反应机理为:首先HCHO先吸附在催化剂的表面,其次HCHO与催化剂表面的活性组分MnFeOx发生反应,将催化剂的表面氧转化为活性氧,同时产生甲酸盐和DOM等中间体,最后甲酸盐和DOM等中间体在晶格氧的作用下进一步氧化为CO和H2O,CO最终被氧化为CO2。
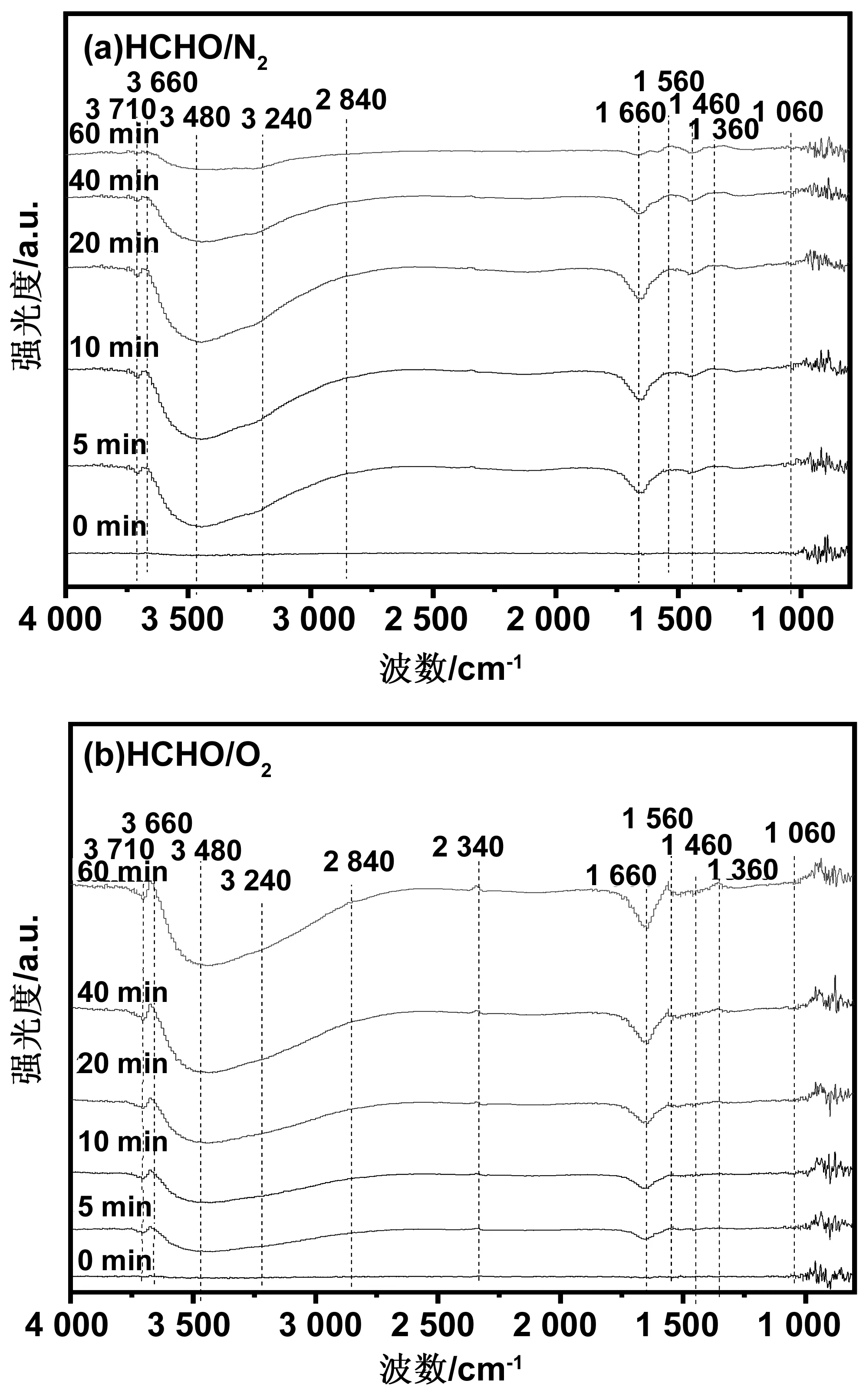
图10 MnFeOx/TiO2催化剂的原位红外光谱图Fig 10 In-situ infrared spectra of MnFeOx/TiO2 catalyst
3 结 论
通过溶胶-凝胶法制备TiO2载体,通过浸渍、蒸发、烘干、焙烧的方法制备MnFeOx/TiO2催化剂,考察MnFeOx的负载量、摩尔比、焙烧温度等因素对催化剂常温催化氧化甲醛性能的影响。研究结果表明,MnFeOx/TiO2催化剂对甲醛具有良好的催化氧化活性,克服了目前的甲醛催化剂对于贵金属的依赖,降低成本、降低反应温度。实验中TiO2对甲醛的转化率仅有31.5%,由此可以得出TiO2主要充当的是催化剂的载体,对甲醛氧化起主要作用的是活性组分MnFeOx。MnFeOx负载在TiO2载体上后,会形成了丰富的微孔,从而提供了更多的吸附位点,使得甲醛分子吸附在上面形成吸附态,并且能够进一步与MnFeOx发生催化氧化反应,将催化剂的表面氧转化为活性氧,同时产生甲酸盐和DOM等中间体,最后甲酸盐和DOM等中间体在晶格氧的作用下进一步氧化为CO2和H2O。当MnFeOx的负载量为10%(质量分数),n(Mn)∶n(Fe)=4∶1,焙烧温度为350 ℃时,催化剂常温催化氧化甲醛的性能最好,在室温下48 h内将浓度为0.992 mg/m3的甲醛降低至0.123 mg/m3,甲醛的转化率达到87.6%。通过催化剂的稳定性测试发现,5次测量后催化剂的甲醛的转化率从87.6%降至69.0%。
