基于GC-MS的低盐虾酱低温发酵过程中代谢组学分析
2022-05-09李文亚班雨函于宏伟马爱进桑亚新孙纪录
李文亚,班雨函,于宏伟,马爱进,桑亚新,孙纪录,*
(1.河北农业大学食品科技学院,河北 保定 071001;2.北京工商大学食品与健康学院,北京 100048)
传统虾酱是由毛虾、蜢子虾等小型虾或低值虾添加食盐发酵制成的调味品。传统虾酱含盐量高,约为25%~30%。摄入食盐过多可能会导致血压升高等一系列健康问题,所以传统高盐虾酱并不符合现代人群健康的理念。与之相比,低盐豆酱[1]、低盐鱼酱[2]和低盐腌鱼[3]等低盐产品更加受到消费者的欢迎。近年来,低盐虾酱已在沧州黄骅等一些传统虾酱产区悄然兴起。低盐虾酱同样是以低值虾类经过加盐发酵而成,但是,其含盐量显著降低,约为10%~12%。目前,国内已有学者对低盐虾酱的发酵工艺进行研究,包括添加酶制剂发酵[4]、低温发酵[5]和人工接种发酵[6]等。由于含盐量的降低,一些腐败微生物可能得不到抑制而大量增长,从而对低盐虾酱的风味、形态及营养价值产生一定的影响。因此,目前许多低盐虾酱生产企业采用低温发酵的方式控制腐败微生物的生长。
代谢组学是一种系统确定生物样品中低分子质量代谢物的方法,在发酵水产品中,已被用于监测从原材料到终端产品这一过程中的质量、安全性和微生物的变化过程,确保产品的品质[7]。发酵水产品的代谢组学分析也已用于记录发酵过程中的代谢物变化,以期达到预测终端产品的感官特性和营养质量的目的[8]。目前,代谢组学的研究手段主要为液相色谱-质谱、气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)、核磁共振和高效液相色谱等[9]。水产品的发酵过程可以看作一个复杂的生态系统,含有多种微生物菌群,对营养成分进行水解,从而释放出大量的代谢物,如氨基酸、有机酸和苷元化合物等。由于代谢组学能够同时检测多种代谢物的变化,因此被广泛用于发酵食品的代谢物组变化中,如灰树花的发酵[10]、沙棘油[11]、发酵乳[12]和高度黑糯米酒[13]。在发酵水产品中,代谢组学应用还不够广泛,在低盐虾酱中更是研究匮乏。Chen Daian等[14]研究了发酵过程中蟹酱代谢组学的演变,发现蟹酱的质量明显受到发酵的影响,质量变化表现为乳酸、甜菜碱、牛磺酸、三甲胺-N-氧化物、三角碱、肌苷、二磷酸腺苷、2-吡啶醇的下降,一系列氨基酸的波动,以及蔗糖、甲酸、乙酸盐、三甲胺、次黄嘌呤的积累。Lee等[15]对在不同环境中发酵的高盐虾酱进行代谢组学分析,发现在高盐环境下酶的作用受到抑制,导致在发酵后期氨基酸和葡萄糖含量仍然没有显著性差异,同时推测在虾酱样品发酵过程中,原料虾体内的内源性蛋白酶和脂肪酶发挥着重要作用,尤其是对感官特性有十分重要的影响。
虾酱发酵过程中的代谢物直接影响虾酱的品质和风味,而低盐虾酱作为一种近年出现的新型产品,其代谢物组的研究十分匮乏。因此,本实验拟使用GC-MS技术对低温发酵的低盐虾酱中代谢物组进行分析,并通过t检验和变量投影重要性(variable importance in projection,VIP)值分析等多元统计分析方法对差异代谢物进行筛选,以期揭示低温发酵工艺生产的低盐虾酱中代谢物组变化规律。研究结果将为低盐虾酱的质量评估和进一步完善低盐虾酱生产工艺提供理论支撑。
1 材料与方法
1.1 材料与试剂
蜢子虾购自河北农业大学科技市场,产地为黄骅。
氯仿(色谱级) 上海沃凯生物技术有限公司;超纯水、甲醇、乙腈 美国Fisher Chemical公司;吡啶(色谱级) 上海阿拉丁生化科技股份有限公司;甲氧胺盐酸盐、L-2-氯苯丙氨酸 上海阿达玛斯科技有限公司;N,O-双(三甲基硅烷基)三氟乙酰胺(含1%三甲基氯硅烷) 美国Regis公司。
1.2 仪器与设备
Wonbio-96c多样品冷冻研磨仪 上海万柏生物科技有限公司;Centrifuge 5424 R高速冷冻离心机 德国Eppendorf公司;JXDC-20氮吹仪 上海净信实业发展有限公司;8890B-5977B GC-MS联用仪 美国Agilent公司;TH2-D恒温振荡器 苏州培英实验设备有限公司。
1.3 方法
1.3.1 低盐虾酱的制作
挑选新鲜蜢子虾,清洗、沥水、称质量,捣碎后添加蜢子虾质量10%的食盐[6],分装于玻璃发酵容器中,用两层纱布封口,置于培养箱中进行恒温发酵。一批放于10 ℃恒温培养,另一批放于20 ℃恒温培养,当氨基酸态氮含量趋于稳定时视为发酵结束。发酵0 d的低盐虾酱被标识为S0,10 ℃发酵的低盐虾酱为低温组(L组),被标识为LX;20 ℃发酵的低盐虾酱为对照组(H组),被标识为HX;其中X表示虾酱发酵周数。
1.3.2 样品前处理
精确称取50 mg样本到2 mL离心管里,加入0.5 mL甲醇-水溶液(4∶1,V/V,含0.02 mg/mL的内标L-2-氯-苯丙氨酸)。加入一颗钢珠,放入-20 ℃研磨机中研磨(50 Hz,3 min)。加入200 μL氯仿,研磨机中研磨(50 Hz,3 min),超声提取30 min。-20 ℃静置30 min。4 ℃、15 000 r/min离心15 min,取上清液装入玻璃衍生瓶中,氮气吹干。向玻璃衍生小瓶中加入80 μL的甲氧胺盐酸吡啶溶液(15 mg/mL),涡旋振荡2 min后,于振荡培养箱中37 ℃肟化反应90 min。取出后再加入80 μL的N,O-双(三甲基硅烷基)三氟乙酰胺(含1%三甲基氯硅烷)衍生试剂,涡旋振荡2 min后,于70 ℃反应60 min。取出样本,室温放置30 min,进行GC-MS代谢组学分析。
1.3.3 GC条件
衍生化后样本用分流模式注入GC-MS系统进行分析,进样量1 µL,分流比10∶1。样品经DB-5MS毛细管柱(40 mh0.25 mm,0.25 µm)分离后进入质谱检测。进样口温度260 ℃,载气为高纯氦气,载气流速1 mL/min,隔垫吹扫流速3 mL/min,溶剂延迟5 min。升温程序:初始温度60 ℃,平衡0.5 min,然后以8 ℃/min升至310 ℃,并维持6 min。
1.3.4 MS条件
电子电离源;传输线温度310 ℃;离子源温度230 ℃;四极杆温度150 ℃;电子能量70 eV。扫描方式为全扫描模式,质量扫描范围m/z50~500,扫描频率3.2 scan/s。
1.4 统计学分析
采用MassHunter workstation Quantitative Analysis(v10.0.707.0)软件进行峰提取、对齐等数据预处理操作,最终得到代谢物鉴定结果及数据矩阵,结合t检验和VIP值筛选出差异代谢物。
2 结果与分析
2.1 低盐虾酱中代谢物的多元统计分析
2.1.1 不同温度发酵低盐虾酱的OPLS-DA
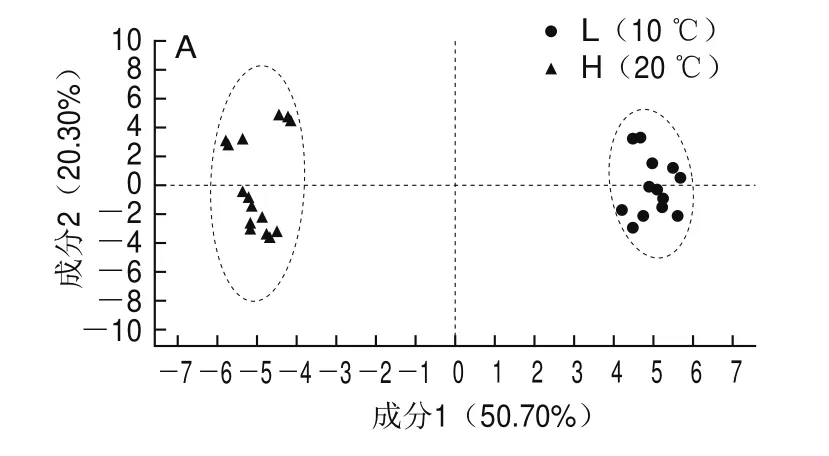
为了分析2种温度下低盐虾酱中的代谢物是否会产生明显的差异,使用正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)法分析2种处理下低盐虾酱样品之间的差异性,从而更好区分组间差异,结果如图1所示。

图1 不同温度下发酵低盐虾酱的OPLS-DA图(A)和置换检验图(B)Fig.1 OPLS-DA (A) and permutation test (B) plots of low-salt shrimp paste fermented at different temperatures
由图1A所示,2种不同温度下发酵的低盐虾酱能够被明显区分,证明温度能够明显影响微生物的代谢,使2 组样品间菌体代谢物种类和含量存在明显的差异[10]。对于OPLS-DA模型图,往往需要使用置换检验对模型的有效性进行验证,以防发生过度拟合现象导致模型出现偏差,在图1B中,和分别表示所建模型对X和Y矩阵的解释率,Q2标示模型的预测能力。、和Q2越接近1表示模型越稳定可靠,Q2>0.5表示模型的预测能力较好。在本次检验结果中,、和Q2值分别为0.709、0.992和0.989,证明该OPLS-DA模型有效,不存在过拟合现象。因此,对于分析不同温度下发酵的低盐虾酱之间代谢物的差异性准确。
2.1.2 不同温度发酵低盐虾酱代谢物PLS-DA
由图2可以看出,随着发酵时间的延长,2种温度下发酵的低盐虾酱代谢物大部分可以明显分开。由图2A所示,H组样品中原料S0中的代谢物能够明显与其他5个时间段的样品区分开;发酵4 周和8 周的样品与其他样品能够明显区分;在发酵中后期,第12、16周和第20周的虾酱样品并没有明显区分。这可能是因为刚开始发酵后菌种活力较高,微生物生物量增加导致代谢物变化较大,导致第4周和第8周的样品能够明显区分,而进入发酵中后期后,代谢物的变化速度降低,使发酵中后期样本区分不明显。由图2B所示,原料S0与5个取样点样品都能明显区分,第4、8周和第12周样品能够明显区分,这可能是因为在发酵前期,由于低温环境的影响,微生物菌种活力相对较低,但由于前期碳源较为充足,代谢物之间相互作用产生一些酯类和酚类等化合物,使代谢物能够明显区分[13]。在发酵后期第16周和第20周,由于能源物质基本被消耗,微生物发酵作用受到抑制,造成代谢物变化不明显,所以不能被很好区分。
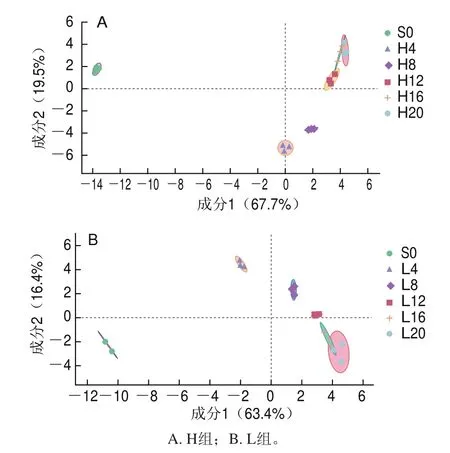
图2 不同温度发酵低盐虾酱代谢物的PLS-DA图Fig.2 Partial least squares discriminant (PLS-DA) plots of metabolites in low-salt shrimp paste fermented at different temperatures
2.1.3 不同发酵阶段低盐虾酱代谢物PLS-DA
为更加全面地了解不同温度下发酵的低盐虾酱代谢物的变化,对同一发酵阶段不同处理的虾酱中的代谢物进行PLS-DA,结果如图3所示。在发酵第0周时,2种低盐虾酱的代谢物并无差异。随着发酵的不断进行,2种低盐虾酱中的代谢物都能够被明显区分,这可能是因为发酵温度对于微生物活力有很大影响,导致微生物在发酵过程中能够产生不同的代谢物,从而能够很好地被区分开。
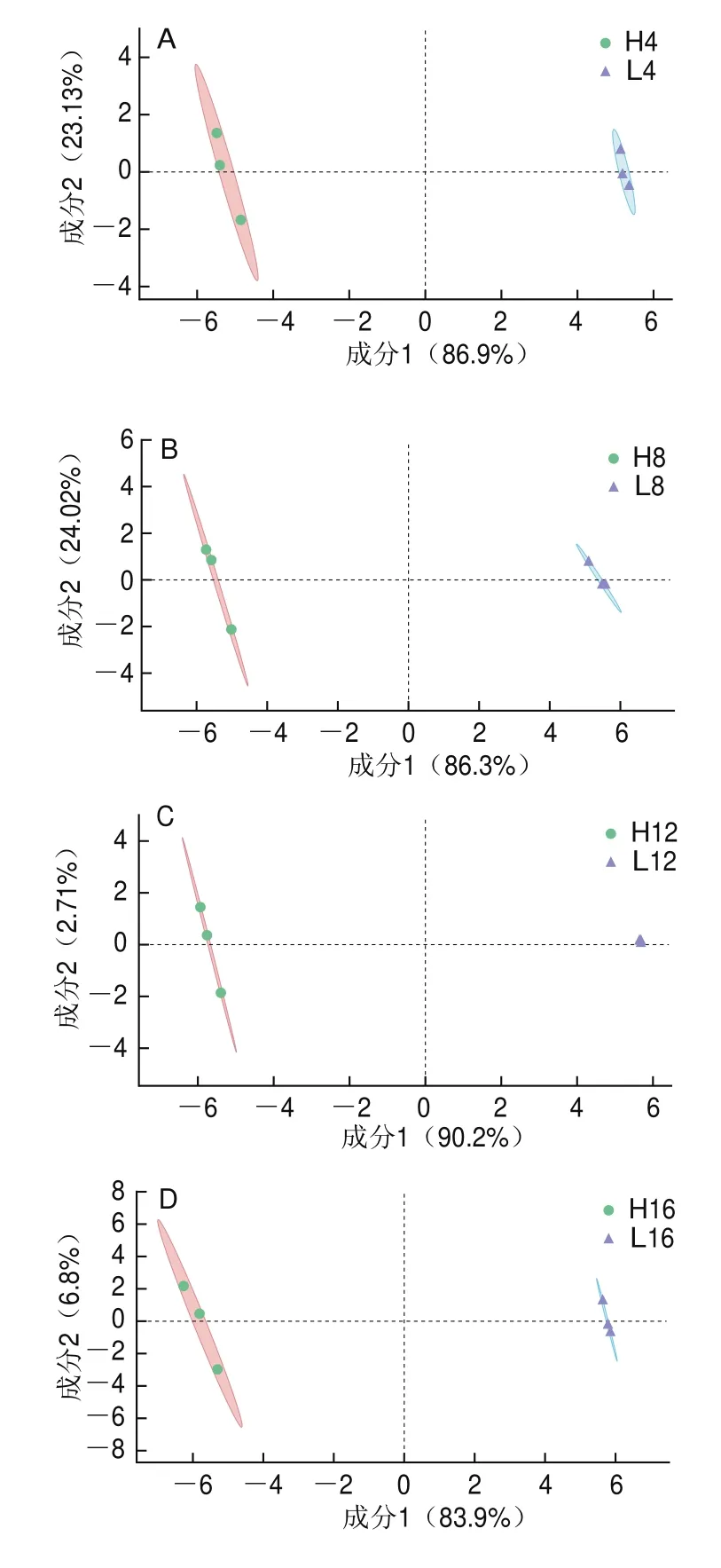

图3 不同发酵阶段的低盐虾酱代谢物的PLS-DAFig.3 PLS-DA plots of metabolites in low-salt shrimp paste at different fermentation stages
2.2 低盐虾酱中的主要代谢物分析
基于GC-MS的检测结果,对不同温度下发酵的两组虾酱中主要代谢物(组内不同发酵周数的总量)进行分析。2 组低盐虾酱中共有44种主要代谢物,包括氨基酸类16种、脂肪酸类6种、胺类2种、有机酸类8种、醇类3种、核苷酸类3种、其他类6种,表1列出部分主要代谢物。
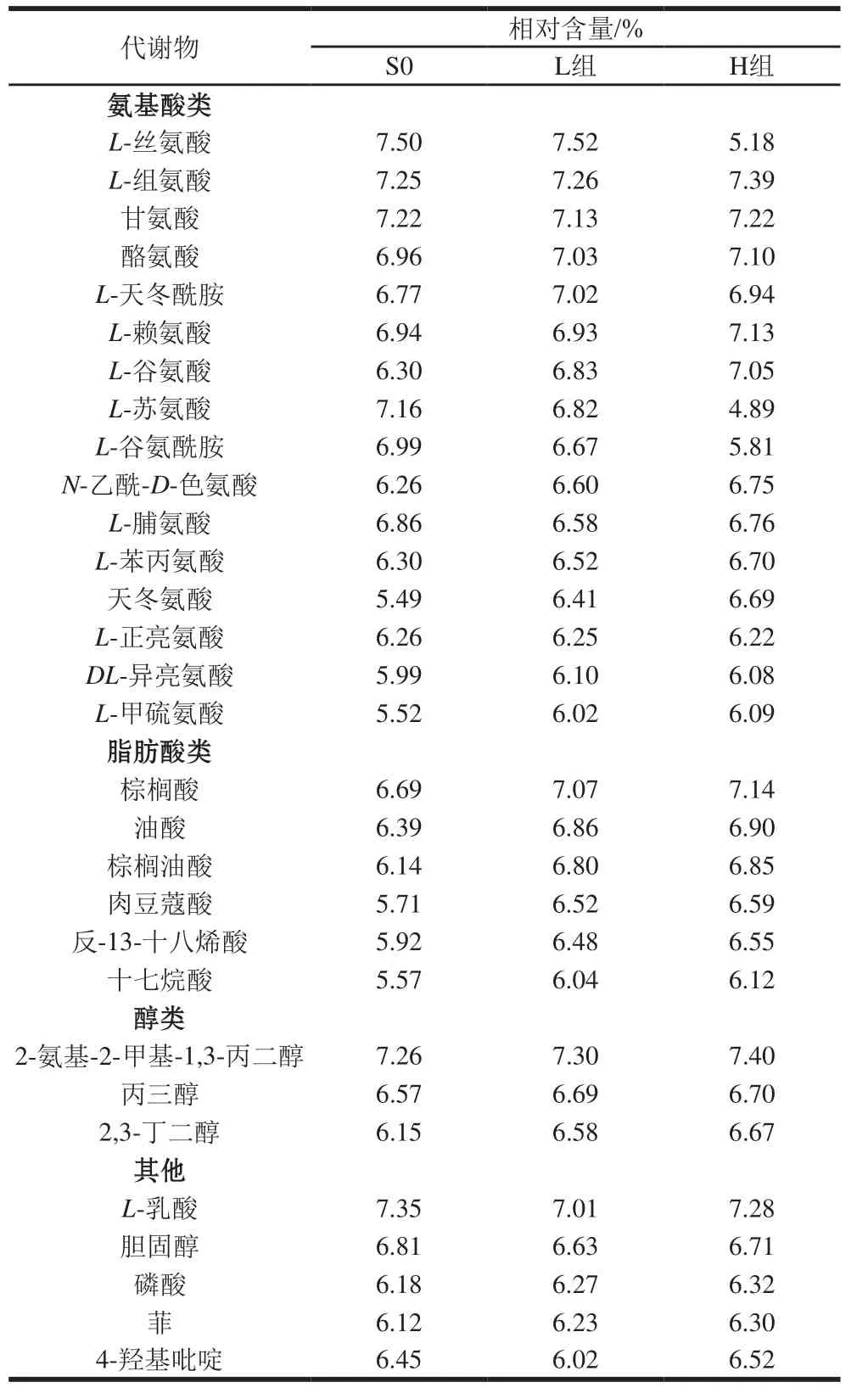
表1 不同温度下发酵虾酱中主要代谢物相对含量Table 1 Relative contents of major metabolites in shrimp paste fermented at different temperatures
氨基酸类物质是低盐虾酱中含量最丰富的代谢物,在虾酱发酵后有助于各种口味的形成,包括鲜味、甜味、苦味、酸味和咸味特征,而且还是低盐虾酱中重要的营养和风味前体物质,为发酵过程中的微生物生长提供氮源。实验检测到的主要氨基酸中,呈现甜味的氨基酸主要为甘氨酸、L-苏氨酸和L-丝氨酸。呈现苦味的氨基酸为L-苯丙氨酸和L-脯氨酸,呈现鲜味的氨基酸为天冬氨酸、L-谷氨酸和L-谷氨酰胺。这些氨基酸在低盐虾酱发酵过程中共同作用带给虾酱独特的风味[16]。
脂肪酸,尤其是长链多不饱和脂肪酸已被视为饮食中必需营养物质,对生物的生长、发育和繁殖至关重要。虾酱和其他类型的海洋来源食物是不饱和脂肪酸的良好来源。在2 组低盐虾酱中主要检测到6种脂肪酸,分别为棕榈酸、油酸、棕榈油酸、肉豆蔻酸、反-13-十八烯酸和十七烷酸。棕榈酸和肉豆蔻酸属于饱和脂肪酸,而油酸属于n-9不饱和脂肪酸。油酸有降血压和胆固醇的功效,同时也能降低心血管疾病的发病率,是人体良好的营养物质来源,食用富含油酸的食品有助于改善健康状况[17]。
有机酸是低盐虾酱中重要的组成部分,在原料虾中(S0)含有较少部分有机酸,在发酵过程中有机酸的含量有所升高。在低盐虾酱L-乳酸相对含量较高。L-乳酸在食品、制药、化妆品和其他化学工业中具有广泛的用途,其具有爽口的酸味,是发酵水产品中主要的有机酸类。但有机酸含量过高会导致低盐虾酱产品的酸化,对产品的品质造成不利影响,所以在发酵过程中更应该控制有机酸的过量产生。
2.3 低盐虾酱中的差异代谢物的筛选和分析
对2种温度下发酵的低盐虾酱中差异代谢物进行研究,通过聚类热图和VIP条形图,展示各差异组中代谢物在各样本中的表达模式和代谢物在多元统计分析的VIP值,以及单维统计中的P值,从而直观显示出差异代谢物的重要性和含量趋势变化,结果如图4所示。图4A中,颜色表示该代谢物在该组样本中相对表达量大小,红色越深表示该代谢物相对表达量越大,蓝色越深表示代谢物相对表达量越小。图4B中,条形长度表示该代谢物对2 组差异的贡献值,默认不小于1,值越大表示该代谢物在2 组间差异越大。
在本次差异代谢物筛选中,共筛选出40种差异代谢物,筛选出VIP值大于1且P值小于0.05的差异代谢物共30种(图4),VIP值从大到小排序为乙醇胺(VIP=3.11)、L-丝氨酸(VIP=2.91)、硫氰酸苄酯(VIP=2.86)、甘油酸(VIP=2.76)、2-乙基己酸(VIP=2.73)、乙酸橙花酯(VIP=2.62)、L-苏氨酸(VIP=2.56)、肌氨酸(VIP=2.53)等。在2种不同温度下发酵的低盐虾酱中,主要筛选出的差异代谢物为酯类、嘌呤类、酚类、胺类、有机酸类、酮类、醇类、氨基酸等。大多数被检测到的差异代谢物早已在发酵水产品中被鉴定出来,例如鱼酱和鱼露[18]。具有挥发性化合物在发酵过程中表现出动态变化,有些增加,而另一些出现下降趋势,这表示总体风味特征在整个发酵过程中也发生变化。
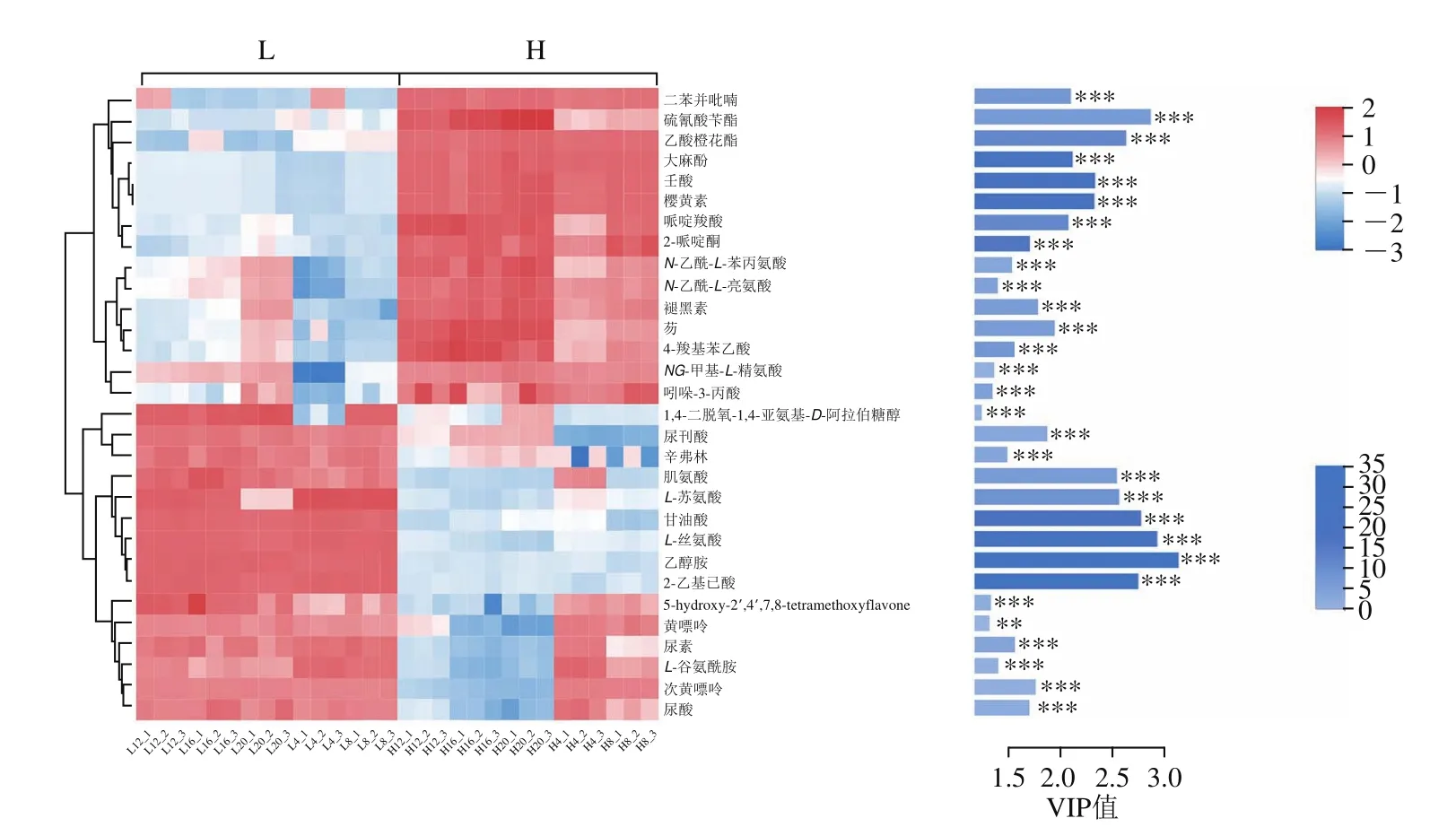
图4 不同温度下发酵低盐虾酱中差异代谢物的层级聚类分析热图Fig.4 Heatmap obtained by hierarchical clustering analysis of differential metabolites in low-salt shrimp paste fermented at different temperatures
酸类物质在低盐虾酱发酵过程中不仅有呈味作用,同时也能在发酵过程中对杂菌起到抑制作用,有的有机酸类还可以通过磷酸化参与糖酵解为细胞提供能量,虾酱中的酸类物质一部分来源于原料蜢子虾,另一部分来源于发酵过程中微生物代谢产生。本研究在差异代谢物检测中检测到的酸类物质有壬酸、哌啶羧酸、4-羟基苯乙酸和吲哚-3-丙酸。壬酸主要存在于H组虾酱中,其常作为精油的呈味物质,在食用香料方面有很高的利用价值。尿刊酸和甘油酸主要在L组中产生,甘油酸作为一种化学中间体,在日常生活中有很高的需求量,在食品中主要用于食品添加剂用于改善风味[19],同时能够进一步磷酸化后形成甘油酸3-磷酸,参与糖酵解提供细胞生长产生所需能量。尿酸在2种处理组虾酱中均被检测到,在L组发酵过程中均存在,但在H组虾酱样品只在第4周和第8周被检测到。尿酸是嘌呤代谢的终产物,同时也是痛风的主要原因。在L组含量高的原因可能是在发酵过程中黄嘌呤和次黄嘌呤含量较高,导致其代谢终产物中尿酸含量也有所增加。在对锦州虾酱挥发性成分进行检测时,发现主要酸类差异代谢物为乙酸和丁酸[20],乙酸的产生起源于乳酸菌的作用,丁酸在虾制品中提供奶酪香气,这与本研究结果不同,可能是因为原料来源和发酵条件不同导致。
酮类物质是通过微生物对脂质或氨基酸的酶促反应产生,主要为低盐虾酱提供甜的花香风味,其产生机理是由多不饱和脂肪酸经过氧化产生,同时也能通过降解氨基酸产生,对低盐虾酱的风味有十分重要的影响。研究发现其存在于鱼露中,有类似干酪的香气[21]。在低盐虾酱发酵过程中,主要存在于H组虾酱样品中的2-哌啶酮作为主要差异酮类代谢物被筛选出来。
糖类物质作为主要的碳源,在糖酵解过程中被消耗,通过碳水化合物代谢途径为微生物的生长提供必需的能量[22],本次在代谢物差异中所检测到的糖类物质的衍生物分别为1,4-二脱氧-1,4-亚氨基-D-阿拉伯糖醇和肌醇半乳糖苷。在L组虾酱中1,4-二脱氧-1,4-亚氨基-D-阿拉伯糖醇含量较H组更多,在L组发酵初期(第4周),1,4-二脱氧-1,4-亚氨基-D-阿拉伯糖醇含量很少,随着发酵时间的延长1,4-二脱氧-1,4-亚氨基-D-阿拉伯糖醇含量增加,在之后整个发酵过程中都能被检测到,在H组虾酱中只在第20周检测到了1,4-二脱氧-1,4-亚氨基-D-阿拉伯糖醇。
嘌呤类化合物是细胞中最为丰富的代谢物,对于提供细胞能量和细胞内信号传导起十分重要的作用[12]。本次检测到的嘌呤类差异化合物有黄嘌呤和次黄嘌呤,黄嘌呤是嘌呤降解途径的产物,并且能够在黄嘌呤氧化酶的作用下生成尿酸,这是L组中尿酸含量大于H组的原因。次黄嘌呤别名为6-羟基嘌呤,可通过进一步分解得到黄嘌呤,黄嘌呤形成后经过参与代谢转化得到终产物甘氨酸[23]。
氨基酸不仅是代谢过程中必需的,而且还是有益的前体物质。氨基酸主要来自发酵过程中细菌中的蛋白酶对原料中蛋白质的酶促降解以及酵母和其他微生物的自溶作用。虾酱中氨基酸含量十分丰富。氨基酸不仅可以为微生物的生长提供氮源,还可以为虾酱增加鲜味。氨基酸是虾酱发酵过程中不可缺少的成分之一,具有多种味感,例如鲜味、甜味、苦味、酸味和咸味。在发酵过程中,一些氨基酸被酵母用作营养素,一些被转化为高级醇,对于虾酱的风味及感官品质的形成具有十分重要的作用。对2 组虾酱差异代谢物的筛选中,发现肌氨酸、L-苏氨酸、L-丝氨酸、N-乙酰-L-苯丙氨酸、N-乙酰-L-亮氨酸、N-甲基丙氨酸和L-谷氨酰胺。其中亮氨酸、苏氨酸和苯丙氨酸是3种人体必需氨基酸,苯丙氨酸也是鲜味氨基酸的一种。在低盐虾酱发酵过程中,肌氨酸、L-苏氨酸、L-丝氨酸只在L组被检测到,在H组中并没有表达量。L-苏氨酸作为人体生长必需的氨基酸,具有十分重要的作用,如促进生长,提高免疫机能等,在L组低盐虾酱发酵前期(第4、8周)含量达到了最大值,随着发酵时间的不断延长含量逐渐降低,到第20周时,L-苏氨酸含量几乎减少为0,但在H组中从始至终未表达。肌氨酸在人体中的存在形式是磷酸肌酸,可作为能量来源。在L组整个发酵过程中,肌氨酸一直被检测到,但在H组中,只在发酵早期(第4周)检测到肌氨酸。L-丝氨酸不仅是构成天然蛋白质的底物而且是生物体内重要的能源构成部分[24]。在整个发酵过程中,L组样品均检测到了L-丝氨酸,而H组样品在整个过程中并未检测到。N-乙酰-L-苯丙氨酸、N-乙酰-L-亮氨酸和N-甲基丙氨酸在H组发酵过程中均被检测到,但在L组样品中,只在发酵末期(第20周)有较低的含量。
樱黄素、褪黑素和辛弗林也被鉴定2 组低盐虾酱样品中差异代谢物。樱黄素是从几种植物中提取的异黄酮类中的一种代表性O-甲基化类黄酮[25]。该化合物已显示出许多有益的活性,如抗炎、抗肥胖、应激反应以及调节蛋白水解活性[26]。同时也发现樱黄素具有抗肥胖的潜力,并参与人类肝脏中醛脱氢酶的抑制[27]。在整个发酵过程中,樱黄素只在H组中被检测到,在L组样品中并未表达。褪黑素是一种亲脂性和亲水性的吲哚类化合物,由于其代谢物具有抗氧化性,故认为褪黑素具有级联抗氧化效应,在人体和动物体内具有增强人体免疫力和抗氧化能力[28]。褪黑素在2 组低盐虾酱样品中均被检测到,在整个发酵阶段中,H组每个阶段都检测到该样品,而在L组样品中,褪黑素只在发酵末期(第20周)被检测到,且表现出较低的含量。辛弗林属于生物碱中麻黄碱类的一种,在中药中常用作减肥促进剂,其作用机理是对肾上腺素受体进行刺激而产生热量。在整个发酵过程中,L组样品中各个阶段均检测到辛弗林,而在H组中并不是每个阶段低盐中都能检测到辛弗林,而只在发酵后期(第16、20周)检测出较低的含量。
锦州虾酱样品中,醛类(46.34%)和酸类(35.99%)是虾酱样品中的主要挥发性成分[20],但在本研究中,醛类物质并不是主要差异代谢物,除此之外还在低盐虾酱样品中发现了酯类差异代谢物,主要是硫氰酸苄酯和乙酸橙花酯,酯类物质也是发酵产品中主要的挥发性风味物质之一,H组样品中,2种酯类化合物含量均高于L组样品,乙酸橙花酯是一种源于橙花基焦磷酸的单萜类衍生物,广泛存在于植物精油中[29-30]。乙酸橙花酯是橙花香和玫瑰香气的来源,已广泛应用于许多领域[31]。在食品工业中,乙酸橙花酯已被食品药品监督管理局重新认可并批准为安全的食品调味剂。乙酸橙花酯具有抗菌性能,可以用作食品防腐的潜在抗菌剂[32]。此外,乙酸橙花酯也被欧洲食品安全局评估为一种安全的调味食品,可用于所有动物的饲料。在2 组不同温度下发酵的低盐虾酱中,乙酸橙花酯主要在H组中被检测到,在L组中未检测到较高含量。
2.4 低盐虾酱中的差异氨基酸分析
如图5所示,在低盐虾酱发酵过程中,涉及到许多微生物产生各种蛋白酶进行蛋白质分解,从而释放出不同种氨基酸,对提高发酵食品的感官特性有十分重要的作用。众所周知,许多氨基酸和小肽可以起到增味剂的作用,使食物中的鲜味、甜味、咸味和浓香味得以体现。大部分氨基酸有D型和L型2种对映体,其中L型氨基酸是构成天然蛋白质底物和生物体内重要的能源供给部分[24],主要的4种氨基酸类差异代谢物中,L组虾酱中L-丝氨酸、L-苏氨酸、L-谷氨酰胺和肌氨酸含量高于H组虾酱,这说明L组虾酱中氨基酸营养成分高于H组。L-丝氨酸和L-苏氨酸是人体细胞重要的能源之一,L-丝氨酸是人体非必需氨基酸,仅在胶质细胞(主要是星形胶质细胞)中通过糖酵解中间体3-磷酸甘油酸的代谢途径而形成。这种代谢途径被称为磷酸化途径,通过3种酶促反应将3-磷酸甘油酸转化为L-丝氨酸[32]。具有抑制大鼠神经细胞凋亡的作用[33]。L-苏氨酸是人体必需氨基酸,主要存在于血红蛋白,胰岛素和乳球蛋白中[34],在畜牧营养研究中具有增强机体免疫力等作用[35]。L-谷氨酰胺是人体中最丰富的氨基酸之一,是由内源性酶对蛋白质进行分解而产生的小分子化合物,除了在蛋白质合成中发挥重要作用外,L-谷氨酰胺还能参与合成烟酰胺腺嘌呤二核苷酸,从而减少镰状红细胞与内皮细胞的黏附,是血管闭塞性疼痛危机的标志[34]。同时L-谷氨酰胺能够增加鸡肠道黏膜免疫机能[36]和缓解人体急性酒精肝损伤[37]。
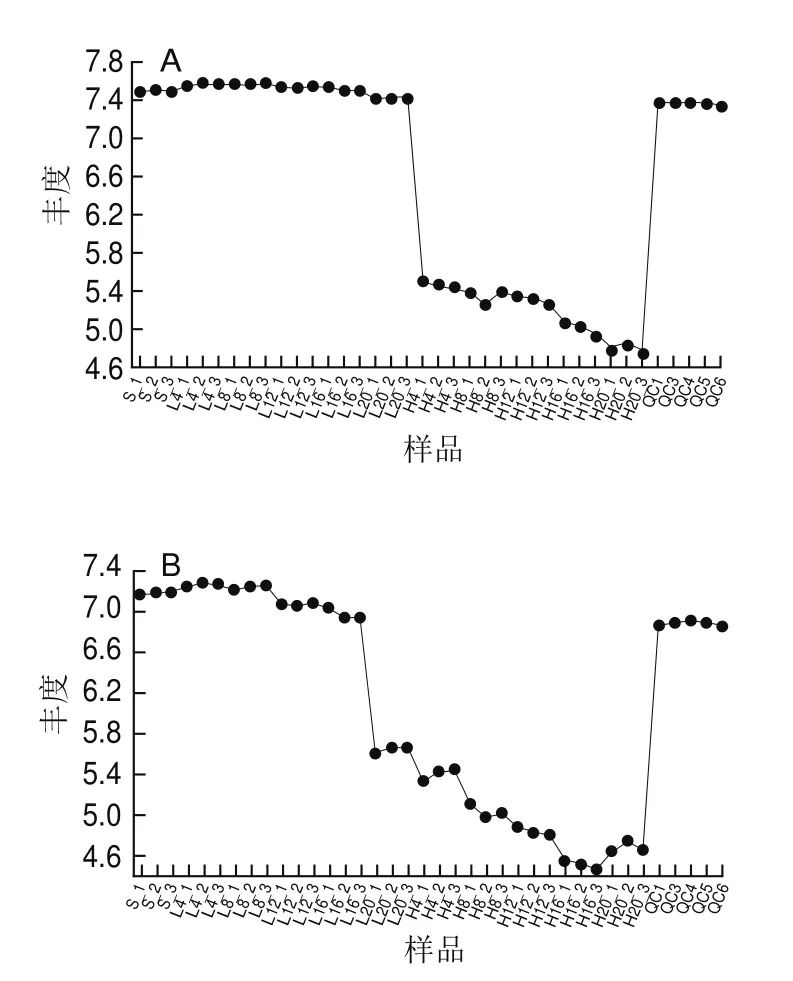
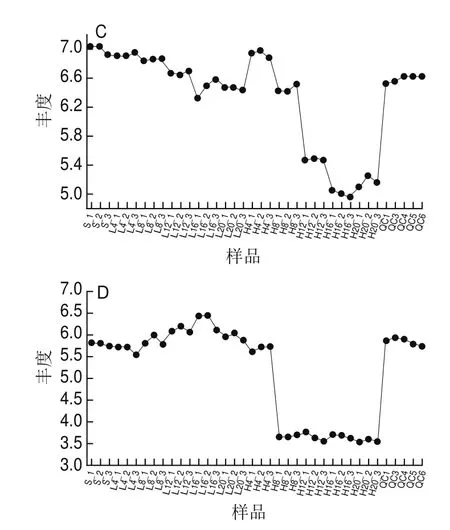
图5 低盐虾酱中差异氨基酸分析Fig.5 Analysis of differential amino acids in low-salt shrimp paste
综上所述,在10 ℃发酵的低盐虾酱中氨基酸含量大于常温发酵的低盐虾酱,与传统虾酱相比,低盐虾酱中含盐量降低,氨基酸态氮含量升高,提高了虾酱的品质[38]。结合其他指标看,本研究的低盐虾酱产品不仅是一个健康产品同时也符合人类绿色健康生活理念。
3 结 论
利用GC-MS技术对低盐虾酱发酵过程中的代谢物进行监测分析。结果表明,温度对低盐虾酱中的代谢物有明显影响。通过PLS-DA结果发现,10 ℃和20 ℃发酵的低盐虾酱中代谢物均能在第4、8周明显分开,说明这些代谢物有显著差异。2种温度下发酵的低盐虾酱中代谢物主要为氨基酸类和脂肪酸类物质。基于VIP值大于1且P值小于0.05共筛选出30种差异代谢物,主要为氨基酸类、有机酸类、酯类、嘌呤类和醇类物质。与20 ℃发酵的低盐虾酱相比,10 ℃发酵低盐虾酱中L-丝氨酸、L-苏氨酸、L-谷氨酰胺、肌氨酸和嘌呤类化合物含量较高,而酯类物质含量较少。与传统虾酱相比,10 ℃发酵的低盐虾酱不仅含盐量降低,而且营养特性较高。本研究有助于低盐虾酱发酵过程中代谢物的变化和差异,为低盐虾酱的生产提供一定的理论依据。
