黑木耳多糖的磷酸化修饰、结构表征及体外降糖活性
2022-05-09陈玥彤张闪闪李文意于文浩赵晓芳刘婷婷
陈玥彤,张闪闪,李文意,于文浩,赵晓芳,刘婷婷,*
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.吉林省粮食精深加工与高效利用工程研究中心,吉林 长春 130118;3.吉林省粮食精深加工与副产物高效利用技术创新重点实验室,吉林 长春 130118;4.农业农村部食用菌加工技术集成科研基地,吉林 长春 130118)
黑木耳(Auricularia auricula)是我国重要的药食同源真菌,其中多糖为其主要的活性成分,高达70%以上[1]。相关研究表明黑木耳多糖具有抗氧化[2]、抗癌[3]、提高免疫[4]等多种功能活性,其生物活性取决于它们的结构特征,包括单糖组成、糖苷键类型、分支结构和构象特征等[5]。目前相比于多糖的物理修饰,化学修饰(例如硫酸盐修饰、磷酸盐修饰、羧甲基修饰等)更能提高其生物活性[6]。其中磷酸化修饰是多糖支链结构中羟基被游离的磷酸根基团取代的过程,由于磷酸根带3个负电荷,通过增强多糖的电负性影响多糖的某些活性[7]。Chen Ling等[8]将南瓜多糖进行磷酸化修饰,发现磷酸化可使其体外抗氧化活性增强。Deng Chao等[9]报道磷酸化处理可扩展多糖的链构象,明显增强其抗肿瘤活性。此外,大量研究表明抗氧化活性往往与降血糖作用具有一定的相关性,对食用菌多糖进行磷酸化修饰有助于推动降血糖等诸多领域的应用。
调查显示,我国目前有9 300万糖尿病患者[10]。糖尿病是指一组以高血糖水平长期维持为特征的代谢性疾病[11],市场上用于糖尿病的降糖药物主要为双胍类、阿卡波糖和沃格利波糖,这些药物虽然可增加葡萄糖的储存或抑制α-葡萄糖苷酶、α-淀粉酶的活性,但也有一定的副作用,如肠胃气胀和腹泻等[12]。相关研究表明,食用菌多糖是治疗糖尿病的有效途径。但有关磷酸化修饰多糖降血糖活性研究却鲜有报道。因此,本实验以黑木耳多糖为原料进行磷酸化修饰,并对其结构及体外降血糖活性进行表征与评价,以期为黑木耳高值化利用和新型功能性食品的开发提供参考。
1 材料与方法
1.1 材料与试剂
黑木耳 吉林省博林生物科技有限公司;葡聚糖标准品 瑞典Pharmacia公司;α-葡萄糖苷酶、α-淀粉酶、4-硝基苯-α-D-吡喃葡萄糖苷 上海源叶生物科技有限公司;三偏磷酸钠(sodium trimetaphosphate,STMP)、三聚磷酸钠(sodium tripolyphosphate,STPP)、浓硝酸、三羟甲基氨基甲烷、钼酸铵、无水乙醇、三氯甲烷等均为分析纯。
1.2 仪器与设备
IR Prestige-21傅里叶红外光谱仪、SSE-550扫描电子显微镜 日本岛津公司;UV210紫外-可见光分光光度计美国Unico公司;1515型高效液相色谱仪 美国Waters公司;AV600核磁共振仪 德国Bruker公司。
1.3 方法
1.3.1 黑木耳多糖的制备
称取5 g 120 目黑木耳粉,料液比1∶70(g/g),高压反应釜内提取(1.0 MPa、110 ℃、60 min),离心,Sevag法脱蛋白(6次),经凯氏定氮法测定蛋白含量为5%以下时进行浓缩、醇沉、冻干即为黑木耳多糖,记为AAP。
1.3.2 磷酸化黑木耳多糖的制备
参照Duan Zhen等[13]的方法,略作修改。分别称取5 g STPP、2 g STMP溶解于超纯水中,配制70 mg/mL的磷酸化试剂。加入AAP 1 g、硫酸钠5 g,溶解后调节pH值至9.0,分别在60、70、80、90 ℃反应5 h。样液透析(8 000~14 000 Da)48 h后,浓缩冻干即为磷酸化黑木耳多糖,记为PAAP-1、PAAP-2、PAAP-3、PAAP-4。
1.3.3 磷酸化黑木耳多糖结构测定
1.3.3.1 磷酸根含量的测定
采用钼蓝比色法[14]测定,取5 mL样液通过标准曲线测定其磷酸根含量。
1.3.3.2 分子质量测定
将2.0 mg/mL AAP及PAAP-(1~4)多糖溶液经0.45 μm滤膜过滤,然后注入高效凝胶渗透色谱仪。测试条件:高效液相色谱仪Ultrahydrogel 500、Ultrahydrogel 2000色谱柱(7.8 mmh300 mm);示差折光检测器;流动相为0.1 mol/L超纯水;流速0.5 mL/min;柱温和检测器温度均为35 ℃,进样量25 μL[15]。
1.3.3.3 单糖组成测定
多糖的衍生:将水解干燥后的AAP及PAAP-(1~4)加入1 mL吡啶,1 mL硅烷化试剂,于70 ℃恒温干燥箱中反应30 min。
气相色谱条件:色谱柱为DB-17(30 mh0.25 mm,0.25 μm),进样口温度280 ℃,氢火焰离子化检测器温度300 ℃,载气为氮气,柱压73.0 kPa,柱流量1.00 mL/min,分流比10∶1,进样量1 μL[16]。
1.3.4 磷酸化多糖的结构测定
1.3.4.1 紫外光谱分析
将AAP与PAAP-(1~4)分别配制成1 mg/mL溶液置于比色皿中,在190~400 nm波长范围内扫描[17]。
1.3.4.2 刚果红实验
称取5 mg多糖纯品AAP、PAAP-(1~4)溶解于2 mL超纯水中,取2 mL刚果红(80 μmol/L)溶液与不同体积的1 mol/L NaOH溶液配制为0、0.1、0.2、0.3、0.4、0.5 mol/L的NaOH溶液。采用紫外-可见光分光光度计在波长400~600 nm范围内记录最大吸收波长[18]。
1.3.4.3 红外光谱分析
分别称取2 mg AAP及PAAP-(1~4)与200 mg烘干至恒质量的KBr研磨均匀,压片,收集范围为4 000~400 cm-1的红外光谱[19]。
1.3.4.4 扫描电镜测定
取一定质量的AAP及PAAP-(1~4)纯品平铺于导电胶,吹去未粘住的多糖粉末,放入离子溅射仪真空喷金30 s,再将样品置于电子显微镜下(1h10-5Pa、20 kV)观察,选取合适区域拍照[20]。
1.3.4.5 核磁共振波谱分析
取AAP及PAAP-(1~4)以D2O为溶剂加入到核磁管中,在600 MHz核磁共振谱仪上测定,探针温度为60 ℃;扫描次数16次;空扫次数0次;脉冲角度30°;弛豫延迟时间1.0 s[21]。
1.3.5 磷酸化多糖体外降血糖活性测定
1.3.5.1 抑制α-淀粉酶活性
采用DNS比色法[22]测定,对AAP及PAAP-(1~4)进行α-淀粉酶抑制活性的测定,按式(1)计算抑制率:

式中:A0为以等体积蒸馏水取代待测溶液吸光度;A1为以等体积磷酸盐缓冲液取代α-淀粉酶溶液吸光度;A2为以等体积蒸馏水和磷酸盐缓冲液分别取代待测溶液和α-淀粉酶溶液吸光度。
1.3.5.2 抑制α-葡萄糖苷酶活性
参照张梦晴[23]的方法,对AAP及PAAP-(1~4)进行α-葡萄糖苷酶抑制活性的测定,按式(2)计算抑制率:

式中:A1为样品吸光度;A0为以磷酸盐缓冲溶液代替多糖溶液的吸光度;A2为测定磷酸化黑木耳多糖溶液反应体系的吸光度。
1.4 数据处理与统计分析
结果以 fs表示,采用SPSS 20软件对数据进行统计分析,利用Origin 8.0软件绘图。
2 结果与分析
2.1 磷酸化多糖的理化性质及结构表征
2.1.1 黑木耳多糖磷酸根含量的测定结果
黑木耳多糖中磷酸根含量作为磷酸化修饰程度的评价指标,其生物活性取决于磷酸根含量的多少[24]。由表1可以看出,磷酸根含量随反应温度的升高逐渐递增,在90 ℃时磷酸根质量分数为8.49%。这是因为能量的升高会使高分子键的活性增强,磷酸化试剂的利用率也会随之增加。

表1 不同温度修饰下黑木耳多糖磷酸根含量Table 1 Phosphate contents of A.auricularia polysaccharides modified at different temperatures
2.1.2 相对分子质量测定结果
多糖的生物活性与分子质量之间相互关联,因此对AAP及PAAP-(1~4)相对分子质量进行测定。由表2可以看出,PAAP的相对分子质量明显低于AAP。低分子质量多糖通过抑制肠道内碳水化合物的降解对α-淀粉酶和α-葡萄糖苷酶产生抑制作用[25],这也为修饰后黑木耳多糖降血糖活性升高提供理论依据。随温度升高磷酸化黑木耳多糖相对分子质量明显降低,其多分散指数接近1,说明AAP及PAAP的平均相对分子质量分布集中,纯度较高。
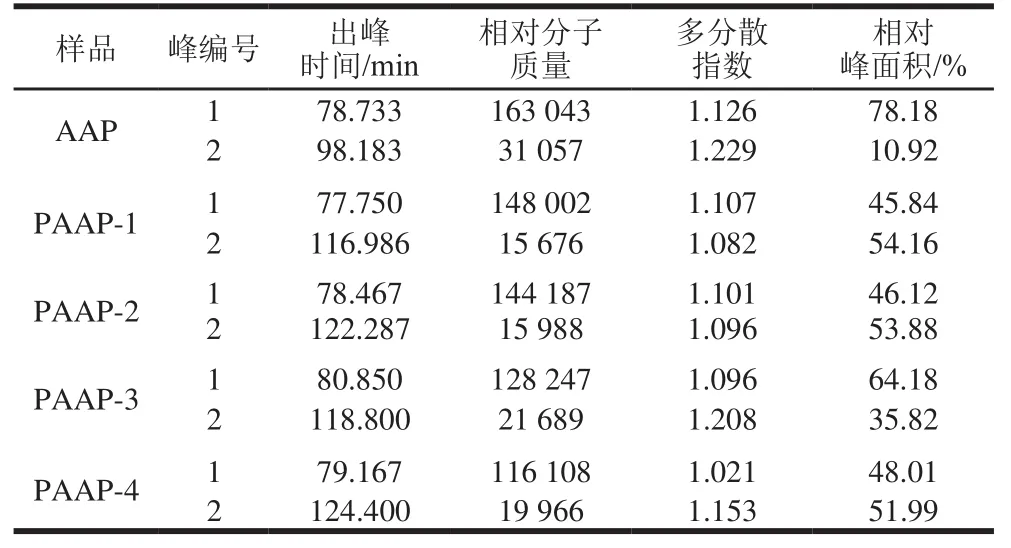
表2 AAP及PAAP-1、PAAP-2、PAAP-3、PAAP-4的高效凝胶渗透色谱测定结果Table 2 Results of HPGPC analysis of AAP, PAAP-1, PAAP-2,PAAP-3 and PAAP-4
2.1.3 磷酸化多糖的单糖组成
如图1所示,利用高效液相色谱分析,与标准单糖衍生后的保留时间进行对比,AAP主要是由Rib、Fuc、Xyl、Fru、Man、Gal、Glu组成的杂多糖,其构成单糖基的物质的量比为0.6∶0.41∶1.1∶1.18∶19.72∶0.74∶18.09。PAAP-(1~4)主要由Fuc、Xyl、Fru、Man、Gal、Glu组成的杂多糖,虽其相互间具有相似的单糖组成,但构成单糖基的物质的量比有所差异,分别为0.57∶1.31∶1.31∶13.03∶1.18∶27.78(PAAP-1),0.27∶2.03∶2.14∶20.62∶0.57∶18.04(PAAP-2),0.43∶1.55∶2.01∶14.06∶0.73∶20.69(PAAP-3),0.36∶0.52∶1.42∶1.62∶20.35∶0.94∶22.88(PAAP-4)。


图1 标准单糖(a)与AAP(b)、PAAP-1(c)、PAAP-2(d)PAAP-3(e)和PAAP-4(f)的色谱图Fig.1 GC chromatograms of mixed standards of monosaccharides (a)as well as AAP (b), PAAP-1 (c), PAAP-2 (d), PAAP-3 (e), and PAAP-4 (f)
2.1.4 紫外光谱分析
图2显示AAP及PAAP-(1~4)在260 nm和280 nm波长处均无明显的吸收峰,因此可以说明黑木耳多糖及磷酸化修饰多糖核酸和蛋白质含量较低。黑木耳多糖经修饰后形成了化学键束缚,从而导致紫外吸收强度有所减弱,其峰值明显降低。
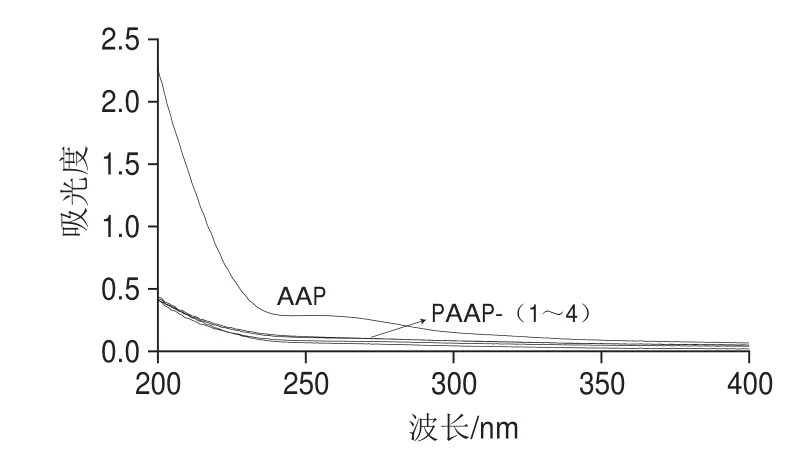
图2 AAP及PAAP-(1~4)的紫外光谱扫描Fig.2 Ultraviolet absorption spectra of AAP and PAAP-1, 2, 3 and 4
2.1.5 刚果红实验
刚果红有序的螺旋构象可与多糖结合形成络合物,通过紫外-可见最大吸收波长是否红移测定有无三股螺旋结构。相关文献表明,多糖的构象以螺旋形式存在时,将发挥较为关键的功能活性,其螺旋结构中存在的β-1,3-分支残基,可提高抗氧化及抗肿瘤活性[26]。如图3可知,AAP与刚果红对照组相比无明显差异,但多糖经磷酸化修饰后,磷酸根发生了取代反应在低NaOH浓度下最大吸收波长极具增加,说明其发生了分子间作用力变化,具有三股螺旋结构。因此可以猜测,磷酸化黑木耳多糖与β-1,3-糖苷键形成三螺旋构象时可提高多糖的生物活性,为后续体外降糖研究提供结构基础。

图3 不同NaOH浓度下刚果红和AAP、PAAP-(1~4)紫外-可见光最大吸收波长变化Fig.3 Maximum absorption wavelengths of Congo red and AAP,PAAP-1, 2, 3 and 4 under different NaOH concentrations
2.1.6 红外光谱分析
如图4可以看出,AAP及PAAP吸收峰为典型的多糖吸收峰[27],黑木耳多糖修饰前后主体结构没有发生改变。在3 336 cm-1处吸收峰主要是由OüH所引起,磷酸化修饰后吸收峰明显增强,这是由于修饰后的氢键和主链长度被破坏,暴露出更多的氢键和烷基键。取代的磷酸根带有2个—OH,增加了修饰后多糖的—OH个数,从而增加了其水溶性,使其具有更强的活性。2 921 cm-1附近处AAP及PAAP出现的中等强度吸收峰归属于CH2不对称伸缩振动,1 617 cm-1处的弱吸收峰归因于C=O振动。不同的是磷酸修饰后多糖在1 205 cm-1附近处出现P=O键的伸缩振动吸收峰,在898 cm-1附近处出现PüOüC键的特征吸收峰,这是由于羟基转化为磷酸基团所导致,因此可以表明磷酸化多糖修饰成功。
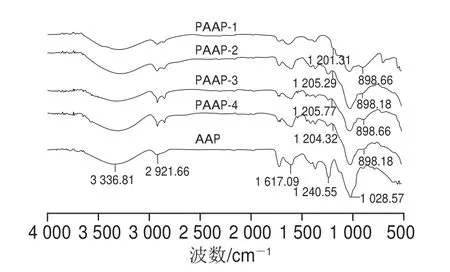
图4 AAP和PAAP-(1~4)的红外光谱扫描Fig.4 IR spectra of AAP and PAAP-1, 2, 3 and 4
2.1.7 扫描电镜分析
由图5所示,AAP的主要形态为表面均匀的致密片层结构,碎片大且平整光滑,无卷曲,部分出现堆积现象。这说明AAP的分子质量偏大,形态均一,分子间作用力大。PAAP-(1~4)的扫描电镜图与AAP相比呈细小碎片状,随温度的升高磷酸化多糖呈现蜷曲状,说明其分子间作用力降低,氢键作用力减小与红外推测相吻合。同时与党参多糖修饰前表面光滑,有不规则和交错的条纹,而修饰后表面粗糙不平,且有很多凸起的球体结果相似[28]。磷酸化修饰改变了多糖的空间形态,这与其与生理活性密切相关[29]。


图5 AAP及PAAP-(1~4)扫描电镜图Fig.5 SEM micrographs of AAP and PAAP-1, 2, 3 and 4
2.1.8 核磁共振分析
PAAP-4的磷酸根含量较高,因此选取PAAP-4进行核磁测定。因磷酸盐为弱电子吸收基团,磷酸化衍生物的13C核磁共振与非衍生多糖相似[30]。由图6可以看出,AAP的C3、C5、C2、C4在δ69~76处,δ60.46为C6的化学位移,经磷酸化修饰后,C6的化学位移向低场移动至δ69.27,这与碳信号附着在吸电子的磷酸基上时,会向低场移动结果一致。由此表明磷酸化修饰在C6位置上发生了取代反应。
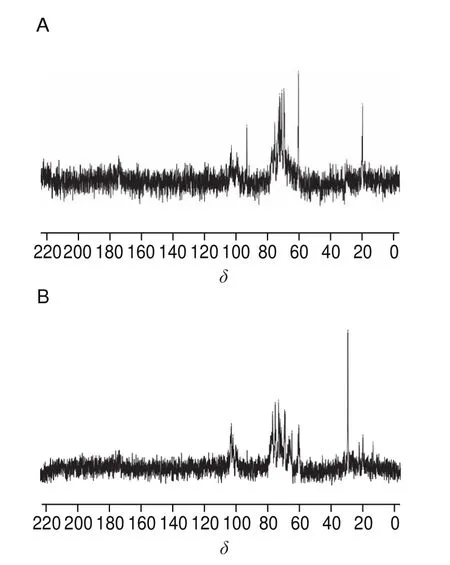
图6 AAP(A)与PAAP(B)13C核磁共振谱图Fig.6 13C NMR spectra of AAP (A) and PAAP (B)
利用31P核磁共振进行谱图分析,如图7所示,相比AAP,PAAP在δ0.94、-8.19处出现新的信号峰,说明多糖中有2个不同位置的羟基被磷酸基取代,进一步验证磷酸化修饰成功。

图7 AAP(A)与PAAP(B)31P核磁共振谱图Fig.7 31P NMR spectra of AAP (A) and PAAP (B)
2.2 磷酸化多糖体外降血糖活性
2.2.1α-淀粉酶抑制率
α-淀粉酶能够催化淀粉、糖原和低聚糖α-1,4-糖苷键的水解,将二糖转化为单糖,导致餐后血糖水平急剧升高[31]。由图8可知,在质量浓度为5 mg/mL时,PAAP-4和AAP的抑制率分别为41.08%和31.47%,PAAP-4较AAP的抑制率提高了10.03%,二者的IC50分别为5.835、3.038 mg/mL,可知同条件下,PAAP-4对α-淀粉酶的抑制能力达AAP样液的1.92 倍。可有效通过抑制α-淀粉酶活性从而抑制高聚糖的分解,达到降血糖目的[32]。
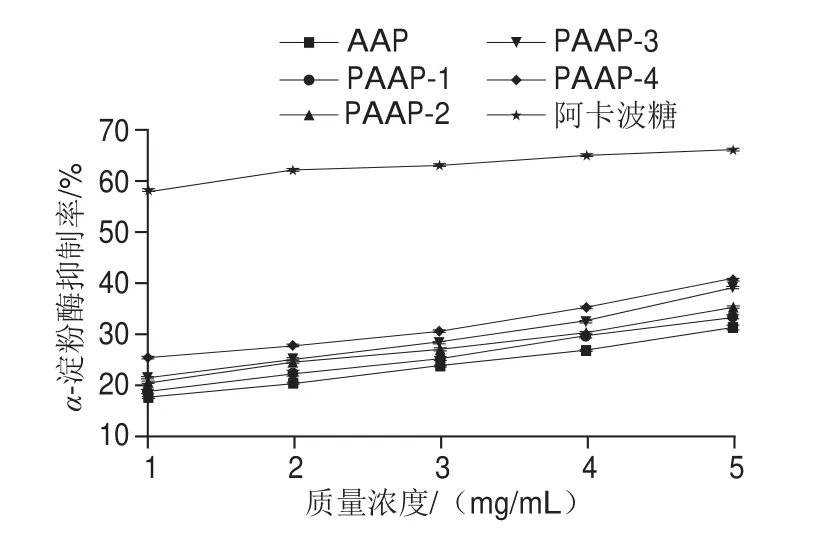
图8 AAP及PAAP-(1~4)对α-淀粉酶的抑制率Fig.8 Inhibition rates of AAP and PAAPs on α-amylase
2.2.2α-葡萄糖苷酶抑制率
研究表明多糖与酶的结合导致α-葡萄糖苷酶的极性和分子构象发生变化,部分酶活性丧失[32]。由图9可知,随着AAP及PAAP-(1~4)质量浓度的升高,α-葡萄糖苷酶的抑制率也随之增加。质量浓度为5 mg/mL时,PAAP-4和AAP的抑制率分别为56.89%和47.88%,PAAP-4较AAP的抑制率提高了9.01%,二者的IC50分别为27.22、10.66 mg/mL,可知同条件下,PAAP-4对α-葡萄糖苷酶的抑制能力达到AAP样液的2.55 倍。

图9 AAP及PAAP-(1~4)对α-葡萄糖苷酶的抑制率Fig.9 Inhibitory effects of AAP and PAAPs on α-glucosidase
3 结 论
对加压剪切联合萃取的黑木耳多糖进行磷酸化修饰,当反应温度为90 ℃修饰下磷酸根含量最高,为8.49%。红外光谱显示黑木耳多糖修饰后出现了磷酸基团的特征峰,修饰后多糖相对分子质量明显下降,刚果红实验表明修饰后黑木耳多糖出现三股螺旋结构。核磁共振光谱分析结果表明磷酸化修饰主要发生在C6位的羟基上,且在δ0~1.5处出现了磷酸基团中P的信号峰。扫描电镜显示不同温度下磷酸化多糖出现卷曲现象,相比修饰前呈现细小碎片状,与相对分子质量结果相吻合。体外降糖实验结果表明不同修饰后磷酸化多糖较未修饰前均具有更强的体外降血糖活性。在质量浓度为5 mg/mL时,PAAP-4活性最高且对α-葡萄糖苷酶和α-淀粉酶抑制率分别为56.89%和41.08%。黑木耳多糖经过磷酸化修饰后其分子结构发生了衍生,磷酸化后的供氢能力增加从而降糖活性发生改变。以上为进一步研究磷酸化黑木耳多糖提供了理论依据,但目前磷酸化黑木耳多糖的降血糖作用机理还不明确,仍需进一步探讨研究。
